2020-08-05


陆勇从2004年开始做印度格列卫“代购”,而以他为原型的电影《我不是药神》在2018年上映后,收获了极高的话题度。
究其原因,是由重症或罕见病病患用药难得保障的现实引起的共鸣。
20世纪初,对这些患者来讲,国内的药企尚不能供给续命的药,摆在他们面前的只有两个选择:花大价钱买经过国家药监局批准的进口原研药,要么就等死。毕竟像陆勇确诊之初服用的格列卫,一粒药就要200块,一天就是800多元。
从企业角度来看,“10年10亿美元”研发的一款药,专利保护期只有短短20年,药价低不得,因为“研发投入往往会占到销售收入的20%以上”,有业内人士告诉虎嗅。
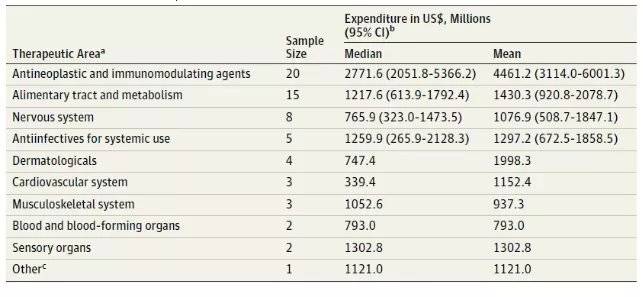
(不同疾病药物的高额研发投入)
按理来讲,国内的研发成本等可以折个汇率,药价自然能更实惠,但现实是,当时没有药企做这件事,或者说没有人愿意做。“多苦啊,熬那么多年搞研发,还有很大概率失败(从临床I期走到上市的成功率只有不足10%),哪有做仿制药来钱快又稳”——这是当年一批药企老板的真实内心写照。
漫长的一段时间中,也鲜有VC肯冒着打水漂的风险,陪着一款药从结构设计阶段一步步走到临床、上市。当然,基金存续期对他们来讲也是没法逾越的鸿沟。
而纵观近几年,尤其在2018年港股新规及2019年科创板推出后,创新药企的招牌因为有了资本市场的关注而越来越亮。
百济神州、再鼎医药、传奇生物等生物医药公司成功赴美IPO的事实,疫情之中我国在疫苗上的进度,是更浓的一针鸡血——这似乎在告诉我们,中国的医药创新已经正式与美国接轨了。
然而,两国之间曾经15~20年的差距真能被这样轻松消灭吗?我国创新药的进展到底如何?我们试图从西湖大学的生物医药主题思享汇中找到答案。
- 1 -
蛮荒
先抛出结论,自2015年我国创新药研发驶入快车道后,我们的确缩短了与美国的差距。多位投资人向虎嗅表示,目前这一差距在10年左右;乐观者则认为只有5年。
2001年回国创办贝达药业时,丁列明发现中国医药产业从创新角度来讲是一穷二白。“整个产业以仿制为主;我们的产值也不高,只有美国的1/3。”
彼时,全国有6000多家药企,但98%以上在做仿制药。即便是中国食品药品监督管理局(CFDA)通过的1类新药,也几乎全是对欧美药品的改良,技术含量很低。
如前文所述,资本不敢入场,做创新药的巨额投入企业要么支撑不起,要么担心影响利润。
不仅如此,政策法规也是极大的挑战。从注册管理到临床研究指导规范的整套药品管理体系全像是为仿制药而设,丁列明等2000年前后回国想做创新药,面对的是真正意义上的“蛮荒”。
直接结果便是,国内两三年也没有一款新药上市;即便有,也大多是未经科学路径验证的。譬如杭州一款叫做康美来的药,说是能治疗肺癌,但用了到底有哪些效果,谁都说不清楚。
反观美国,VC和高校的配合已经有了十分的默契。高校聚焦于基础研究,所研发的创新药或发现的靶点在经过临床前验证后,VC会投钱,再配备职业经理人团队,完成我们常说的科研成果转化。
同时,美国如辉瑞、赛诺菲、诺华等制药巨头的存在,让中小公司有各种方法赚钱维持生计,譬如技术授权、出售销售代理权、被并购等。背后的VC也因此有了除上市之外更丰富的退出机制。
不过即使看到了差距,国内的确没有合适的生存环境留给创新药。因而鲜有创业者肯冒险追赶。
- 2 -
数量追赶,药费降低
转折点始于2015年国家陆续推出的药品注册等相关政策。但直到2017年,我国才开始对真正的创新药给予政策支持,临床试验管理、审评审批流程等才开始完善。
政策红利之下,热钱涌入这个赛道。创新药总算有了基本的成长环境。
在丁列明看来,2018年之后,我国的创新药物进入了爆发期。“我们一年能出10个新药,虽然不好说是不是每个创新药都很好,但从数量上来看,我们跟全球的差距已经大大缩小。”
“后续我们也能看到非常好的势头。”据丁列明介绍,近几年我国每年注册临床试验的项目有几百个,哪怕只有10%的成功率,也意味着以后可能每年都有20~30个新药可以走到上市。
不仅如此,国内的部分创新药不再是自娱自乐。
“我们的技术平台和生产能力,逐渐能够被跨国药企看中,在国外授权,这证明了我们技术能力的提升”,这是让清华大学医学院院长董晨欣喜的变化之一。
这对药企来讲, 也意味着几千万美元,甚至几亿美元真金白银的进账。
另一方面,很多国内创新药也在走向国际——在国外进行临床研究,在国外上市。此前百济神州所研发的白血病小分子药泽布替尼,就已在美国获批。

(泽布替尼还有一系列适应症的临床试验在路上)
中国的药企也开始具有了将国外研究成果通过技术合作、购买授权、战略并购的方式引入中国,从而拉近与国际前沿研究的距离。
如今,在新兴的细胞治疗和基因治疗领域中,我国在研的药物数量为全球第二,仅次于美国。且“因为我们相对来讲对细胞治疗的政策比美国更宽松,虽然商业上的定价等仍需要进一步摸索,但我觉得中国有可能在这一领域有一定的领先,或者至少不落伍”。
董晨进一步解释,就像新冠疫苗一样,可能大家的起跑线差不多。
这样的进展,已经对患者用药产生了一些积极影响。以PD-1药物为例,目前国内共有6款药获批上市,其中3款为自主研发。这三款国产药,让患者的治疗费用从一年几十万美元降到10多万元人民币。
“信达、君实、恒瑞的三款PD-1药物上市后,年销售额都在10亿左右。”就在日前,信达生物发布公告称其PD-1产品达伯舒在刚刚过去的Q2中卖了5亿元,上半年销售额共计9亿元。市场销售情况不错,不过在丁列明眼中这才仅仅是个开始。
然而,创新药的长周期注定其无法快速盈利,在国内上市当时来讲并不现实,这也是资本们的最大心结。直到2018年港股新规、2019年科创板的相继推出,退出通道清晰,让资本更能放开手脚。
同时,专业医疗基金的出现,更能在早期就看得懂。眼光独到的,势必比在临床阶段进入的赚得多。
另一边的二级市场中,“老大哥”恒瑞市值突破了5000亿元大关,虽然距离默沙东、葛兰素史克、赛诺菲等千亿美元级别的跨国巨头仍有较大差距,但这酝酿的可能是,未来创新可以交由小型生物科技公司完成,而大公司通过“买买买”终将成为真正的巨头。
- 3 -
质量还得加把劲儿
但正如前文所述,中国的医药产业目前只是拉近了与美国的距离。
一方面,我们目前更多是在通过在研药物项目的数量来衡量这种进步,但质量呢?
从直接结果来看,虽然我们对全球创新药研发的贡献率上升了5个点,但也不过只有7.8%;而美国对全球创新贡献率高达50%,日本、英国、德国和瑞士等制药强国位居第二梯队,创新贡献率为5%~10%。
患者的治疗效果也还存在明显差距。以癌症为例,美国患者的5年生存率是66%,中国则仅有30.9%。
量变没有引发质变,问题出在哪儿?这就不得不提到我国科研长期存在的一个问题是,论文实力强,而科技实力并未与之相匹。
即便已经有浮出水面的几家国内生物医药公司用产品证明了自己,但我们不能也不该忽视,很多国内的在研药物仍然是fast-follower或me-better的创新。它们与首创在结构或临床效果上有差异,但也不过是因为站了在首创药的肩膀上。
“我国新药原创研发能力不足,研发靶点又过于集中,同质化严重”,丁列明总结。不难推测,这些药出国并非不可能,但出去之后在全球又能卖多少呢?
实际上,我国医疗器械市场也面临着相同的问题。从先前用市场换国外设备商的技术,到现在说是参与创新,出口却大多只能到东南亚、印度、非洲这样的国家去。即便如今国产替代越喊越响,国内的市场份额短时间内仍将被GE、西门子、飞利浦等巨头牢牢占据。
当然,我们不是说fast-follower、me-better不好,它们对提升患者治疗体验有很大的帮助;就连me-too的存在也有重要意义。
但如果有一天,国际关系继续恶化,到了我们在制药技术上也受制于人呢?没有原创性基础的弊端便将暴露无遗。
显然,我国当下的基础研究虽在进步,但仍远远不够。
“我们认为源头上基础生命科学的研究非常重要,也要深入研究疾病的机理,同时还要有能力设计好的临床试验。”董晨认为,只有这样才能攻克那些还无药可治的疾病,真正做到拓荒。
另一方面,与美国医疗产业完整的生态相比,我们不得不承认国内的医药产业还在发展较为初期的阶段。
“只有让科学家、医生、企业家、投资人和病人形成真正的闭环,才能推动药物创新的发展”,作为药企的“乙方”,药明康德联席CEO杨青认为这样的颠覆并不远。
但据启明医疗总经理訾振军介绍,中国临床医生目前是在崛起,但仍像工匠一样。“他们的时间拿来一部分看门诊、一部分做手术,留给临床科研的时间并不多少。”只有改变这一现状,才能让医生真正进入创新研发的生态系统中去。
此外,除了对药物本身靶点、结构等进行创新,一些新型工具的出现也是想要提升新药研发的速度。比如现在国内外一级市场中资本比较看好的AI药物研发平台,通过大量的数据可能为药物发现、临床等提供更强的助力。
但从AI医疗经历四年发展仍难落地的现状来看,AI药物研发平台究竟能发挥多大作用,尚需要时间验证。
种种原因影响之下,我国的原创药产业发展速度可能并不如想象中乐观。
来源:虎嗅网
作者:石晗旭
*本文已获得原作者授权。本文仅代表作者观点,医微客只用于信息传递分享,并不对其真实性负责。
百度浏览 来源 : 虎嗅网
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)