2021-08-06

2021年,必将是“神药”PD-1抑制剂大战的关键之年。
2月19日,君实生物生物发布公告称其PD-1产品特瑞普利单抗已获国家药监局批准,用于既往接受过二线及以上系 统治疗失败的复发/转移性鼻咽癌患者的治疗,成为全球首个获批鼻咽癌治疗的PD-1单抗。而就在一天前君实生物公告,特瑞普利单抗联合化疗用于晚期一线未接受过系统性治疗的复发转移性鼻咽癌的新适应症上市申请刚刚获得国家药监局受理。
由此,君实生物在国内PD-1的厮杀中迈出了差异化的关键一步。
2020年刚结束月余,中国的PD-1市场格局发生了深刻变化:四款本土药物陆续被纳入国家医保,两款进口药物“被迫”降价,更新慈善赠药政策,以求保住一定市场份额。
那么,2021年,谁有望脱颖而出?谁或将出奇制胜?PD-1市场格局将如何演变?即将获批的后来者又将如何搅动市场?
01 谁能成为赢家?
可以预见的是,随着越来越多第二梯队药企加入战局,围绕PD-1展开的战争,将进一步白热化。价格、适应证、产能、销售能力……只有在这些关键要素上步步为营,药企才有望成为最后赢家。
国内PD-1的竞争格局将由综合实力决定:
一是适应证拓展和联合用药,未来中国市场将更趋于规范化,超适应证用药会逐步减少,适应证拓展和联合用药的布局显得尤为重要。
二是医保谈判,大适应证纳入医保后销售会出现拐点。
三是成本和价格,当第二梯队企业也加入销售竞争之后,有可能会有比较激烈的价格竞争,届时成本控制能力也非常重要。
02 价格厮杀激烈
纳入医保后,销售能力也是制胜的核心与关键。
截至2020年底,四款国产PD-1已全部被纳入医保,分别是信达生物的达伯舒、君实生物的拓益、百济神州的百泽安、恒瑞医药的艾瑞卡。
此前,这四款药品上市时的单疗程价格分别为7838元、7200元、10688元、19800元,慈善赠药后的年治疗费用约为10万-12万元。
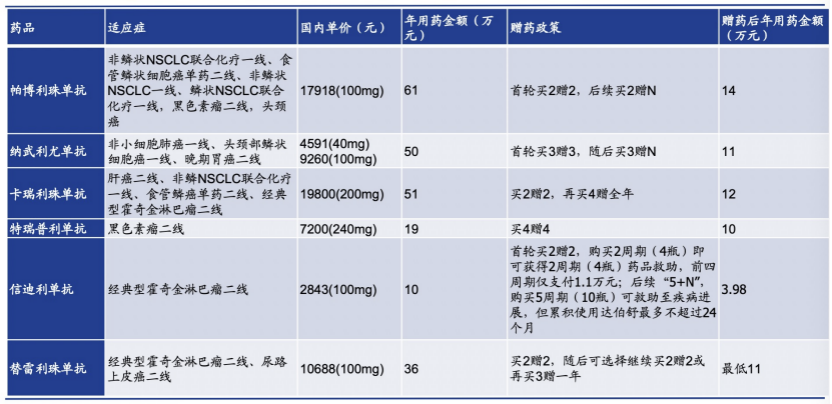
(图片来源:国盛证券研报)
进医保的代价是60%以上的降幅。在2019年,达伯舒降至2843元/支,降幅达到64%。2020年的降价要更猛烈一些,拓益降至906.08元/支,降幅达到87%。余下两款药品具体价格未披露,不过据媒体报道,艾瑞卡降至3000元/支左右,降幅达到85%。百泽安降至是1500元/支左右,降幅达到86%。
按照各家推荐的用法估算,患者年花费在5万-7万元左右。根据国家医保局披露的数据,2020年前三季度医保实际报销比例达到68%,以此测算,患者年自付费用低于3万元。
这个价格水平,对无缘医保的两款进口药品——百时美施贵宝的欧狄沃(Opdivo,下称“O药”)和默沙东的可瑞达(Keytruda,下称“K药”)造成了极大冲击。在2020年医保谈判后,他们迅速更新了慈善赠药政策,进行“腰斩式”降价,以求保住一定的市场份额。
此前,O药单疗程价格18442元,慈善赠药后年治疗费用22万元,K药单疗程价格35836元,慈善赠药后年治疗费用近30万元。政策更新后,两款药品降价幅度超50%,年治疗费用分别为11万元和7万元。
由此可见,本土的PD-1与外资PD-1在定价区间分属两个区间,接下来实现市场放量,销售能力是核心与关键。
六家PD-1企业的销售能力中,恒瑞医药最为突出。一位接近恒瑞医药的业内人士曾透露:“恒瑞的销售体系非常庞大,有近3000人的销售团队专门销售PD-1,且销售网络能完全覆盖二级医院,艾瑞卡的放量速度远超对手。”
这让最晚获批上市的艾瑞卡,销量远超国内竞争对手。中信证券研报预计,前三季度其销售额约30亿元。同期,拓益与百泽安累计销售额不足7亿元,即便是早在2019年已进入医保的达伯舒,累计销售额也仅为15亿元。2021年1月,信达公布达伯舒2020年Q4销售额超过7亿元,全年销售额超过22亿元。
目前,余下药企已意识到了销售能力的短板,均在扩充销售团队,提升医院覆盖率,销售费用支出亦大幅增加。
2020年上半年,百济神州的销售及一般行政开支较去年同期的1.40亿美元增长65.2%,达到2.31亿美元。
信达生物的销售及市场推广开支为4.47亿元,占总收入的45.4%,去年同期仅为1.67亿元。销售及市场推广团队持续扩大,达到1176人,相比去年同期翻了一倍不止。
君实生物的销售费用为2.28亿元,去年同期为1.11亿元,增长106.14%。这主要是因为销售团队的扩张,以及产品推广力度的不断加大。截止2020年6月,君实生物的销售团队共有561人。
03 争夺适应证高地
除了价格,另一个决定市场格局的核心要素,就是适应证。
目前,各家公司均在争分夺秒拓展自家PD-1药物的适应证。一方面,专注布局患者基数大的主要癌种;另一方面,抢占竞争对手尚少的小癌种,寻求差异化竞争。
从国内已获批的适应证来看,两款进口药品在这方面很有优势,由于上市早,已经积累了大量的临床数据。O药适应证为非小细胞肺癌(2L)、头颈部鳞状细胞癌(2L)、胃或胃食管接连部腺癌(3L)。K药适应证为黑色素瘤(2L)、非鳞状非小细胞肺癌(1L联合)、非小细胞肺癌(1L)、鳞状非小细胞肺癌(1L联合)、食管鳞癌(2L)、头颈部鳞状细胞癌(1L)。
而在四款国产药品中,恒瑞医药领先一步,艾瑞卡获批4项适应证——霍奇金淋巴瘤(3L)、肝细胞癌(2L)、非鳞状非小细胞肺癌(1L联合)、食管鳞癌(2L)。
百济神州紧随其后,百泽安获批3项适应证,霍奇金淋巴瘤(3L)、尿路上皮癌、鳞状非小细胞肺癌(1L联合)。
信达生物的达伯舒获批2项适应证,霍奇金淋巴瘤(3L)、非鳞状非小细胞肺癌(1L联合)。
加上本次获批的鼻咽癌(2L),君实生物的拓益也获批了2项适应证,另一为黑色素瘤(2L)。
对比来看,在肺癌、霍奇金淋巴瘤领域各家竞争激烈,属于必争之地。而艾瑞卡的肝癌、百泽安的尿路上皮癌、O药的胃或胃食管接连部腺癌为独家适应证,竞争压力较小,现有产品获得先发优势,可以抢占大部分市场。
除了已获批的适应证,各家药企均有多项PD-1的三期临床获批或正在进行中,多为联合用药,出现扎堆情况。
据国盛证券研报统计,截至2021年年初,恒瑞医药有15项PD-1的三期临床,君实生物有13项,百济神州11项,信达生物4项,默沙东18项,百时美施贵宝20项。
值得一提的是,PD-1纳入CSCO(中国抗癌协会临床肿瘤学协作专业委员会)指南情况亦值得关注。指南是指导医生处方的金标准,进入指南越多,用药也就越多。
数据显示,纳入指南最多的是K药和O药,分别是20个和14个。余下依次是艾瑞卡(5个)、拓益(3个)、百泽安(1个)、达伯舒(1个)。
04 四款PD-1悉数出海
目前,海外市场主要被O药与K药占据。
2020年K药销售达到143.8亿美元,实现近30%的增长;O药2020年略显疲态,销售额下降3%。
两家独享蛋糕,但余下的跨国药企也不甘落后。国盛证券研报指出,早期的先行者在该领域市场地位已非常稳固,若想重新定义市场格局,后来者必须要尽快通过独家、创新的组合疗法来颠覆现有的或者开辟新的市场空间。这些跨国药企的研发管线中不乏各类靶点的创新药,但却受限无法再短时间内开发出一款PD-1来。因此,与拥有高效、高质研发水平的中国本土企业合作成为了一个不错的选项。
在此背景下,四款本土PD-1陆续出海。
2021年2月,君实生物宣布与美国Coherus公司就拓益在美国和加拿大的开发和商业化达成合作。根据协议条款,君实生物将授予Coherus特瑞普利单抗和两个可选项目(如执行)的许可,并获得总额最高达11.1亿美元的首付款、可选项目执行费和里程碑付款。君实生物将与Coherus共同开发特瑞普利单抗,由Coherus负责美国和加拿大的所有商业活动。
2021年1月,百济神州宣布授权跨国巨头诺华在多个国家开发、生产和商业化百泽安达成合作与授权协议。授权区域包括美国、加拿大、墨西哥、欧盟等。百济神州将获得诺华6.5亿美元的预付款,并在达到里程碑事件后有资格获得至多13亿美元的里程碑付款,另有资格获得百泽安授权区域未来年度净销售额的近20%~30%的分级特许使用费。
2020年8月,信达生物与礼来制药共同宣布,双方将扩大关于达伯舒的战略合作,新的合作将拓展至全球市场。根据协议,礼来将获得信迪利单抗在中国以外地区的独家许可,信达生物将获得累计超10亿美元款项。礼来已就信达生物和礼来合同研发的信迪利单抗拟在美国市场上市进行布局,申请的适应证为非小细胞肺癌,目前处于临床第一阶段。
2020年4月,恒瑞医药宣布与韩国 Crystal Genomics公司(下称“CG公司”)达成协议,将艾瑞卡有偿许可给后者。CG公司将获得该药物在韩国的独家临床开发、注册和市场销售的权利,且被许可进行研发和销售卡瑞利珠单抗用于所有人类疾病。CG公司将向恒瑞支付150万美元的首付款。
这些跨国药企手中有完善的产品线,可以与PD-1进行联合用药,从而双双放量,互利共赢。比如,信达生物于2020年8月提交的新适应症申请——信迪利联合健择®(注射用吉西他滨) 和铂类化疗用于鳞状非小细胞肺癌一线治疗,其中的健择®即为礼来在中国深耕多年的老牌产品。
05 后来者的入局或将如何搅动市场?
截至2020 年12月,累计有66款国产PD-1/PD-L1抗体申报临床,包括47款PD-(L)1单抗和19款PD-(L)1双抗。
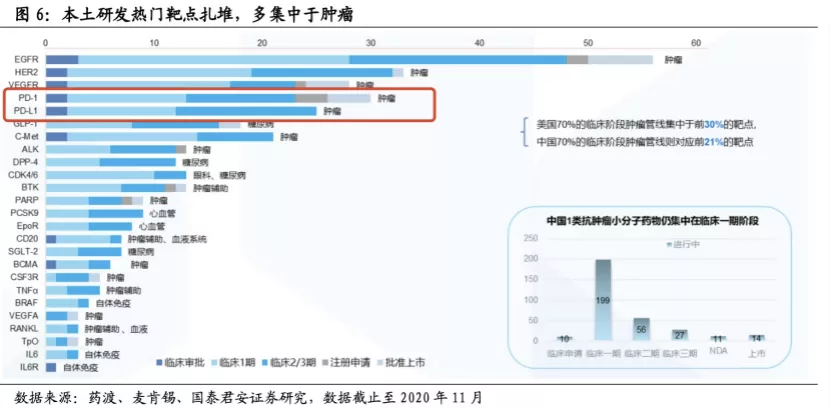
(图片来源:国泰君安研报)
目前,在本土PD-(L)1研发阵营中,最有希望“接棒”的第二梯队包括康方生物,基石药业,康宁杰瑞,他们的PD-1产品均研发进展较快,即将上市。
后来者的入局或将如何搅动市场?
一位不具名生物药企高层告诉E药经理人,适合免疫治疗的患者是有限的,并不会因为更多药物上市,市场变得无限大。越早进入市场的产品,会以最快的速度抢占市场份额。
他认为,一款PD-(L)1产品不可能获批全部的适应证,也不可能在每一个治疗领域呈现的数据结果都是最优。因此,未来PD-1市场竞争中的一个关键因素就是,要做差异化竞争。
从目前的情况看,各家企业均意识到了这一点,在布局肺癌等大适应症的同时,寻求独家小适应症的先发优势。
康方生物的PD-1主攻的适应症为非小细胞肺癌(1L联合)、霍奇金淋巴瘤(3L)、晚期实体瘤。基石药业的PD-L1拟定适应症为非小细胞肺癌(1L联合)、复发或难治性(R/R)结外自然杀伤细胞/T细胞淋巴瘤。
康宁杰瑞主要布局PD-L1及双抗,PD-L1的适应症集中在胆管癌的联合用药上,还有晚期实体瘤。
百度浏览 来源 : E药经理人
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)