
肿瘤,是悬在人类头上的“达摩克利斯之剑”。在过去几百年的历史长河中,人类一次又一次地向肿瘤宣战,从最开始的手术治疗,到放疗、化疗、靶向治疗,再到细胞毒性T淋巴细胞相关蛋白4(CTLA-4)及程序性死亡受体1(PD-1)抑制剂发现开启了肿瘤免疫疗法的新纪元。免疫治疗一经问世,国内外临床研究如“雨后春笋”般不断涌现,然而同类药物在同一治疗领域取得的疗效数据存在差异。如何认识这些差异,是临床一直“困惑”的问题。不同药物的特性和疗效之间是否存在着某种必然联系?这一问题也已成为国内外研究的热点。近期, 国外开展的相关基础研究对T细胞内PD-1信号通路进行了更加深入的解读,为我们揭秘“药物”和“疗效”之间的关系提供了新的线索。
近年来,免疫治疗成为肿瘤领域发展最为迅猛,疗效最为确切的新疗法,已成为肿瘤治疗的重要手段。研发最早并且也是最成熟的CTLA-4及PD-1抑制剂,在非小细胞肺癌及黑色素瘤领域已成为一线治疗药物。然而PD-1抑制剂在不同人群、不同瘤种,不同个体中,疗效差异巨大,甚至作用机制相似的PD-1抑制剂在同样的患者群中也可能表现出“性”相近,“效”相远的治疗结局。以黑色素瘤领域目前我国仅有的两项单臂临床注册研究为例。KEYNOTE-151研究和POLARIS-01研究是在中国人群恶性黑色素瘤二线/二线及以上患者中开展的临床研究,二者虽不是“头对头”研究,但由于开展的时间接近、由同一专家牵头、多个参与中心重叠和纳入患者分期相似,“肩并肩”两相比较,仍然具有临床参考价值。KEYNOTE-151研究和POLARIS-01研究结果中的客观缓解率(ORR)分别为16.7%和17.3%,然而,在中位缓解持续时间(mDOR)和中位总生存期(mOS)指标上则相去甚远,POLARIS-01研究mDOR为25.6个月,mOS长达22.23个月,而KEYNOTE-151研究则分别为8.4个月和12.1个月。无独有偶,评估PD-1抑制剂用于尿路上皮癌二线及以上患者治疗的POLARIS-03研究和BGB-A317-204研究结果同样表现出较大差异。在PD-L1表达阳性的患者中,POLARIS-03研究结果显示PD-1抑制剂治疗ORR高达41.7%,mOS为35.6个月,而在BGB-A317-204研究中,ORR和mOS为23.1%和9.8个月。面对同样的“考卷”,不同PD-1抑制剂的“成绩单”大相径庭。如果能够厘清这种现象背后的原因,似乎就能打开免疫治疗的又一扇“通关之门”。
抑制PD-1/PD-L1信号通路—让肿瘤细胞“无所遁形”
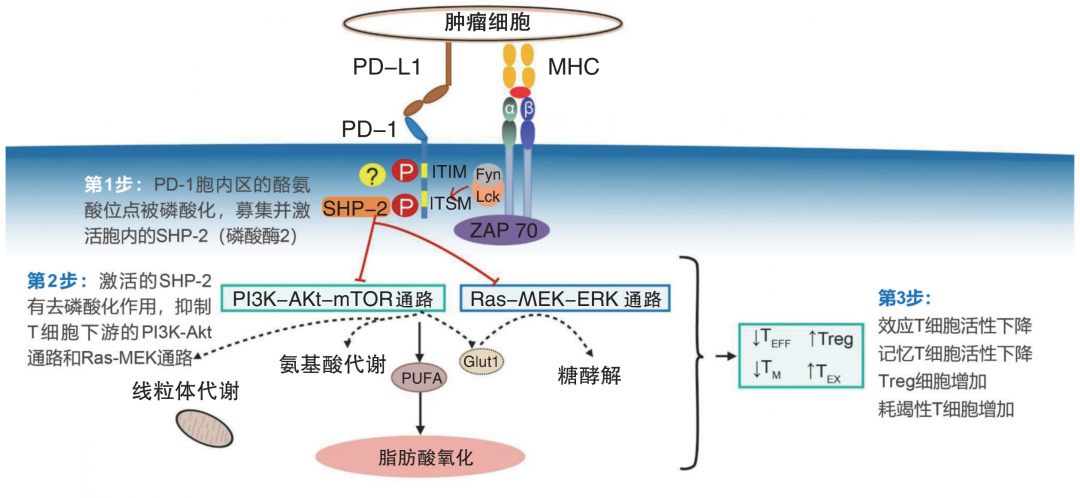
图 1 PD-1抑制通路示意图
破解免疫治疗的“谜题”,要从“作用机制”入手,而“故事”的开端,要从肿瘤细胞的免疫逃逸说起。肿瘤细胞由正常细胞发生基因突变产生,并产生肿瘤特异性抗原,其被抗原呈递细胞(APC)识别、捕获并呈递给T细胞。T细胞活化需要APC与T细胞表面的共刺激分子相互作用。负调控共刺激分子通常也被称为免疫检查点,主要用于限制免疫系统的过度激活,而PD-1即为最重要的免疫检查点之一,在肿瘤微环境中,肿瘤细胞和肿瘤相关APC表达PD-L1,与PD-1结合后可诱导T细胞凋亡、失能、耗竭,进而抑制T细胞功能,实现肿瘤免疫逃逸。由此可见,PD-1是与肿瘤细胞免疫逃逸相关的最重要的分子之一,激活PD-1/PD-L1信号通路有利于肿瘤细胞的免疫逃逸。从结构上看,PD-1胞内部分由2个酪氨酸残基构成,1个是靠近N端的免疫受体酪氨酸抑制基序(ITIM),另1个是靠近C端的免疫受体酪氨酸依赖的转换基序(ITSM);其中,ITIM上的酪氨酸可恢复细胞质段的磷酸化,从而拮抗抗原受体;而ITSM参与PD-1的负性调控。细胞外部分则是由IgV样结构域组成,该结构域能与配体结合,进而抑制T细胞的活化。当细胞表面的PD-1与配体偶联后,导致PD-1胞质区的ITSM结构域中的酪氨酸发生磷酸化,募集并激活胞内的蛋白酪氨酸磷酸酶2(SHP-2),促进下游的TCR/CD3复合体和ZAP70分子发生去磷酸化,进而抑制磷脂酰肌醇3激酶(PI3K)等的活化,抑制下游通路中AKT、ERK等的激活,从而进一步诱导CD8+ T细胞和CD4+ T细胞处于失活状态,抑制相关细胞因子分泌和T淋巴细胞增殖,起到免疫负调控作用(图1)。
阻断PD-1与PD-L1结合—复原T细胞“必要”但不“充分”
在PD-1/PD-L1信号通路在肿瘤免疫逃逸过程中的上述机制被揭示后,人们在很长时间内认为:只有肿瘤细胞PD-L1与PD-1结合时,才会产生免疫逃逸,而只要阻断PD-L1与PD-1的结合,即可阻断PD-1通路对T细胞的抑制作用,恢复T细胞杀伤肿瘤的功能。因此,PD-1抑制剂对PD-1与PD-L1结合的阻断作用成为最初的关注焦点。然而,临床实践显示,各类PD-1抑制剂阻断效果的差异与临床疗效的差距并不匹配,这提示我们,要恢复T细胞对肿瘤细胞的杀伤作用,仅通过阻断PD-1与PD-L1结合还远远不够。那么问题到底出在哪里?
事实上,已经发表的基础研究结果给我们提供了一系列线索。首先,T细胞杀伤功能的丧失可能并不仅仅源于被抑制,在肿瘤特异性抗原的持续刺激下,T细胞PD-1表达会逐渐上调,最终将导致T细胞随之发生耗竭或者“耐药”。2020年,发表在《自然》(Nature)上的最新研究则进一步明确:尽管PD-1抑制剂有效地阻断了配体激活的信号转导,但它无法抑制T细胞内PD-1自身持续的信号转导。换言之,PD-1蛋白存在时,即对T细胞产生抑制作用(图2)。
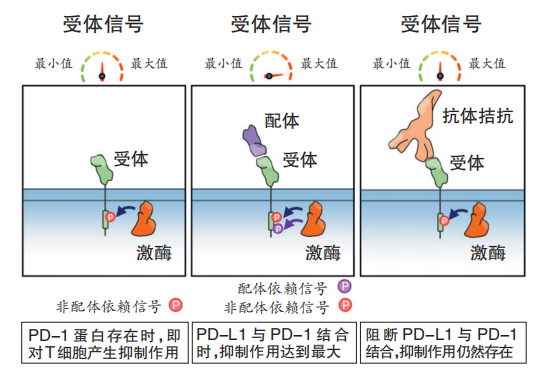
图2 阻断受体与配体结合,也无法解除PD-1对T细胞的抑制作用
至此,我们似乎可以得出不同PD-1抑制剂临床表现差异的背后原因,即PD-1抑制剂的疗效不仅取决于抑制PD-L1与PD-1结合的作用,还取决于其能否下调T细胞PD-1表达,恢复其正常活性的能力。截至目前,已有研究证实PD-1抑制剂中的纳武利尤单抗、帕博利珠单抗和特瑞普利单抗存在内吞作用,可诱导T细胞膜表面PD-1表达下调。因此,对PD-L1与PD-1结合的抑制作用,以及诱导T细胞PD-1内吞的效应,均是构成PD-1抑制剂疗效的组成部分。肿瘤免疫治疗的前路光明但曲折,随着其背后作用机制的脉络逐渐清晰,占据更多机制优势的PD-1抑制剂无疑未来会走得更稳、更远。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)