COVID-19大流行至今已3年时间,造成了数亿人感染,随着感染人群的增多,如今的新冠病毒(SARS-CoV-2)已积累了大量的变异,演化为奥密克戎(Omicron)等具有更强传染力和免疫逃逸能力的变异株。
这些SARS-CoV-2变异株严重挑战了此前基于原始病毒株设计的第一代新冠疫苗,并且多个变异株已被证实可以逃逸初代疫苗诱导的体液免疫。因此,目前迫切需要开发更有效、更安全的新一代mRNA疫苗来对抗SARS-CoV-2变异株。
2022年7月,四川大学华西医院生物治疗国家重点实验室宋相容课题组在材料科学领域顶级期刊 Advanced Functional Materials 上发表了题为:mRNA Vaccines
Against SARS-CoV-2 Variants Delivered by Lipid Nanoparticles Based on Novel
Ionizable Lipids 的研究论文。
该研究开发了基于新型电离脂质4N4T的脂质纳米颗粒——4N4T-LNP,并针对SARS-CoV-2及其变异株(包括Delta和Omicron)设计了相应的mRNA疫苗——4N4T-LNP-mRNA,该疫苗成功引发了强大和持久的体液免疫反应。
更重要的是,对比Moderna公司使用的的SM-102-LNPs,4N4T-LNP表现出更高的mRNA递送效率,且具有良好的安全性,在mRNA疫苗开发中具有强大的应用前景。
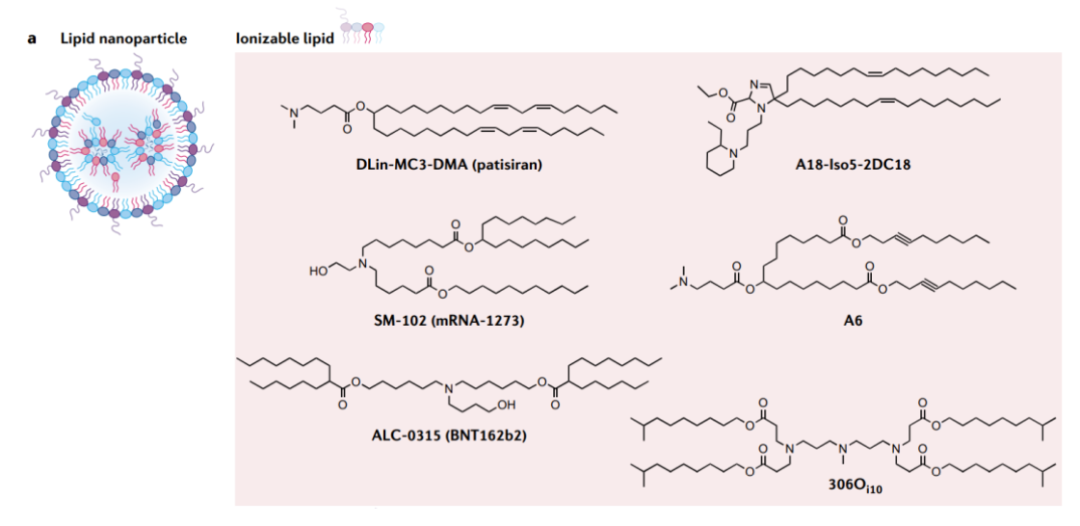
宋相容研究员/博士生导师,2003年本科毕业于四川大学华西药学院,2008年获得四川大学药剂学博士学位,此后在四川大学华西医院生物治疗国家重点实验室任教职,专职从事靶向递送载体研究。期间师从魏于全院士,开展生物学博士后研究;并在哈佛大学医学院学习免疫学和纳米医学,从事mRNA药物相关研究。宋相容研究员带领团队一直致力于mRNA创新药物的研究,并于2021年7月与魏于全院士联合创立了mRNA药物研发公司威斯津生物。工欲善其事,必先利其器,高效的mRNA递送系统是mRNA疫苗成功的关键。其中,脂质纳米颗粒(LNP)是目前先进的非病毒递送系统,美国FDA批准的两款mRNA疫苗——mRNA-1273和BNT162b2,均使用LNP来递送mRNA。可电离脂质对LNP的有效性有着重要影响,可电离脂质提供正电荷将mRNA封装到LNP中,并使得装载的mRNA能够穿过细胞膜,进入细胞内。通过合理设计可电离脂质的化学结构,可以提高LNP系统的递送效率,进而增强mRNA疫苗的效用。
根据化学结构,可电离脂质可分为单荷电脂质和多荷电脂质,mRNA-1273和BNT162b2这两款上市的mRNA疫苗使用的可电离脂质分别为SM-102和ALC-0315,均属于单电荷脂质。而在可电离脂质与mRNA质量比相同的情况下,多电荷脂质通常比单电荷脂质具有更高的N/P比,更有利于mRNA的封装、细胞摄取和溶酶体逃逸,这些都能提高mRNA疫苗的效用。
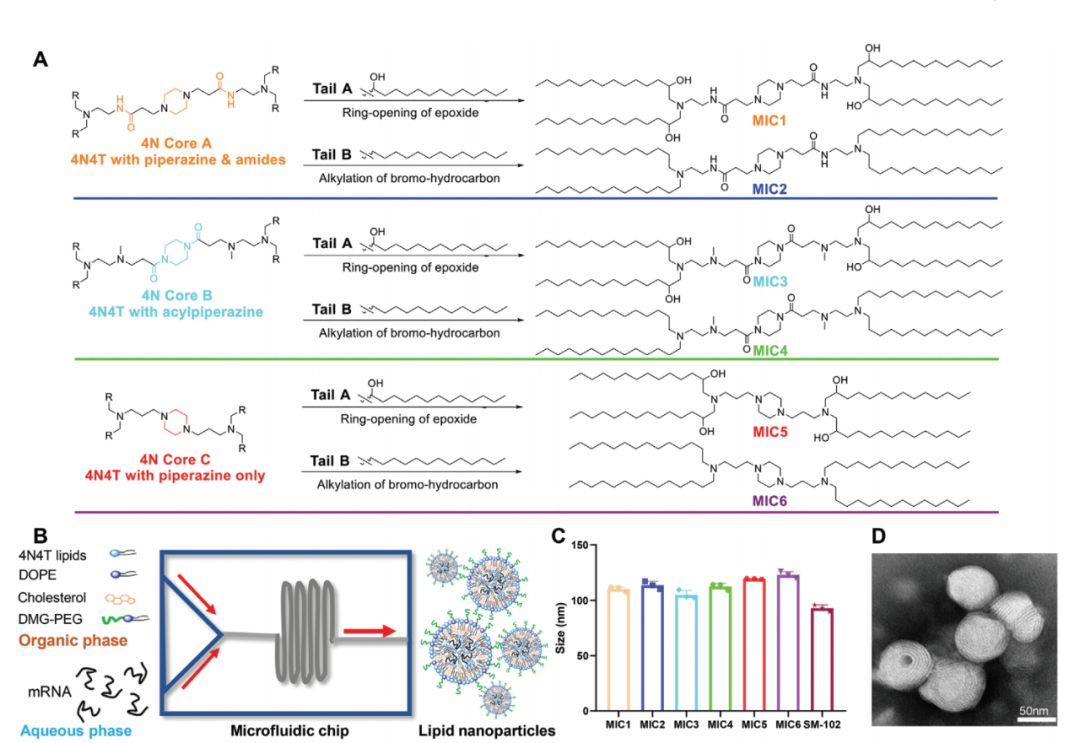
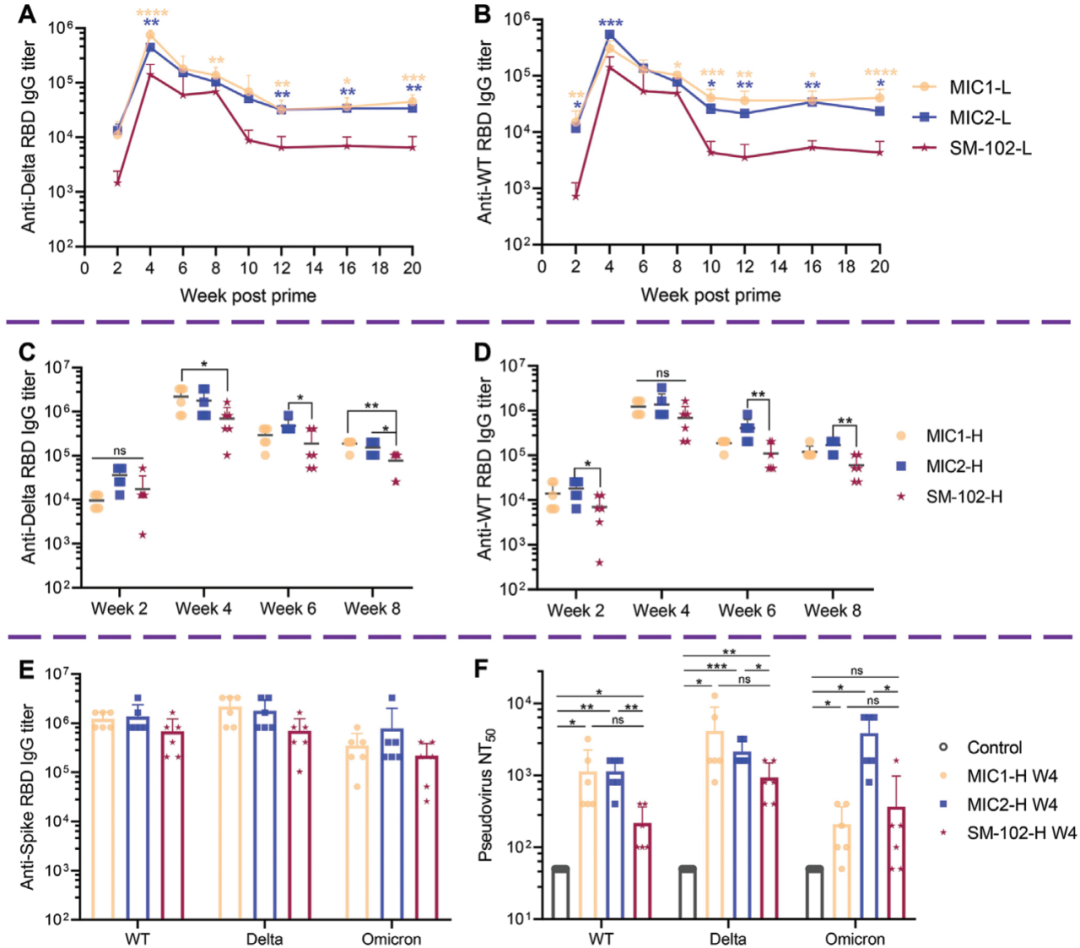
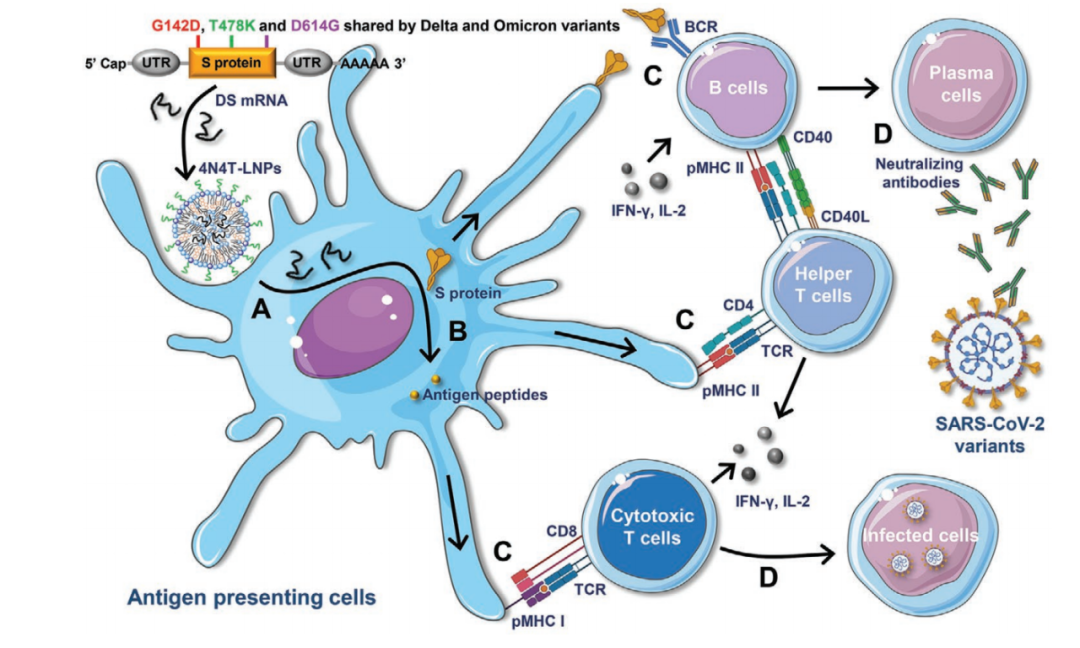
在这项最新研究中,宋相容课题组设计了一组具有4个叔氨基氮原子(4N4T)的新型多电荷脂质,4N4T的设计保留了不同脂类精细结构的差异,从而有利于研究人员探究微小结构差异对mRNA疫苗递送效率和免疫原性的影响。宋相容研究员表示,在四川大学华西医院生物治疗国家重点实验室有很多非常优秀的研究团队,其中就包括机器学习领域的专家。2013年团队开始做mRNA技术,那时候就开始与机器学习结合,应用于纳米载体的结构和配方设计,以及mRNA序列设计和优化方面。宋相容团队应用4N4T生成了新型脂质纳米颗粒——4N4T-LNP。令人兴奋的是,相比Moderna公司在mRNA-1273疫苗中使用的单荷电脂质SM-102-LNP,4N4T-LNP表现出更高的mRNA递送效率。为了验证新型递送系统的有效性,宋相容课题组基于Delta突变株的全长S蛋白设计了包含Omicron突变株中三个关键突变位点(G142D、T478K和D614G)的 DS mRNA,并将其封装到4N4T-LNP中,从而形成了对抗SARS-CoV-2突变株的第二代mRNA疫苗。研究结果显示,4N4T-DS mRNA疫苗成功引发了对SARS-CoV-2及其突变株(包括Delta和Omicron)的强大和持久的体液免疫反应,证明4N4T-DS mRNA疫苗具有作为SARS-CoV-2变异株疫苗的强大潜力。更重要的是,与基于SM-102-LNP的mRNA疫苗相比,4N4T-DS mRNA疫苗具有更高的RBD特异性IgG滴度和中和抗体滴度。该研究也是首次发现mRNA疫苗诱导中和抗体的类型受可电离脂质化学结构的影响。4N4T-DS mRNA疫苗和已批准的LNP-mRNA疫苗的体液免疫应答比较不仅如此,研究团队还首次发现,mRNA疫苗诱导中和抗体的类型受可电离脂质化学结构的影响。此外,4N4T-DS mRNA疫苗也能诱导强烈的辅助性T细胞反应,且具有良好的安全性。宋相容研究员表示,载体组分的结构、代谢、分布都与毒性有关,在载体开发过程中,团队已经做了大量毒力实验,从而调整和改进设计方案,让4N4T-LNP具有了更好的安全性。总的来说,这项研究开发了一种新型mRNA递送载体——4N4T-LNP,它具有比已批准的LNP更高的mRNA递送效率,并在对抗SARS-CoV-2突变株的mRNA疫苗开发中展现出强大的应用潜力。据悉,威斯津生物已建设成熟的mRNA药物技术平台、新型纳米佐剂平台,目前已经开展了包括抗感染疫苗、肿瘤疫苗、抗衰老药物、抗肥胖药物、基因编辑治疗罕见病/遗传病、编码抗体的mRNA药物等近20个mRNA药物研发管线。宋相容研究员表示,威斯津这近20个管线可以分为两大类,一类是基于免疫的,一类是基于蛋白替代。能一成立就布局这么多管线,实际上这是基于四川大学华西医院生物治疗国家重点实验室多年来的一系列研究成果。宋相容研究员告诉《生物世界》,当前的mRNA疗法还存在着一大难点,就是组织特异性不高,目前已有例如SORT等具有器官特异性的新型LNP载体出现,自己团队也做了很多针对脑、肺、肝、脾等器官的递送载体研发。
onlinelibrary.wiley.com/doi/10.1002/adfm.202204692
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。









发表评论
注册或登后即可发表评论
登录注册
全部评论(0)