2023-01-18 来源 : vip说
无论是国内还是国际上,肿瘤新药仍然是上市药物中占比最大的。我国抗肿瘤药研发的活跃程度不断增高,2018-2021年间增幅(35.7%)超过全球总体增长(17.3%);新药批准数量呈逐年增多趋势,其中抗肿瘤新药上市约占全部新药的31.1%。
2022年NMPA共批准上市了47款新药,亮点有:诞生第一个国产双抗、胆管癌实现靶向精准治疗、肺癌靶向药增多、最难治的三阴性乳腺癌有突破,罕见肿瘤、儿科肿瘤也有药可治。
而FDA批准了10款重磅创新药,其中有4个首创新药、2个首创疗法及1个免疫治疗新靶点。
“
导读目录
2022年获批新药将为中国哪些患者带来临床获益?
呼吸系统肿瘤(9款新药获得NMPA批准)
消化道肿瘤(11款新药获得NMPA批准)
头颈癌(6款新药获得NMPA批准)
实体瘤(5款新药获得NMPA批准)
乳腺癌(3款新药获得NMPA批准)
妇科肿瘤(2款新药获得NMPA批准)
泌尿系统肿瘤(1款新药获得NMPA批准)
血液肿瘤(8款新药获得NMPA批准)
皮肤癌(1款新药获得NMPA批准)
神经系统肿瘤(1款新药获得NMPA批准)
癌症并发症(2款新药获得NMPA批准)
FDA又将引领哪些研发浪潮?
FDA批准新药(共10款按时间顺序排列)
“以患者为中心”的新时代面临哪些问题?

图片来源:2022年CSCO大会
2022年获批新药将为中国哪些患者带来临床获益?
呼吸系统肿瘤(9款新药获得NMPA批准)
新药:盐酸恩沙替尼胶囊
机制:ALK 抑制剂
企业:贝达药业
批准时间:2022年3月16日
适应症:单药适用于间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性的非小细胞肺癌(NSCLC)患者的治疗。
新药:阿替利珠单抗注射液
机制:人源化单克隆抗PD-L1抗体
企业:罗氏
批准时间:2022年3月16日
适应症:单药用于检测评估为≥1%肿瘤细胞(TC)PD-L1 染色阳性、经手术切除、以铂类为基础化疗之后的 II-IIIA期非小细胞肺癌患者的辅助治疗。
新药:布格替尼片Brigatinib
机制:ALK抑制剂
企业:武田
批准时间:2022年3月22日
适应症:间变性淋巴瘤激酶(alk)阳性的局部晚期或转移性的非小细胞肺癌(nsclc)患者的治疗。
新药:曲美替尼片
机制:丝裂原活化细胞外信号调节激酶1( MEK 1 / 2) 可逆性抑制剂
企业:葛兰素史克
批准时间:2022年3月22日
适应症:联合甲磺酸达拉非尼适用于治疗 BRAF V600 突变阳性的转移性非小细胞肺癌患者。
新药:甲磺酸达拉非尼胶囊
机制:可逆的、高选择性MEK1和MEK2激酶活性的变构抑制剂
企业:诺华
批准时间:2022年3月22日
适应症:联合曲美替尼适用于治疗 BRAF V600 突变阳性的转移性非小细胞肺癌患者。
新药:洛拉替尼片(Lorlatinib)
机制:三代ALK抑制剂
企业:辉瑞+基石药业
批准时间:2022年4月27日
适应症:用于治疗既往接受过一种或多种间变性淋巴瘤激酶(ALK)酪氨酸激酶抑制剂(TKI)治疗的 ALK 阳性局部晚期或转移性非小细胞肺癌 (NSCLC)。
新药:塞普替尼胶囊
机制:RET抑制剂
企业:礼来
批准时间:2022年10月9日
适应症:用于RET驱动型肺癌和甲状腺癌患者;用于治疗转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者、需要系统性治疗的晚期或转移性 RET 突变型甲状腺髓样癌(MTC)成人和 12 岁及以上儿童患者、以及需要系统性治疗且放射性碘难治(如果放射性碘适用)的晚期或转移性 RET 融合阳性甲状腺癌(TC)成人和 12 岁及以上儿童患者。
新药:斯鲁利单抗注射液
机制:PD-1 单抗
企业:复宏汉霖
批准时间:2022年10月25日
适应症:联合卡铂和白蛋白紫杉醇用于一线治不可手术切除的局部晚期或转移性鳞状非小细胞肺癌(NSCLC)
消化道肿瘤(11款新药获得NMPA批准)
新药:淫羊藿素软胶囊
企业:北京珅诺基医药科技有限公司
批准时间:2022年1月10日
适应症:用于不适合或患者拒绝接受标准治疗,且既往未接受过全身系统性治疗的、不可切除的肝细胞癌,患者外周血复合标志物满足以下检测指标的至少两项:AFP≥400 ng/mL;TNF-α<2.5 pg/mL;IFN-γ≥7.0 pg/mL。
新药:钇[90Y]微球注射液
机制:治疗放射性药物
企业:远大医药
批准时间:2022年1月30日
适应症:经标准治疗失败的不可手术切除的结直肠癌肝转移
新药:雷莫西尤单抗
机制:抗血管生成药物
企业:礼来/信达生物
批准时间:2022年3月16日;2022年9月30日
适应症:联合紫杉醇用于在含氟尿嘧啶类或含铂类化疗期间或化疗后出现疾病进展的晚期胃或胃食管结合部腺癌患者的治疗;用于既往接受过索拉非尼治疗且甲胎蛋白(AFP)≥ 400 ng/mL 的肝细胞癌(HCC)患者的治疗。
新药:佩米替尼片
机制:选择性FGFR 1/2/3抑制剂
企业:信达生物
批准时间:2022年3月29日
适应症:用于治疗既往至少接受过一种系统性治疗,且经检测确认存在有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者。
新药:替雷利珠单抗注射液
机制:人源化IgG4抗PD-1抗体
企业:百济神州
批准时间:2022年4月8日
适应症:联合化疗用于一线治疗不可切除的局部晚期、复发或转移性食管鳞状细胞癌(ESCC)
新药:伊立替康脂质体注射液
机制:拓扑异构酶抑制剂
企业:施维雅
批准时间:2022年4月12日
适应症:与5-氟尿嘧啶(5-FU)和亚叶酸(LV)联合用于治疗接受吉西他滨治疗后进展的转移性胰腺癌患者
新药:特瑞普利单抗注射液
机制:PD-1 单抗
企业:君实
批准时间:2022年5月10日
适应症:联合紫杉醇和顺铂适用于不可切除局部晚期/复发或转移性食管鳞癌的一线治疗。
新药:纳武利尤单抗注射液
机制:PD-1单抗
企业:百时美施贵宝
批准时间:2022年6月23日
适应症:联合氟嘧啶类和含铂化疗适用于晚期或转移性食管鳞癌患者的一线治疗;用于经新辅助放化疗(CRT)及完全手术切除后仍有病理学残留的食管癌或胃食管连接部癌患者的辅助治疗。
新药:信迪利单抗注射液
机制:PD-1单抗
企业:信达生物制药
批准时间:2022年6月23日
适应症:联合含氟尿嘧啶类和铂类药物化疗用于不可切除的局部晚期、复发或转移性胃及胃食管交界处腺癌的一线治疗。
头颈癌(6款新药获得NMPA批准)
新药:普拉替尼胶囊
机制:口服、强效、选择性RET抑制剂
企业:基石药业
批准时间:2022年3月8日
适应症:适用于需要系统性治疗的晚期或转移性转染重排(RET)突变型甲状腺髓样癌(MTC)成人和 12 岁及以上儿童患者的治疗,以及需要系统性治疗且放射性碘难治(如果放射性碘适用)的晚期或转移性 RET融合阳性甲状腺癌成人和 12 岁及以上儿童患者的治疗。
新药:盐酸安罗替尼胶囊
机制:小分子多靶点酪氨酸激酶抑制剂
企业:正大天晴
批准时间:2022年4月13日
适应症:用于进展性、局部晚期或转移性放射性碘难治性分化型甲状腺癌患者
新药:替雷利珠单抗注射液
机制:人源化IgG4抗PD-1抗体
企业:百济神州
批准时间:2022年6月7日
适应症:联合吉西他滨和顺铂用于复发或转移性鼻咽癌的一线治疗。
新药:西妥昔单抗注射液
机制:作用于表皮生长因子受体(EGFR)的IgG1单克隆抗体
企业:默克
批准时间:2022年6月22日
适应症:与放疗联合用于治疗局部晚期头颈部鳞状细胞癌(LA SCCHN)
新药:甲苯磺酸多纳非尼片
机制:口服多靶点蛋白激酶抑制剂类小分子抗肿瘤药
企业:泽璟制药
批准时间:2022年8月10日
适应症:用于治疗进展性、局部晚期或转移性放射性碘难治性分化型甲状腺癌(RAIR-DTC)
新药:塞普替尼胶囊
机制:RET抑制剂
企业:礼来
批准时间:2022年10月9日
适应症:用于RET驱动型肺癌和甲状腺癌患者;用于治疗转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者、需要系统性治疗的晚期或转移性 RET 突变型甲状腺髓样癌(MTC)成人和12岁及以上儿童患者、以及需要系统性治疗且放射性碘难治(如果放射性碘适用)的晚期或转移性RET融合阳性甲状腺癌(TC)成人和 12 岁及以上儿童患者
实体瘤(5款新药获得NMPA批准)
新药:斯鲁利单抗注射液
机制:PD-1 单抗
企业:复宏汉霖
批准时间:2022年3月22日
适应症:用于经过标准治疗失败的、不可切除或转移性高度微卫星不稳定型(Microsatellite Instability-High,MSI-H)实体瘤
新药:硫酸拉罗替尼胶囊/硫酸拉罗替尼口服溶液
机制:TRK抑制剂
企业:拜耳
批准时间:2022年4月8日/ 2022年6月23日
适应症:用于治疗患有NTRK基因融合的局部晚期或转移性实体瘤的成人和儿童患者
新药:普特利单抗注射液(普佑恒)
机制:PD-1单抗
企业:乐普生物
批准时间:2022年7月22日
适应症:用于治疗既往接受一线及以上系统治疗失败的微卫星高度不稳定(MSI-H)/错配修复功能缺陷(dMMR)实体瘤患者。
新药:恩曲替尼胶囊
机制:广谱抗癌药物,靶向ROS1/ALK/Trk
企业:罗氏
批准时间:2022年7月26日
适应症:用于治疗成人及12岁以上儿童患者神经营养原肌球蛋白受体激酶(NTRK)融合阳性、初始治疗后局部晚期或转移性实体瘤。
新药:替雷利珠单抗注射液
机制:人源化IgG4抗PD-1抗体
企业:百济神州
批准时间:2022年3月8日
适应症:适用于不可切除或转移性微卫星高度不稳定(MSIH)或错配修复基因缺陷型(dMMR)的成人晚期实体瘤患者;既往经过氟尿嘧啶类、奥沙利铂和伊立替康治疗后出现疾病进展的晚期结直肠癌患者;既往治疗后出现疾病进展且无满意替代治疗方案的其他晚期实体瘤患者。
乳腺癌(3款新药获得NMPA批准)
新药:依维莫司片
机制:mTOR 抑制剂
企业:诺华
批准时间:2022年1月30日
适应症:联合依西美坦用于治疗来曲唑或阿那曲唑治疗失败后的激素受体阳性、表皮生长因子受体-2 阴性、绝经后晚期女性乳腺癌患者
新药:曲妥珠单抗注射液(皮下注射)
机制:靶向HER2的单抗
企业:罗氏
批准时间:2022年5月19日
适应症:联合化疗用于治疗早期和转移性HER2阳性乳腺癌患者。
新药:戈沙妥珠单抗(商品名:拓达维,Trodelvy)
机制:靶向TROP-2的ADC
企业:云顶新耀
批准时间:2022年6月7日
适应症:用于既往至少接受过2种系统治疗不可切除的局部晚期或转移性三阴性乳腺癌成人患者
妇科肿瘤(2款新药获得NMPA批准)
新药:卡度尼利单抗注射液(Candonilimab,AK104)商品名:开坦尼
机制:PD-1/CTLA-4 双特异性抗体
企业:康方生物
批准时间:2022年6月28日
适应症:用于既往接受过含铂化疗治疗失败的复发或转移性宫颈癌患者
新药:奥拉帕利片
机制:口服多聚二磷酸腺苷核糖聚合酶(PARP)抑制剂
企业:阿斯利康
批准时间:2022年9月19日
适应症:与贝伐珠单抗联用作为一线维持疗法,用于接受铂类化疗后完全缓解或部分缓解的新诊断晚期卵巢癌患者
泌尿系统肿瘤(1款新药获得NMPA批准)
新药:瑞维鲁胺片(商品名:艾瑞恩)
机制:雄激素受体(AR)抑制剂
企业:恒瑞医药
批准时间:2022年6月29日
适应症:适用于治疗高肿瘤负荷的转移性激素敏感性前列腺癌(mHSPC)患者。
血液肿瘤(8款新药获得NMPA批准)
新药:盐酸米托蒽醌脂质体注射液
机制:蒽环类抗肿瘤药
企业:石药集团
批准时间:2022年1月7日
适应症:适用于既往至少经过一线标准治疗的复发或难治的外周 T 细胞淋巴瘤(PTCL)成人患者。
新药:艾伏尼布片
机制:IDH1抑制剂
企业:基石药业
批准时间:2022年1月30日
适应症:用于治疗携带易感异柠檬酸脱氢酶-1(IDH1)突变的复发性或难治性急性髓系白血病(AML)成人患者。
新药:度维利塞胶囊
机制:口服PI3Kδ/γ双重抑制剂
企业:石药集团
批准时间:2022年3月16日
适应症:既往接受过至少两种系统性治疗的复发或难治性滤泡性淋巴瘤成人患者。
新药:贝林妥欧单抗注射液
机制:CD3-CD19双特异性抗体
企业:百济神州
批准时间:2022年4月27日
适应症:用于治疗儿童复发或难治性 CD19 阳性的前体B细胞急性淋巴细胞白血病。
新药:盐酸丙卡巴肼胶囊
机制:烷化剂药物,也是一种周期非特异性抗肿瘤药
企业:兆科药业
批准时间:2022年4月19日
适应症:晚期霍奇金淋巴瘤
新药:瑞帕妥单抗注射液
机制:新型抗CD20单抗
企业:神州细胞
批准时间:2022年8月23日
适应症:联合CHOP(环磷酰胺+多柔比星+长春新碱+泼尼松)方案治疗弥漫性大B细胞淋巴瘤。
新药:莫格利珠单抗注射液
机制:抗CCR4抗体
企业:协和麒麟
批准时间:2022年10月14日
适应症:治疗蕈样肉芽肿(MF)或塞扎里综合症(SS)成人患者,这是两类常见的皮肤T细胞淋巴瘤。
新药:林普利塞片
机制:PI3Kδ选择性抑制剂
企业:上海璎黎药业有限公司
批准时间:2022年11月9日
适应症:适用于既往接受过至少两种系统性治疗的复发或难治滤泡性淋巴瘤成人患者。
皮肤癌(1款新药获得NMPA批准)
新药:普特利单抗注射液(普佑恒)
机制:PD-1单抗
企业:乐普生物
批准时间:2022年9月20日
适应症:用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤。
神经系统肿瘤(1款新药获得NMPA批准)
新药:那西妥单抗注射液
机制:GD2单抗
企业:赛生医药
批准时间:2022年11月30日
适应症:与粒细胞-巨噬细胞集落刺激因子(GM-CSF)联合给药,用于治疗伴有骨或骨髓病变,对既往治疗表现为部分缓解、轻微缓解或疾病稳定的复发性或难治性高危神经母细胞瘤的儿童(1岁及以上)或成人患者
癌症并发症(2款新药获得NMPA批准)
新药:盐酸曲拉西利
机制:细胞周期蛋白依赖性激酶4/6(CDK4/6)抑制剂
企业:先声药业
批准时间:2022年7月12日
适应症:用于既往未接受过系统性化疗的广泛期小细胞肺癌(ES-SCLC)患者,在接受含铂类药物联合依托泊苷方案治疗时的预防性给药,以降低化疗引起的骨髓抑制的发生率。
新药:甲苯磺酰胺注射液
机制:经纤维支气管镜肿瘤内局部注射的化学消融药物
企业:天津红日健达康
批准时间:2022年11月15日
适应症:用于减轻中央型非小细胞肺癌成人患者的重度气道阻塞。
FDA又将引领哪些研发浪潮?
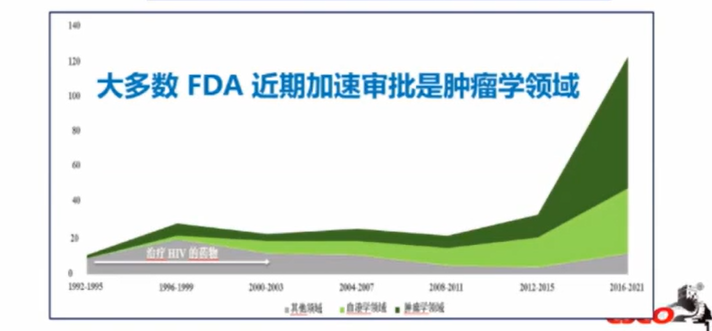
图片来源:2022年CSCO大会
FDA批准新药(共10款按时间顺序排列)
新药:Kimmtrak(全球首款T细胞受体(TCR)疗法)
有效成分:tebentafusp-tebn(双特异性gp100肽-HLA导向的CD3T细胞接合剂)
批准时间:2022年1月25日
适应症:治疗HLA-A*02:01阳性的成人不可切除或转移性葡萄膜黑色素瘤患者
新药:Opdualag(免疫治疗新靶点:LAG-3)
有效成分:nivolumab and relatlimab-rmbw(首创的双免疫联合固定剂量复方制剂)
批准时间:2022年3月18日
适应症:治疗12岁以上患有不可切除或转移性的黑色素瘤患者
新药:Pluvicto
有效成分:lutetium (177Lu) vipivotide tetraxetan(PSMA靶向配体放射疗法)
批准时间:2022年3月23日
适应症:用于治疗PSMA阳性,且经过紫杉烷类化疗和雄激素受体信号通路抑制剂治疗的转移性去势抵抗性前列腺癌(mCRPC)患者
新药:Lytgobi
有效成分:futibatinib(口服、高选择性、不可逆的酪氨酸激酶抑制剂)
批准时间:2022年9月30日
适应症:治疗携带FGFR2基因重排(包括基因融合)的局部晚期或转移性胆管癌患者
新药:Imjudo
有效成分:tremelimumab(抗CTLA-4抗体)
批准时间:2022年10月21日
适应症:与抗PD-L1抗体Imfinzi(durvalumab)联用,治疗不可切除的肝细胞癌患者(首个双重免疫疗法)。
新药:Tecvayli
有效成分:teclistamab-cqyv(首创的BCMAxCD3双特异性T细胞结合抗体)
批准时间:2022年10月25日
适应症:治疗成人复发或难治性多发性骨髓瘤(RRMM)患者
新药:Elahere
有效成分:mirvetuximab soravtansine-gynx(首创的用于铂类药物耐药疾病的抗体偶联药物(ADC))
批准时间:2022年11月14日
适应症:用于既往接受过1~3种全身治疗方案的叶酸受体α (FRα) 阳性、铂类耐药的上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者。
新药:Rezlidhia
有效成分:olutasidenib(口服小分子突变异柠檬酸脱氢酶-1 (IDH1)抑制剂)
批准时间:2022年12月1日
适应症:用于治疗易感异柠檬酸脱氢酶-1 (IDH1)突变的成人复发或难治性急性髓系白血病。
新药:Krazati
有效成分:adagrasib(全球第二款KRAS G12C抑制剂)
批准时间:2022年12月12日
适应症: 治疗KRAS基因G12C突变的局部晚期或转移性非小细胞肺癌(患者既往至少接受过一次全身治疗)
新药:Lunsumio
有效成分:mosunetuzumab-axgb(首款滤泡性淋巴瘤CD20xCD3双特异性抗体)
批准时间:2022年12月22日
适应症:用于治疗复发或难治性滤泡性淋巴瘤(一种非霍奇金淋巴瘤)。
“以患者为中心”的新时代
面临哪些问题?

(图片来源:2022年CSCO大会)
新药研发和临床试验已进入新时代,核心理念由“以疾病为中心”转变为“以患者为中心”。肿瘤治疗面临肿瘤发病机制复杂、肿瘤细胞异质性和耐药性等问题。以患者为中心的抗肿瘤新药研发、临床试验及选择临床用药,都有赖于选择精准人群,其中基于精准患者人群单药疗效差别大、联合用药中如何达到疗效最优与安全性可控、各个治疗线数获益不一致的情况下如何跨线治疗,将是各界同仁在抗肿瘤新药研发、临床试验与治疗中要慎重考虑的重中之重。
肿瘤是人类最棘手的难题,也是付出心力最多的领域,患者获益是每一个人的期望。如本文有帮助,请积极转发,让更多的患者看到希望。

(图片来源:2022年CSCO大会)
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)