2022-06-23 来源 : BiG生物创新社 ,作者BiG专栏

前言
肿瘤的发生和发展与癌细胞的代谢重编程相关。会耗尽某些营养物质的肿瘤微环境(TME)通过诱导营养物清除机制来维持癌细胞增殖,从而迫使癌细胞适应。TME中癌细胞以外细胞类型(包括内皮细胞,成纤维细胞和免疫细胞)的代谢也可以调节肿瘤进展。转移是癌症患者死亡的主要原因,人们一直努力了解转移细胞如何调控代谢。另外,利用肿瘤遗传分析对患者分层和/或饮食干预并结合靶向代谢的疗法引起人们关注。在本文中,美国西北大学Navdeep S. Chandel团队全面概括了肿瘤代谢领域的最新研究进展,并特别强调了尚未得到解答的问题。
背景介绍
肿瘤代谢起源于1931年诺贝尔医学或生理学奖得主奥托·瓦伯格(Otto Warburg)对线粒体呼吸链复合物IV的观察。1920年代,Warburg观察到,与正常组织相比,体外肿瘤组织切片即使在氧气存在下也会使用大量葡萄糖产生乳酸,这种现象被称为有氧糖酵解或Warburg效应。
为什么在肿瘤组织中会出现Warburg效应呢?Warburg推测癌细胞引起这种“呼吸损伤”后,分化细胞才能转化为增殖性癌细胞,即Warburg效应促进肿瘤产生。这种推测合理吗?或许可以追溯下肿瘤代谢领域的研究结果。
在20世纪90年代,人们认识到糖酵解酶乳酸脱氢酶A(LDHA)是癌基因MYC的转录靶标,并且是增加癌细胞的糖酵解和致瘤潜力所必需,而且蛋白激酶B(AKT),哺乳动物雷帕霉素靶蛋白(mTOR)和缺氧诱导因子(HIFs)的失调在肿瘤存活和生长中是必需的。在本世纪初,大部分研究集中在为什么Warburg效应对肿瘤生长有利。一种解释是,通过增加糖酵解,糖酵解中间体可以进入合成代谢的旁途径,以支持细胞增殖所需的核苷酸,脂质和氨基酸的从头合成。
回看肿瘤代谢领域的研究结果,可以发现Warburg的推测似乎是合理的。但肿瘤的形成肯定不只有Warburg效应这一个驱动因素,本篇综述就总结了肿瘤代谢领域最近的关键进展,并强调了在肿瘤代谢中尚未解答的关键体内问题(box1)。
box1 破译癌细胞体内代谢的关键问题
● 如何使用成像、磁共振和质谱技术来检测小鼠癌症模型和癌症患者肿瘤微环境(TME)中的癌细胞和正常细胞的代谢异质性?
● 与癌细胞相比,TME中非恶性细胞以及体内正常分化细胞的代谢和营养感应信号通路在发育、生理学或不同病理学中是如何发挥作用的?
● 为什么琥珀酸盐、延胡索酸或D/L-2-羟基戊二酸(D/L-2HG)的积累仅在某些组织中发挥致瘤作用,以及这些肿瘤代谢物如何改变基因表达?
● 一些代谢酶如何通过非催化机制推动肿瘤进展?
● 哪些活性氧(ROS),即超氧物(O2-)、过氧化氢(H2O2)、羟基自由基(-OH)和脂质过氧化氢(LOOH),促进或抑制肿瘤的发生和发展?肿瘤发生和进展的相关活性氧靶点是什么?
● 起源组织、驱动突变和TME造成的体内代谢脆弱性是什么?
● 是否有不参与合成代谢途径的不同代谢物促进转移性侵袭性细胞表型和转移性休眠?当癌细胞通过循环系统和淋巴系统时,其代谢如何改变以支持细胞存活,最终导致癌细胞在远端定植?
● 宿主的机体代谢如何控制肿瘤的发生和发展?不同的癌细胞在体内利用哪些碳燃料?
● 如何将靶向代谢途径与癌症遗传学、饮食和/或标准护理疗法(如免疫疗法)最佳结合?为什么目前针对代谢的有效疗法,例如5-氟尿嘧啶(5-FU)对某些患者有效,而对其他患者无效?
● 衰老是否通过细胞内和/或机体代谢变化增加癌症风险?
01
合成代谢与肿瘤生长
癌细胞选择糖酵解、单碳代谢、线粒体ETC和TCA循环代谢途径的必要性是维持核苷酸和血红素合成。调节新陈代谢的酶还具有“兼职功能”。例如肾癌和肝癌中的糖异生酶果糖-1,6-双磷酸酶1(FBP1)的缺失,以及软组织肉瘤中的FBP2的缺失,它们可以通过催化依赖性的糖酵解通量增加和催化非依赖性的基因表达控制促进肿瘤的发生(图2a)。同位素标记葡萄糖显示,肿瘤中通过糖酵解和TCA循环的葡萄糖氧化通量增强。代谢通量研究发现包括乳酸和谷氨酰胺在内的多种营养物质输送碳进入TCA循环。使用定量方法破译健康组织与肿瘤组织中合成代谢途径的不同十分重要。
 图1 支持肿瘤生物量生产的代谢和信号通路
图1 支持肿瘤生物量生产的代谢和信号通路02
参与的信号通路
癌细胞通过中间代谢增加代谢通量以维持增殖,从而共同选择信号传导途径和转录网络(例如,PI3K-AKT-mTORC1和MYC)(图1a)。mTORC1途径已经成为营养物质感应的中心节点,并且是增殖细胞中通过脂质和核苷酸合成等途径增加合成代谢通量的调节者。目前正在探索的一个关键领域是癌细胞在MYC和mTORC1过度活化时产生的代谢脆弱性,这可能在减少癌细胞增殖和存活方面提供独特的治疗干预。研究正常细胞和癌细胞体内的信号传导和代谢途径将产生对体内代谢调节的新见解。
03
代谢物作为信号分子
在特定肿瘤中,由于琥珀酸脱氢酶(SDH)亚基和延胡索酸酶(FH)的编码基因发生功能缺失突变,以及编码异柠檬酸脱氢酶1或2(IDH1或IDH2)的基因发生新形态突变,使肿瘤代谢物琥珀酸盐,延胡索酸和2-羟基戊二酸盐(2HG)的含量增加(图2b)。这些肿瘤代谢物的积累如何在某些组织中发挥致瘤作用呢?这些代谢物之间共有的特征是它们通过与α-KG的结构相似,竞争性抑制α-KG依赖性双加氧酶(α-KGDDs)的能力(图2b)。这些肿瘤代谢物已被证明抑制参与调节表观遗传修饰的双加氧酶。除了癌症之外,这些肿瘤代谢物还与各种组织功能相关,包括免疫功能和对机体代谢的控制。
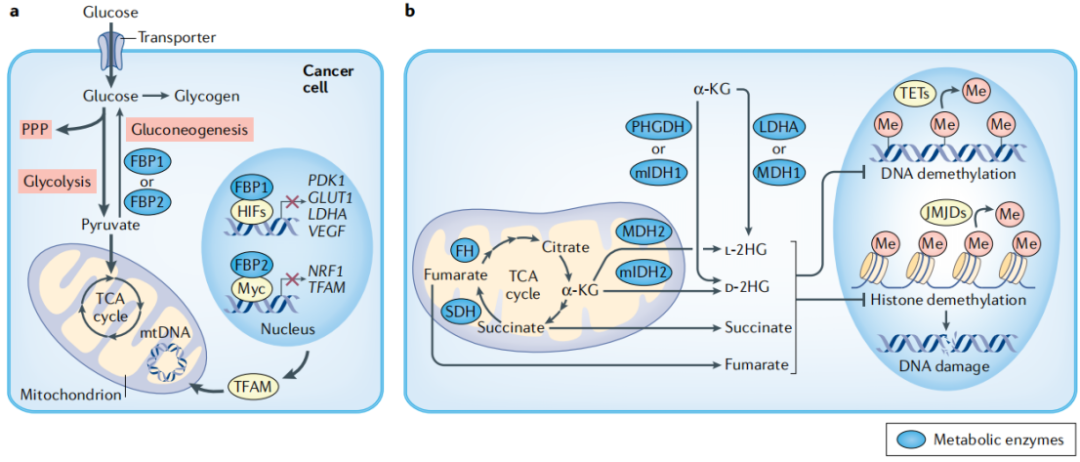
图2 癌症代谢中的信号传导和非经典机制
04
ROS在肿瘤进展中的作用
癌细胞产生ROS的主要种类是超氧化物(O2-), 过氧化氢(H2O2),羟基(-OH)和脂质氢过氧化物(LOOH)。癌细胞通过超氧化物歧化酶1(SOD1)或SOD2迅速产生H2O2。H2O2可以通过氧化还原信号传导促进癌细胞的增殖,存活和侵袭(图3),也可通过过氧化物酶解毒成水。LOOH可以诱导铁死亡。癌细胞利用BH4-DHFR等可以将LOOH还原为无害的脂质醇(LOH),防止铁死亡(图3)。癌细胞中ROS产生的速率要高于正常细胞。限制ROS对于肿瘤细胞起始发生是必需的,而维持ROS水平会促进转移。未来需要开发用于测量不同类型ROS的特异性探针,以及在肿瘤进展期间特异性调节不同类型ROS的遗传干预,以使癌症背景下的ROS生物学变得清晰。

图3 ROS在癌细胞中的生物学特性
05
营养供应
尽管癌细胞中重编程代谢的内在效应已被广泛描述,但癌细胞在低营养和酸性TME的环境中增殖的机制尚不完全清楚。肿瘤类型、解剖位置和宿主饮食共同影响营养的可用性。当营养物质或生长因子不足时,自噬是允许细胞存活和增殖的关键途径之一(图4)。巨胞饮作用是另一种支持细胞适应营养缺乏的途径,它允许细胞内化细胞外蛋白质和坏死细胞碎片(细胞坏死),并将其输送到溶酶体中降解,从而支持大分子合成并进入中央碳代谢途径(图4)。
06
TME中的代谢
除了营养供应和酸性条件变化外,体内TME的另一标志是其由不同细胞类型构成,这有助于控制肿瘤进展(图4)。一个简化模型是内皮细胞和基质细胞支持肿瘤生长,而细胞毒性T细胞(CTLs)可以减少肿瘤进展(图4)。癌细胞必须与TME中的其他各种细胞类型竞争营养。除了营养竞争之外,TME中不同细胞类型之间也存在代谢串扰,这是癌细胞在不利条件下持续生长的策略。以癌症细胞中的特定代谢途径为治疗靶点,可能会对TME中的其他细胞产生类似或不同的影响,进而决定治疗效果。

图4 TME内细胞的代谢串扰
07
代谢转移的控制
转移是癌症患者死亡的主要原因。破译转移和定植于远端部位细胞的代谢脆弱性至关重要。代谢变化与转移中多个步骤过程有关:基底膜的侵袭和细胞迁移到周围的血管或淋巴系统(即内渗);在循环中生存;血管系统的外渗和继发肿瘤部位的定植(图5)。在未来的几年里,人们将更多地关注对于转移是必不可少的代谢途径。与原发肿瘤相比,尚不完全了解哪些代谢物控制支持远端转移生态位生长的信号通路。关于代谢如何促进转移的不同步骤,还有很多有待发现(图5)。
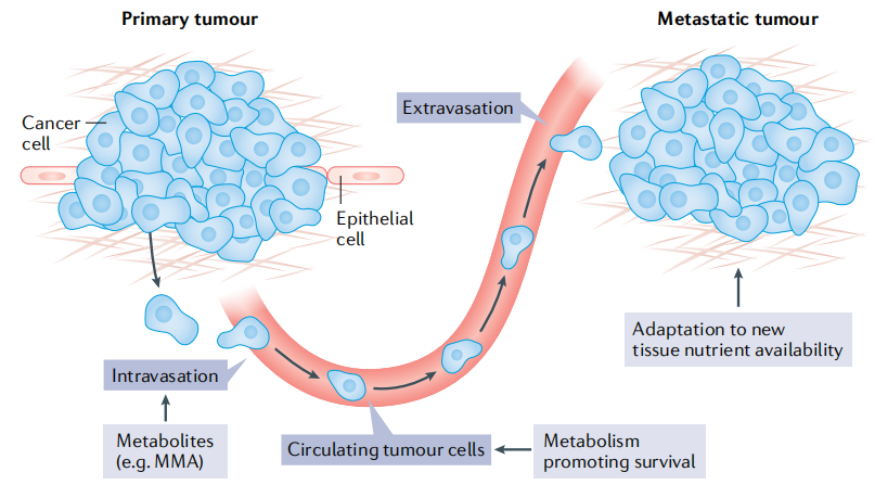
图5 代谢调节转移的多步骤
08
靶向代谢治疗
代谢酶似乎是癌症治疗中有吸引力的治疗靶点,但由于对正常组织的毒性等多种原因,针对代谢的新药一直很少。目前巨大的挑战是确定是否存在一个治疗窗口,允许选择性靶向对正常组织毒性最小的特定抗氧化蛋白。机体代谢对于确定癌症治疗的疗效也至关重要。靶向代谢需要一种“个性化医学”方法来确定癌细胞或机体代谢靶点,这种方法结合了标准的护理治疗和特定基因 (图6)。

图6 针对肿瘤代谢的个性化医疗方法
总结
参考文献:
Martínez-Reyes I, Chandel NS. Cancer metabolism: looking forward. Nat Rev Cancer. 2021; 21(10):669-680.
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)