
2023年2月17日,西湖大学施一公及张晓峰共同通讯在Nature Communications 在线发表题为“Mechanisms of the RNA helicases DDX42 and DDX46 in human U2 snRNP assembly”的研究论文,该研究揭示了人U2 snRNP 组装中RNA解旋酶DDX42和DDX46的作用机制。该研究报道了DDX42-SF3b复合物的冷冻电镜结构和含有DDX42 (DDX42-U2复合物)的17S U2 snRNP的组装前体。DDX42通过N端序列锚定在SF3B1上,其N-plug占据SF3B1的RNA通路。DDX42与SF3B1的结合模式与DDX46的结合模式有着惊人的相似。在DDX42-U2复合物中,DDX42的N端仍然锚定在SF3B1上,但解旋酶结构域已被U2 snRNA和TAT-SF1取代。通过体外实验,作者发现DDX42和DDX46在与SF3b的结合方面是互斥的。SF3B1的癌症驱动突变靶向RNA路径中直接与DDX42和DDX46相互作用的残基。这些发现揭示了DDX42和DDX46在17S U2 snRNP组装中的不同作用,并为SF3B1癌症突变的机制提供了见解。另外,2023年1月13日,西湖大学施一公、黄高兴宇及曾超共同通讯在Current Opinion in Structural Biology 在线发表题为“Structure of the nuclear pore complex goes atomic”的综述文章,该综述总结了最近在破译NPC分子细节方面的进展,这些进展在快速发展的冷冻电镜技术、X射线晶体学和机器学习支持的结构预测方面得到了极大的进展。最近在冷冻电镜(cryo-EM)重建、机器学习支持的结构预测和生化重建方面的突破结合起来,以前所未有的精度生成了NPC的分子模型。此外,在细胞冷冻电子断层扫描(cryo-ET)结构揭示了NPC的实质性结构动力学。这些进步使NPC大的组织原则和职能更加清晰。
2023年1月2日,西湖大学施一公团队在Cell Research(IF=46)在线发表题为“LilrB3 is a putative cell surface receptor of APOE4”的研究论文,该研究表明LilrB3是APOE4的假定细胞表面受体。该研究证明APOE4,而不是APOE2,特异性地与白细胞免疫球蛋白样受体B3 (LilrB3)相互作用。LilrB3胞外结构域(ECD)的两个离散免疫球蛋白样结构域识别APOE4的N端结构域(NTD)上带正电荷的表面斑块。该原子结构揭示了两个APOE4分子如何特异性地与两个LilrB3分子结合,通过形成异质四聚体复合物将它们的细胞内信号基元靠近。与生化和结构分析一致,APOE4,而不是APOE2,以Lilrb3依赖的方式激活人类小胶质细胞(HMC3)进入促炎状态。总之,该研究确定LilrB3可能是APOE4的免疫细胞表面受体,而不是APOE2,这可能有助于理解APOE亚型的生物学功能和疾病相关性。
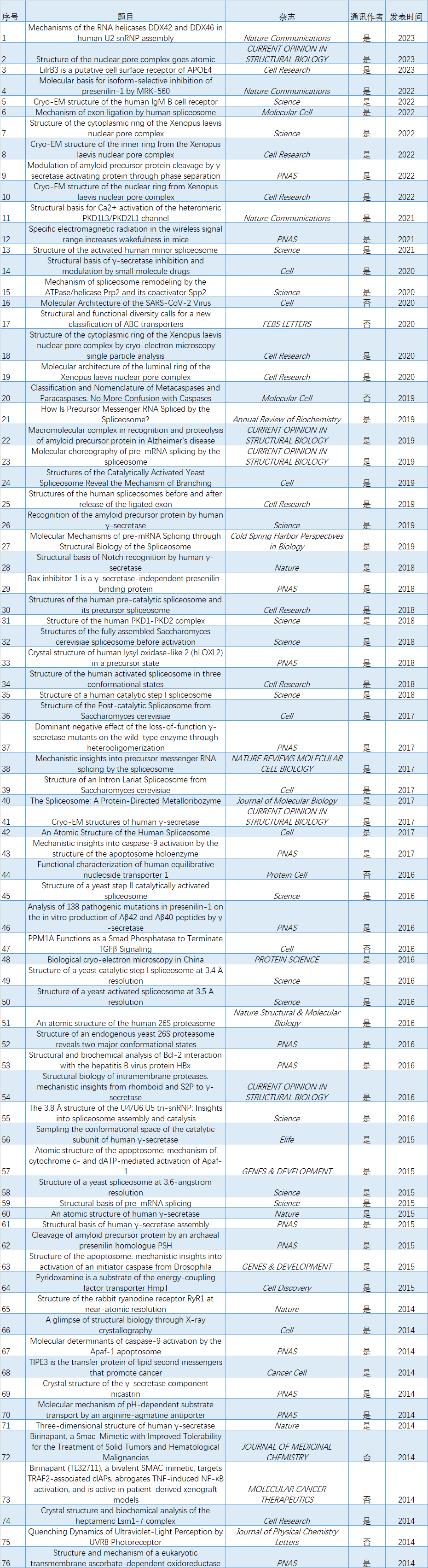
最后,iNature编辑部结合Pubmed及Web of Science发现施一公团队从2014年到2023年(截至2023年3月23日)在Nature (4篇),Science (14篇),Cell (7篇),Cell Research (9篇),PNAS(15篇),Nature Communications (3篇),Protein Cell (3篇)及CURRENT OPINION IN STRUCTURAL BIOLOGY (5篇)等发表76篇文章(包括综述及研究论文,通讯作者的有68篇文章)(文章后附列表),专注于剪接复合物,核孔复合物及分泌酶等的结构解析。另外,由于时间匆忙,如有错误,可向编辑部反馈。76篇文章列表如下:
www.nature.com/articles/s41467-023-36489-x
医微客一站式科研服务平台,致力于服务医院和企业,协助医生解决科研上的痛点,提升临床科研水平,为企业提供医学写作、医学编辑、科研培训和学术传播等策略支持。
科研资讯(站内):
百度浏览
来源 : 诚信科研、iNature
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。








发表评论
注册或登后即可发表评论
登录注册
全部评论(0)