2024-01-09


先导编辑(Prime Editing,PE)是刘如谦团队于2019年开发的一种强大的新型精准基因编辑技术,先导编辑能够实现对目标基因序列的替换、删除和插入,这种多功能性使先导编辑系统特别有希望用于治疗人类的各种遗传疾病。
先导编辑器(Prime Editor)是一种工程蛋白,由一个DNA切口酶(Cas9 nickase)和一个工程逆转录酶(RT)组成的融合蛋白,在pegRNA引导下靶向编辑目标基因位点。而且其编辑过程不依赖于DNA双链断裂或供体DNA模板,因此,相比CRISPR-Cas9等基因编辑技术更安全。
要想充分实现先导编辑系统在研究和治疗中的潜力,就需要安全且高效地将其递送到体内特定组织中。目前已有几项研究通过病毒递送系统进行了先导编辑器的体内递送。然而,最常用的体内基因递送系统——腺相关病毒(AAV)的无法装载先导编辑器,需要将其分拆为两部分,使用两个AAV载体分别递送,这降低了体内基因编辑效率。此外,基于病毒载体的递送系统还存在潜在的安全风险,包括持续转基因表达导致的脱靶编辑增加,以及向宿主基因组整合的风险。
非病毒递送载体,例如脂质纳米颗粒(LNP),通过递送先导编辑器的mRNA,避免了其中一些问题,但其向体内肝脏以外组织的靶向递送仍是一个未被解决的挑战。
2024年1月8日,刘如谦(David Liu)团队在 Nature Biotechnology 期刊发表了题为:Engineered virus-like particles for transient delivery of prime editor ribonucleoprotein complexes in vivo 的研究论文。
该研究开发了用于递送先导编辑器的工程化类病毒颗粒系统——PE-eVLP,能够向体内递送核糖核蛋白(RNP)形式的完整先导编辑系统,进行瞬时先导编辑,在人类细胞中进行了高效先导编辑,在两个遗传性失明小鼠模型中实现了体内碱基编辑并恢复了部分视觉功能。
该研究优化的PE-eVLP系统支持体内瞬时先导编辑,还能减少脱靶编辑、避免基因整合带来的潜在致癌性,增强了先导编辑的安全性。
刘如谦教授表示,基因编辑领域普遍认为,未来基因编辑机制应该最终以蛋白质的形式递送,以最大限度地减少潜在副作用,而这项研究展示了一种有效的方法。目前实验室正在继续积极致力于改进eVLP,并调整该递送载体以靶向体内其他组织。

2022年1月,刘如谦团队在 Cell 期刊发表论文【3】,开发了一种工程化类病毒颗粒(Engineered virus-like particles,eVLP),能够克服基因编辑器递送的多个瓶颈,成功递送了碱基编辑器(Base Editor)并在小鼠体内实现高效基因编辑。
因此,eVLP可作为一种有潜力的治疗性大分子递送载体,它结合了病毒递送载体和非病毒递送载体的关键优势,能够将基因编辑工具递送到细胞和体内器官中,实现高效基因编辑,且具有最低的脱靶效应,安全性很高。
作为体内先导编辑(PE)递送的候选载体,eVLP相比其他递送载体具有几个显著优势:
1、eVLP不受严格的递送货物大小限制,因此不需要将先导编辑器进行分拆递送;
2、eVLP可以直接包装递送核糖核蛋白(RNP)形式的基因编辑器,从而进行瞬时基因编辑,可有效减少脱靶编辑的频率;
3、eVLP完全由蛋白质自组装形成,不含DNA,避免了不必要的病毒遗传物质整合到宿主细胞基因组的风险;
4、eVLP可以通过不同的糖蛋白进行假病毒化修饰,从而实现对器官或细胞的特异性靶向。
在这项最新中,刘如谦团队开发了一种递送先导编辑的工程化类病毒系统——PE-eVLP,PE-eVLP可以将完整的先导编辑系统以核糖核蛋白(RNP)形式进行体内递送。在刘如谦团队之前开发的递送碱基编辑的工程化类病毒系统BE-eVLP中,简单地将碱基编辑器(BE)替换为先导编辑(PE),能够产生非常低编辑效率(在培养的哺乳动物细胞中编辑效率<1%)。

通过系统地识别PE-eVLP递送瓶颈并设计相应的解决方案,研究团队开发了第三代v3 PE-eVLP,与v1 PE-eVLP相比,其在小鼠脑神经瘤细胞(Neuro-2A细胞)中的先导编辑效率提高了79倍,在人类HEK293T细胞中的编辑效率提高了170倍。

接下来,研究团队进行了小鼠体内实验,单次视网膜下注射v3 PE-eVLP,可在小鼠体内实现高效先导编辑,在rd6视网膜色素变性小鼠模型中纠正了Mfrp基因的4bp缺失(平均编辑效率为15%),并在Leber先天性黑蒙(LCA)2型的rd12小鼠模型中替换了Rpe65基因突变(平均编辑效率为7.2%),从而部分恢复了它们的视觉功能。该研究还显示,PE-eVLP还可以有效地编辑活体小鼠大脑中的基因。
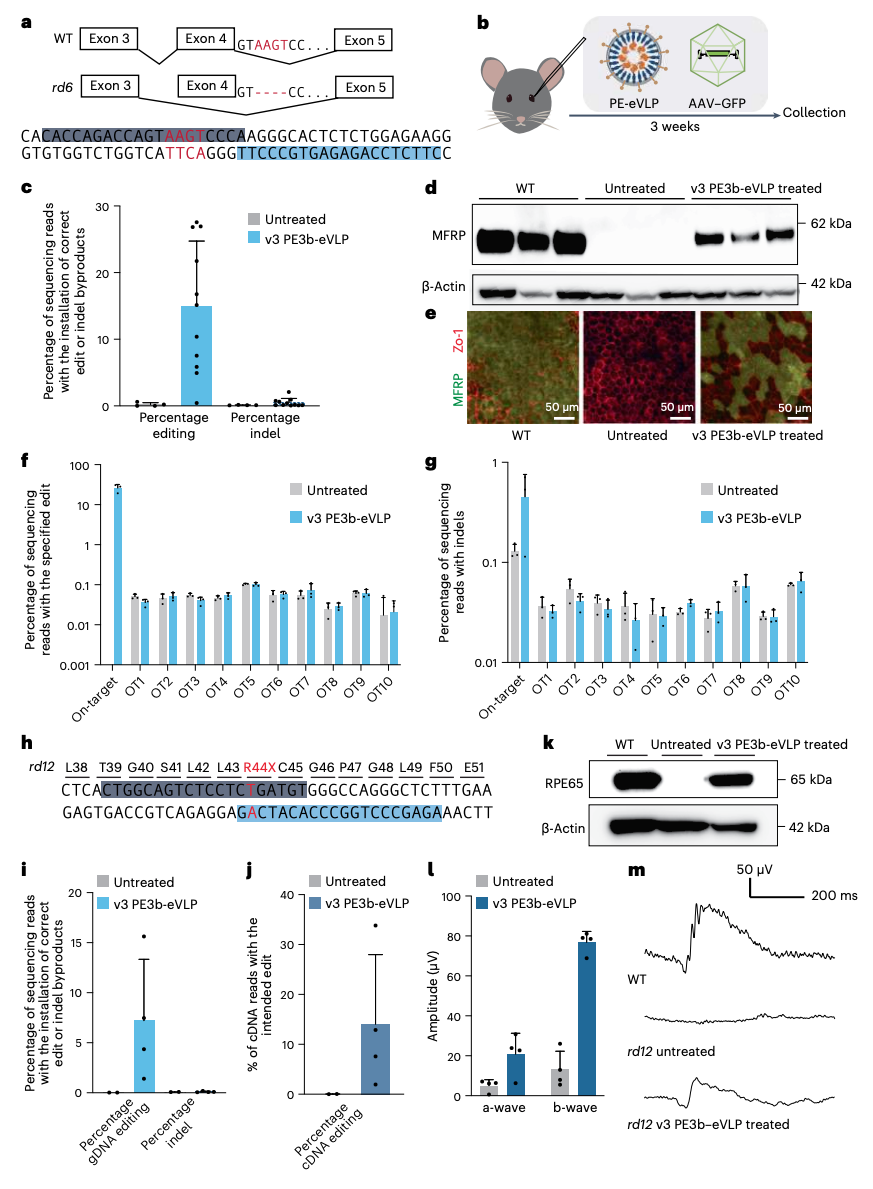
总的来说,该研究开发的PE-eVLP系统,作为一种新的非病毒递送系统,能够支持体内瞬时先导编辑,还能减少脱靶编辑、避免基因整合带来的潜在致癌性,增强了先导编辑的安全性。
值得一提的是,2023年10月份,刘如谦教授曾在第七届Chardan遗传医学年会上表示,将在2024年进行先导编辑的首次临床试验。
刘如谦教授创立的先导编辑公司 Prime Medicine 在其官网上共列出了18个研发项目,目前进度最快的是治疗慢性肉芽肿病(CGD)的疗法,处于IND申报阶段。这是一种X染色体连锁隐性遗传疾病,患者反复发生全身各部位的化脓性感染,严重者会发生败血症而危及生命。临床前研究显示,先导编辑精确修复了慢性肉芽肿病(CGD)患者的CD34+造血干细胞的致病突变,编辑水平超过92%,并恢复了这些细胞后代的NADPH氧化酶活性和髓细胞功能。
研发管线



论文链接:
1. www.nature.com/articles/s41586-019-1711-4
2. www.nature.com/articles/s41587-023-02078-y
百度浏览 来源 : 生物世界
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)