在临床实际应用过程中,不同靶点,不同厂家的免疫检查点抑制剂的治疗效果是不同的,即使是同靶点的PD-1抗体,也是有差异的,本文是方便自己梳理思路,积累素材,只是一家之言,如能对你有所启迪,也是幸事。
目前,在临床应用比较广泛的ICIs,包括抗PD-1单抗、抗PD-L1单抗、抗CTLA-4单抗,本文主要探讨抗PD-1单抗。
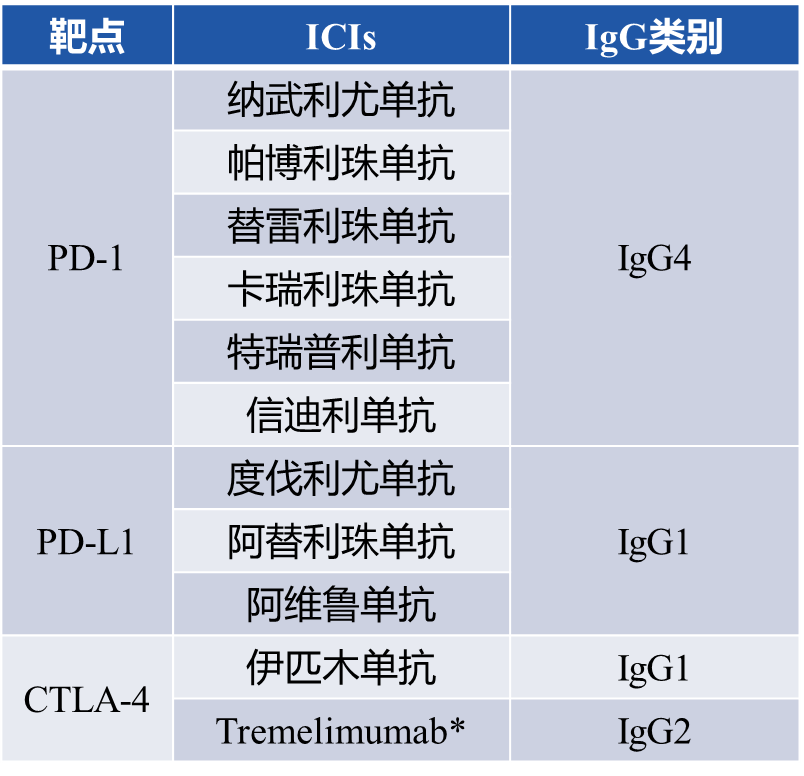
IgG类的抗体,有四种亚型:IgG1、IgG2、IgG3、IgG4,在没有PD-1抗体获批以前,基本上绝大多数的肿瘤抗体类药物采用的抗体亚型都是IgG1亚型,原因主要有两点:- IgG1血液中含量高,稳定性高,易生产纯化,成本低,是现阶段最常被使用的Fc亚型。
- IgG1抗体Fc段介导的ADCC(抗体介导的细胞毒性)、ADCP(抗体介导的细胞吞噬)、CDC(补体介导的细胞毒性)效应是最强的。
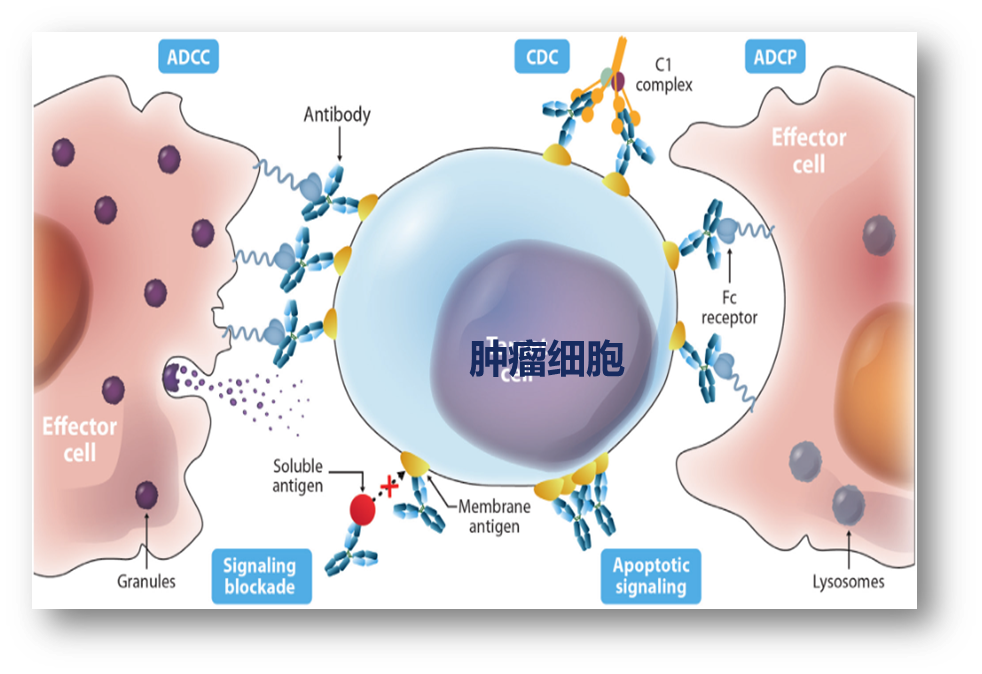
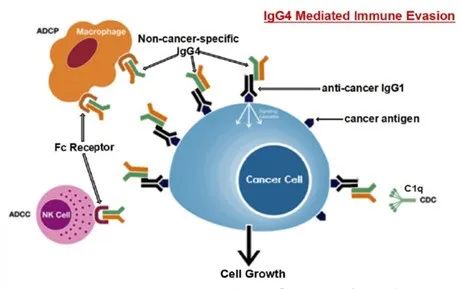
以Her2靶点抗体-曲妥珠单抗为例,曲妥珠单抗通过Fab端特异性识别并结合表达Her2靶点的肿瘤细胞,曲妥珠单抗的Fc段可以与巨噬细胞的FcγR(Fcγ受体,是一类能与抗体Fc端结合的细胞表面受体)结合,介导ADCP效应,也可以通过与NK细胞的FcγR结合,介导ADCC效应,并通过C1q启动CDC效应,进而清除结合的靶细胞,即表达Her2靶点的肿瘤细胞。这是抗肿瘤抗体主要发挥效果的机制。由于PD-1抗体主要是通过Fab端特异性结合T细胞上的PD-1受体,组织肿瘤细胞的PD-L1结合,进而恢复T细胞的免疫识别和杀伤功能,Fc段所介导的ADCC、ADCP、CDC效应会消耗结合的T细胞,是不利的。所以,目前上市的PD-1抗体,基本上采用的都是IgG4亚型,主要原因是天然的IgG4亚型的Fc段介导的ADCC、ADCP、CDC效应是最低的。- Fc-Fc相互作用导致IgG4-Fc易聚集/解离,形成二聚体,并有研究报道,IgG4通过Fc-Fc作用介导免疫逃逸
- IgG4由于其CH3的不稳定性,较IgG1亚型抗体更容易发生聚集/解离
- IgG4通过Fc结合到IgG1及其他IgG4的Fc上
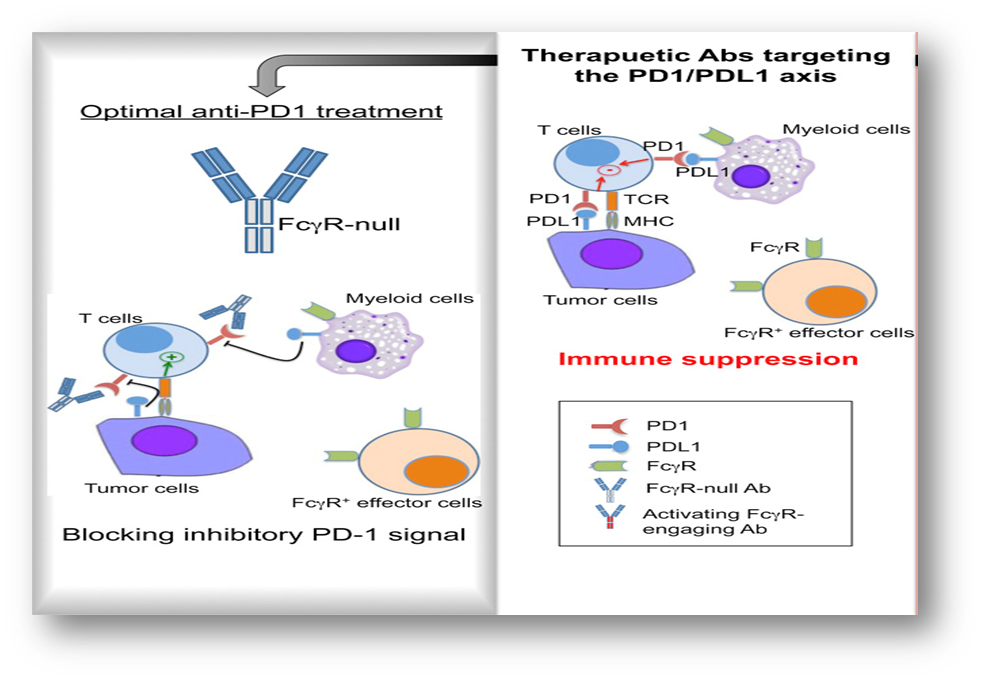
差异原因(二)——ADCC/ADCP活性及细胞因子显著影响PD-1抗体的抗肿瘤活性对于抗PD-(L)1单抗的主要抗体亚型及抗体改造技术综述如下:虽然各家都在Fc段花费了很多精力进行升级改造,各家技术也存在差异,导致了之后的种种效果差异。另外,IgG4并非完全能够去除掉ADCC、ADCP效应。- 抗体Fc段与FcγRs结合后介导巨噬细胞等免疫细胞活化,分泌IL-6,TNF-ɑ等相关细胞因子,增加免疫相关不良反应风险
- 细胞因子IL-8等可结合免疫细胞、肿瘤细胞等,发挥免疫抑制活性,导致疾病进展
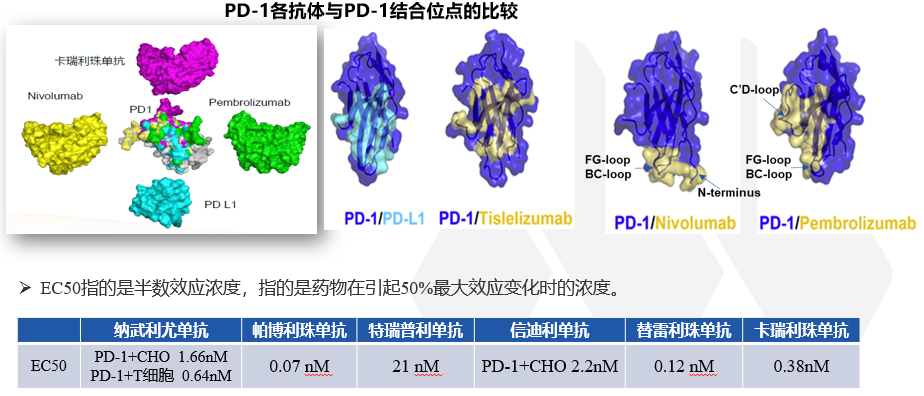
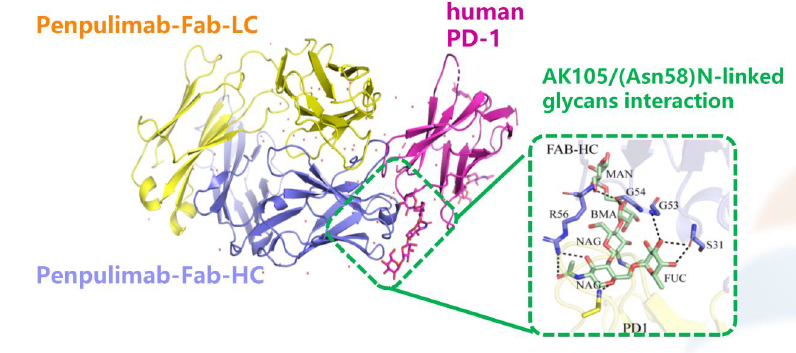
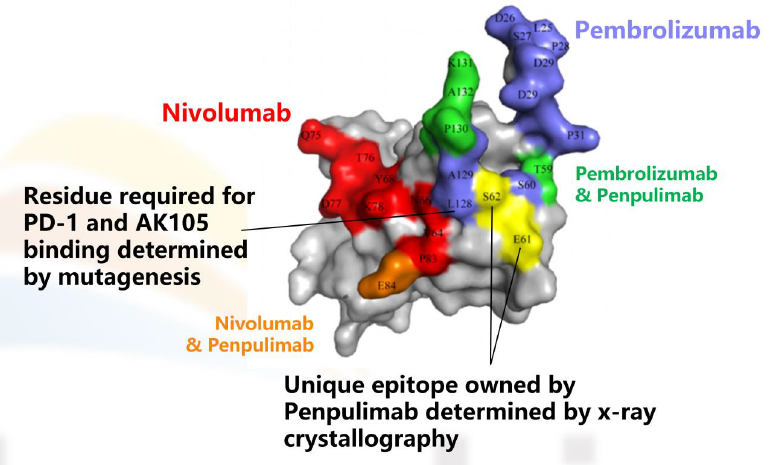
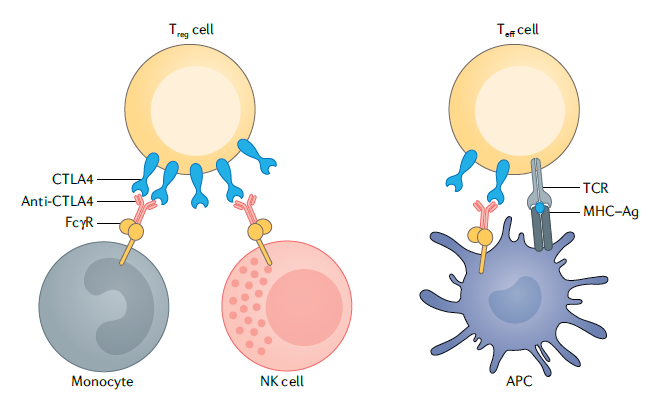
图7. 来源于 DahanR.et al., 2015差异原因(三)——抗体Fab段与PD-1的亲和力和结合部位不同抗体与受体亲和能力的大小以及结合的受体的不同表位,严重影响抗体的疗效。例如:纳武单抗和帕博利珠单抗主要结合在活动的N-端和环形结构表位,而替雷利珠单抗与环形结构表位没有结合作用。当然,也有一个例外,康方生物自主研发的抗PD-1单抗,采用的亚型就是IgG1型,通过Fc段的工程化改造,去除了ADCC、ADCP和CDC效应。晶体衍射分析显示派安普利单抗可以与人PD-1的N-58糖基化位点结合,这可以使得派安普利单抗与PD-1的解离更加缓慢。因此,与纳武利尤单抗(2.43E-04/s)和帕博利珠单抗(2.80E-04/s)相比,派安普利单抗(9.51E-05/s)显示出更慢的解离速率。在此做一个说明。在体内,不仅具有肿瘤细胞识别和毒杀效果的效应T细胞(Teff)会表达CTLA-4,在肿瘤微环境中具有免疫抑制功能的调节性T细胞(Treg)也会表达CTLA-4。理论上,伊匹木单抗结合CTLA-4靶点后,单核细胞(或其他髓系细胞类型)或自然杀伤(NK)细胞上的Fcγ受体的激活会导致Treg细胞的耗竭(左),在Teff细胞中,抗原呈递细胞(APC)上的FcγR受托能够结合伊匹木单抗,阻断CTLA-4靶点,T细胞受体(TCR)能够识别主要组织相容性复合物-抗原肽复合物(MHC–Ag),导致T细胞活性增强。此时,对于伊匹木单抗,亚型的选择就比较纠结了。最终选择的是IgG1亚型。而另一款跟伊匹木单抗同期上临床的抗CTLA-4单抗——Tremelimumab,采用的是IgG2亚型。有关于CTLA-4靶点的争议,本号多篇文章进行过梳理。从今年的ASCO-GI会议上公布的HIMALAYA研究数据来看,我们是可以得出,起始剂量的Treme应用一针之后,是能够明显带来长生存获益的,但ORR数据不如可乐组合,这也是可预见的。
那此时,这样的数据似乎在支持詹姆斯经典的CTLA-4的主要作用是来源于淋巴结内。当然是个人观点,不足为信。Treme(IgG2亚型,弱ADCC效应)与伊匹木单抗(IgG1亚型,强ADCC效应)同期上临床,伊匹木单抗早已经上市,Treme却一直未能单药上市。直到在异质性很高的肝癌领域取得突破。相较于伊匹木单抗宣传的不仅在淋巴结内解除CTLA-4靶点的免疫刹车作用,在肿瘤微环境中还能通过Fc段介导的ADCC效应去杀死具有免疫抑制作用,同样表达CTLA-4靶点的调节性T细胞。而理论上,Treme应该是不具有清除调节性T细胞的作用的,能取得HCC的阳性结果,实属不易,也对当下CTLA-4靶点作用机制的争议增加了话题。具体是否保留ADCC效应,似乎施贵宝是坚定派,旗下三款抗CTLA-4单抗,有一款是通过肿瘤微环境的酸性环境,设计成PH敏感型,Fc段改造增强ADCC效应的抗CTLA-4单抗。另外,O+Y在晚期HCC 1L也应该结束了入组,期待数据的早日披露。
参考文献:
Almagro JC, Daniels-Wells TR, Perez-Tapia SM and Penichet ML (2018) Progress and Challenges in the Design and Clinical Development of Antibodies for Cancer Therapy. Front. Immunol. 8:1751. doi: 10.3389/fimmu.2017.0175.
Udupi A. Ramagopala et al. Structural basis for cancer immunotherapy by thefirst-in-class checkpoint inhibitor ipilimumab.
www.pnas.org/cgi/doi/10.1073/pnas.1617941114.
S.H.Lee, et al.,Yong-Seok Heo,2020 BiochemBiophys Res Comm,527: 226.
Penpulimab, an IgG1 anti-PD-1 antibody with Fc-engineering to eliminate effector functions and with unique epitope and binding properties.DOI:https://doi.org/10.1016/j.annonc.2021.08.280.
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。








发表评论
注册或登后即可发表评论
登录注册
全部评论(0)