2022-06-30 来源 : 康方医学 ,作者北北
肝癌系统治疗的进展,近年来,得益于免疫联合抗血管生成药物联合方案对于肝癌患者ORR、OS等数据的刷新,相应的指南更新频率也在稳步增加。本文主要汇总《原发性肝癌诊疗指南(2022年版)》《NCCN Guidelines Version 1.2022Hepatobiliary Cancers》、《CSCO原发性肝癌诊疗指南2022》等指南/解读综述,并对肝癌领域免疫及抗血管生成药物的具体作用机制进行探索。
肝癌的巴塞罗那分期更新
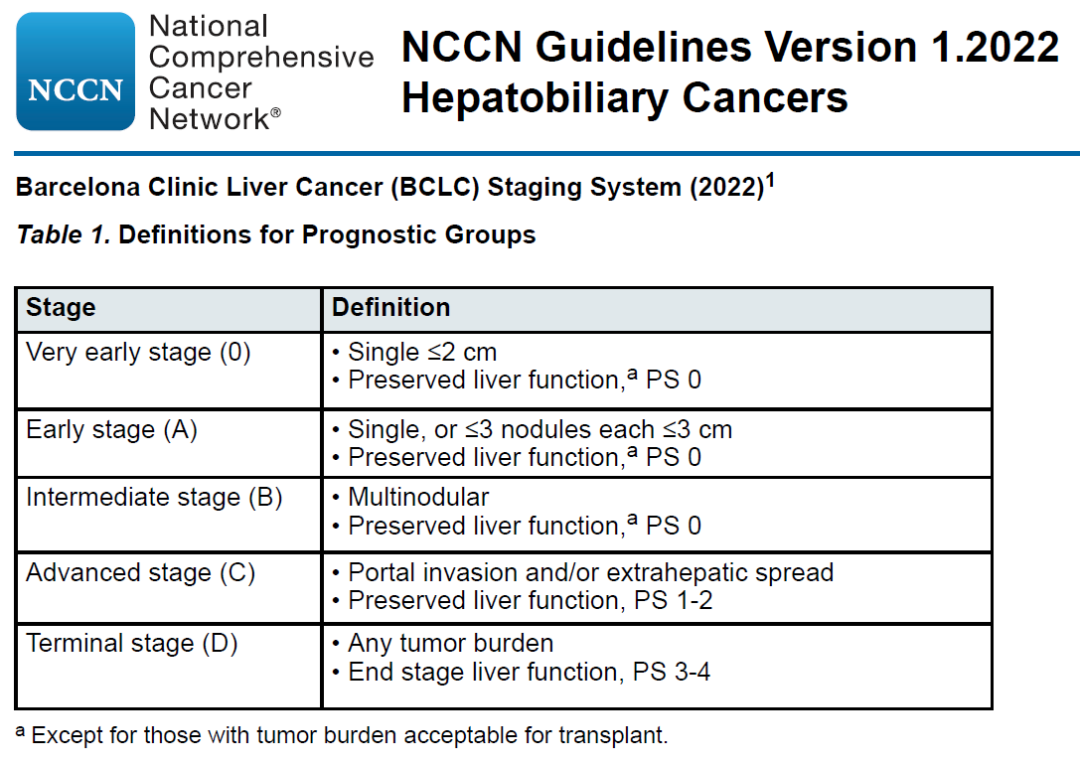
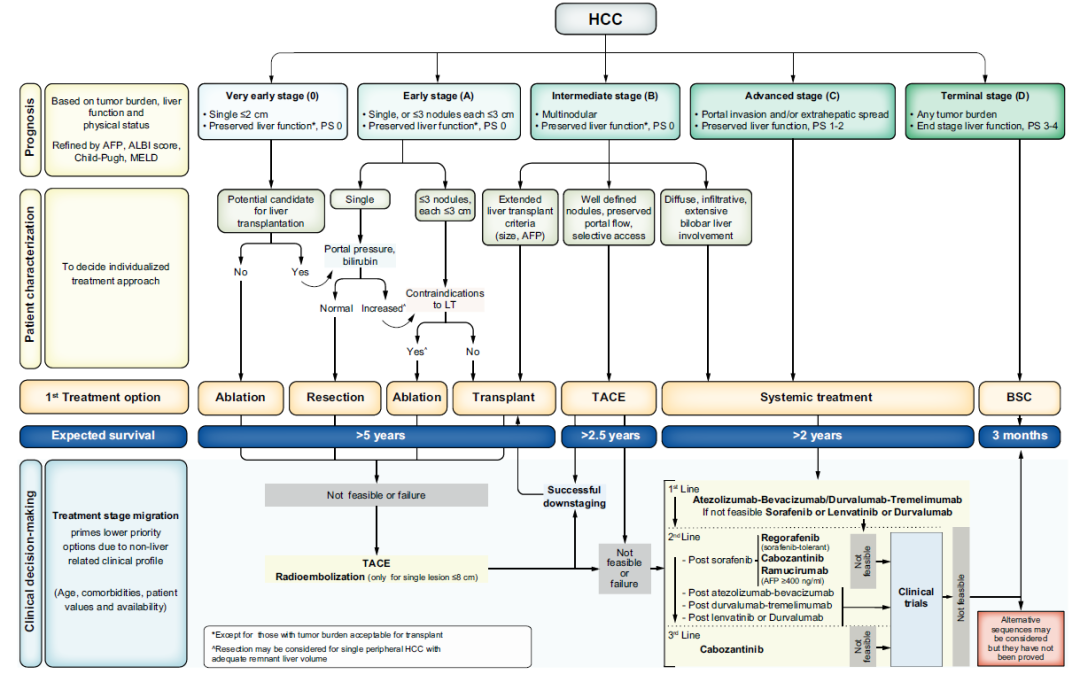
图2. 2022年的BCLC分期和治疗策略
肝癌的五期分期(极早期,早期,中期,进展期和终末期)没有变化,最大的变化在于BCLC B期病人治疗方案的推荐上。更新前,BCLC B期推荐方案仅为TACE治疗,也是饱受争议的一点。2022版指南将B期细化为三个亚组。
肝癌的CNLC分期更新
图3. 中国肝癌临床分期与治疗路线图
相较于BCLC 分期推荐的治疗策略,CNLC分期强调以手术为主的综合治疗策略,积极争取临床治愈。也提出了潜在可切除肝癌的转化治疗,外科学不可切除的CNLC Ⅰa、Ⅰb、Ⅱa期和外科学可切除的CNLC Ⅱb和Ⅲa期肝癌是潜在可切除肝癌,对于这类肝癌,指南建议行转化治疗。转化治疗是将不可切除肝癌转化为可切除,包括局部治疗、系统抗肿瘤治疗。
肝癌的综合分类
随着精准肿瘤治疗时代的到来,高度异质性的肝癌,分子分型的进展也在加速。且在治疗中,不同病因导致的肝癌患者,对于同样的治疗方案,效果可能存在巨大差异。也开始倡导基于病因、分子和组织学特征的肝癌综合分类,进行治疗方案的推荐。
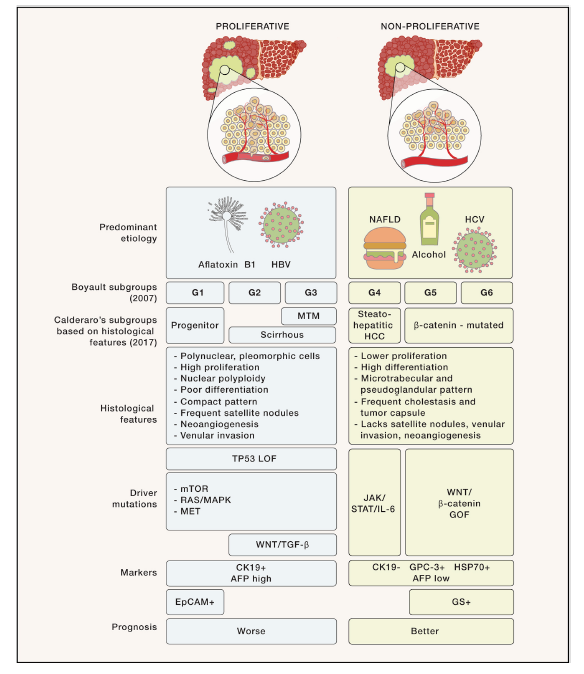
图4. 病因、分子和组织学特征的肝癌综合分类
肝癌可分为两大类:增殖性和非增殖性。
增殖性肝癌表现为促增殖途径的过度激活、更高的新血管生成和侵袭,并与HBV/黄曲霉毒素B1病因和更差的预后相关。增殖性肝癌可进一步细分为G1类,以祖细胞特征为特征;和G2-G3(Scirhous亚型),其特征是WNT/TGF-β途径中的功能获得。
非增殖性HCC分类显示出更高的分化,并与HCV/酒精/NAFLD病因和更好的预后相关。非增殖性HCC可进一步细分为脂肪肝型HCC(G4),显示JAK/STAT通路异常激活,以及β-连环蛋白突变HCC(G5-G6)
肝癌的靶向药物治疗机制及进展
目前被批准用于肝癌治疗的MKIs(多靶点激酶抑制剂)和抗血管生成单克隆抗体的分子,整理如下:
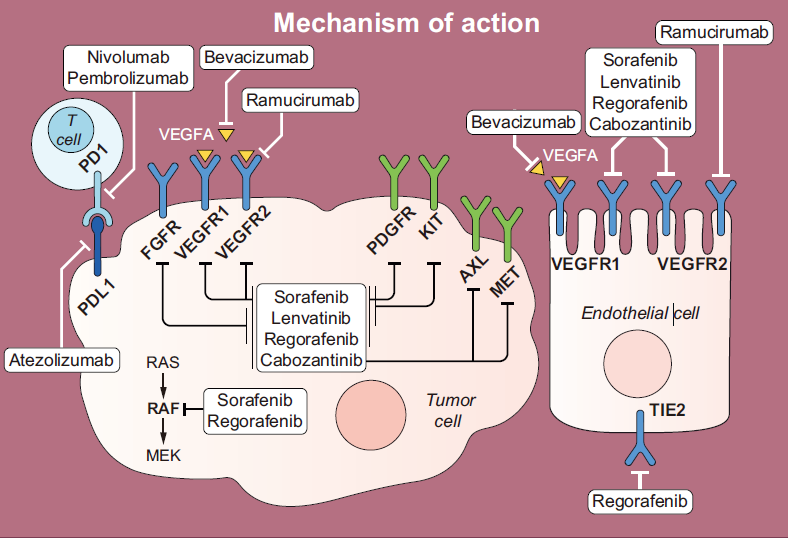
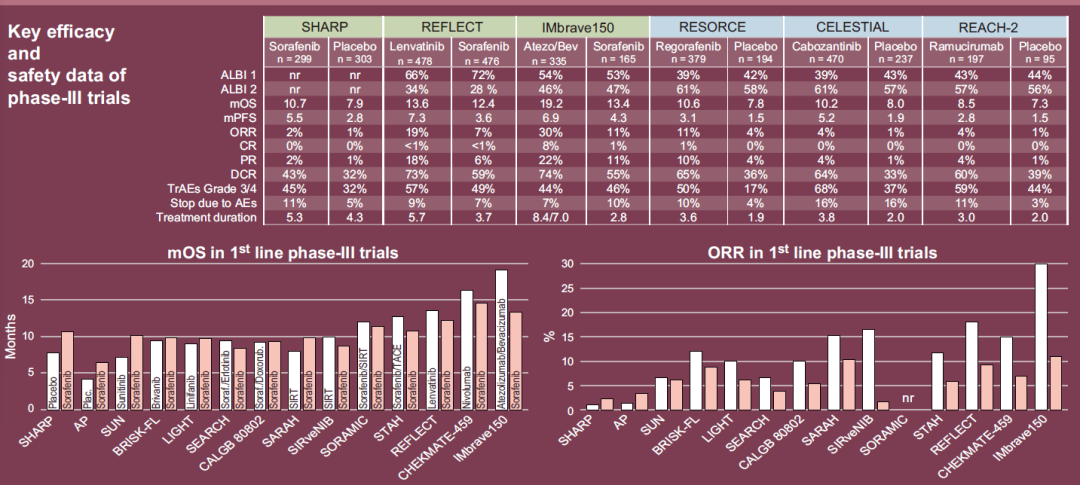
图5. 肝癌靶向药物及III期试验主要数据
肿瘤细胞通过多种机制对MKIs产生耐药性
常利用这些途径的高度冗余性,通过在替代受体(如IGFR-1或EGFR)或其配体(如FGF和HGF)中获得肿瘤耐药性。
肿瘤细胞还激活其他具有类似功能的途径,例如TGF-β(促增殖功能)和STAT3(抗凋亡)。
缺氧环境导致肿瘤细胞耐药的机制,主要是由于缺氧促进了肿瘤细胞中的EMT的表达并促进VEGF的产生,进而导致免疫抑制性细胞亚群(如髓源性抑制细胞(MDSC)和调节性T细胞(Treg))被招募到肿瘤微环境中,,进而抑制T细胞反应。
TGF-β促进VEGF的产生
肝癌的免疫治疗机制及进展
近年来,肝癌的治疗已经发生了迅速的变化,不止局限靶向药物治疗,免疫治疗进展也在改写肝癌的治疗格局。
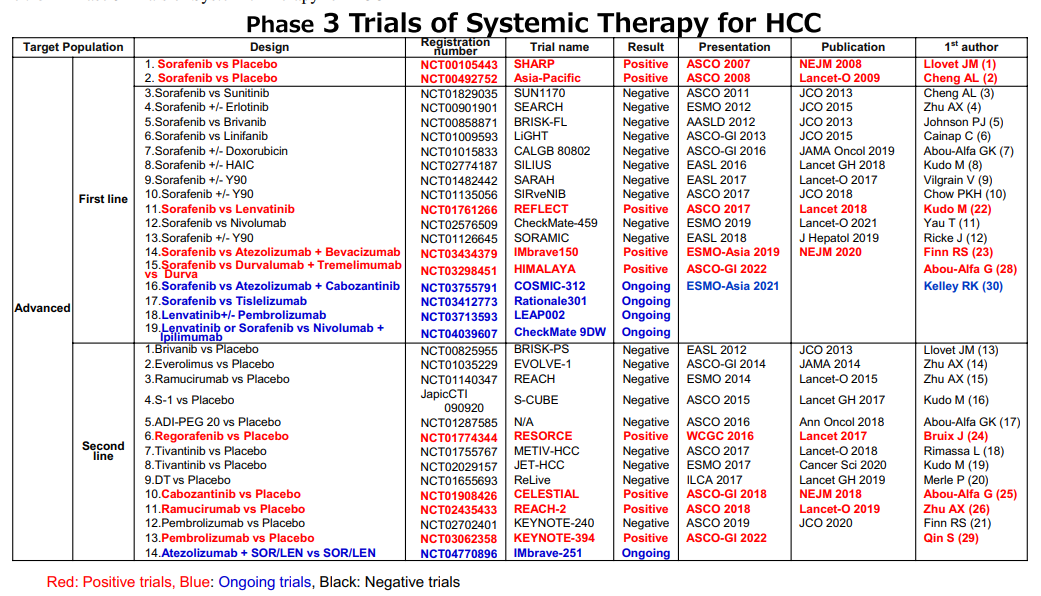
图6. III期HCC系统治疗研究
例如,阿替利珠单抗联合贝伐珠单抗已成为晚期肝癌一线治疗的新选择,并被2022 NCCN v1版指南和原发性肝癌治疗指南(2022年版)作为系统治疗药物优先推荐。

图7. 2022 NCCN V1 肝胆管癌指南肝癌系统治疗推荐
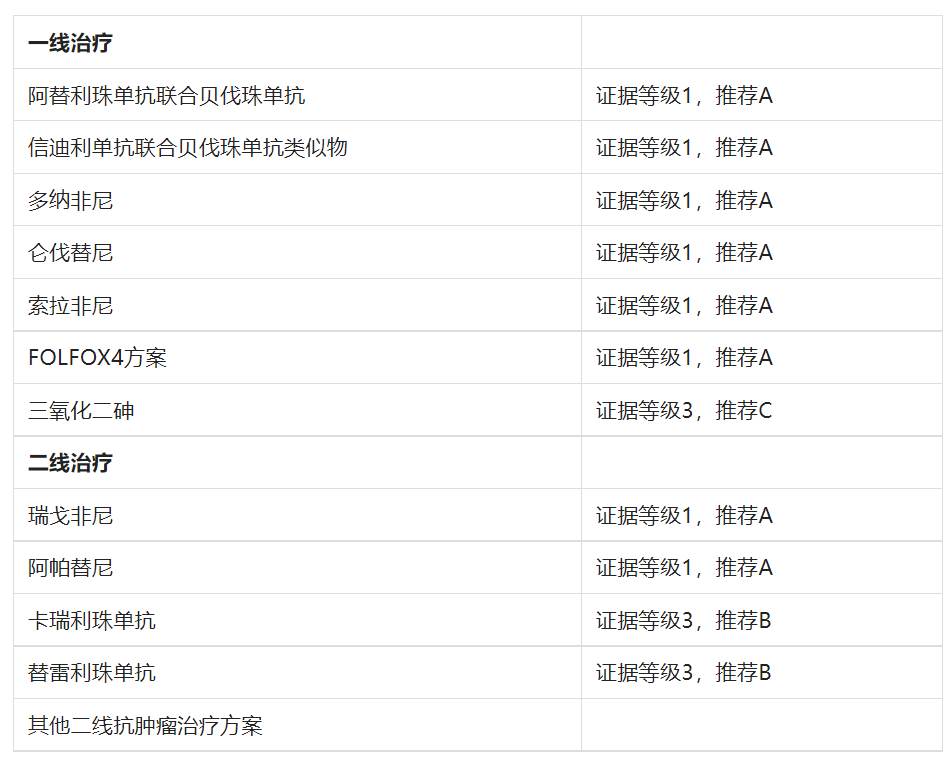
图8. 原发性肝癌治疗指南(2022年版)药物推荐
IMbrave150研究证明了VEGFA抗体-贝伐单抗与PD-L1抗体-阿替利珠单抗联合应用的有效性。与索拉非尼相比,这是第一种显示出显著总体生存效益的治疗方法,现在是晚期肝癌标准的一线治疗方案。也标志着HCC向免疫治疗(IO)的过度。
目前,另一项取得阳性结果的晚期肝癌一线治疗的方案为tremelimumab(抗CTLA-4单抗)加上度伐利尤单抗(抗PD-L1单抗)。具体作用机制整理如下:
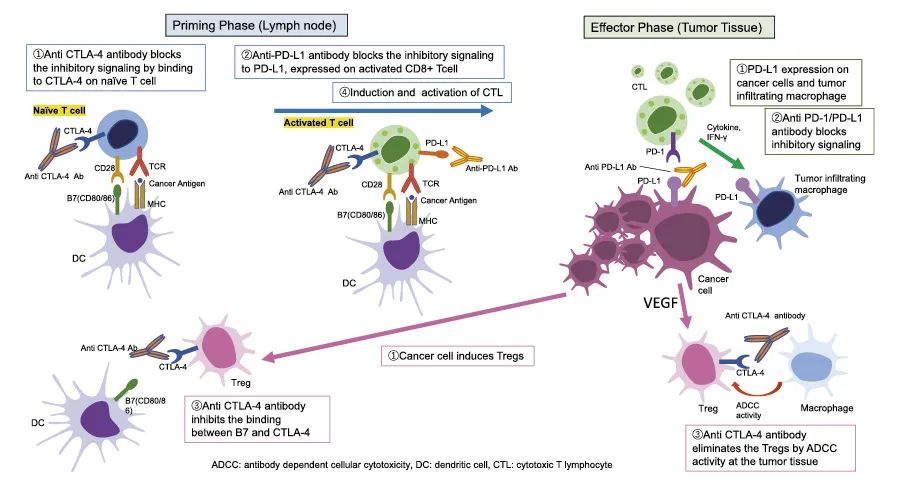
图9. 通过阻断CTLA-4和PD-1/PD-L1通路恢复肿瘤免疫
在启动阶段,Tregs通过消耗由CD4+T细胞产生的白细胞介素-2来抑制幼稚CD8+T细胞的激活。效应Tregs通过CTLA-4/B7途径抑制抗原呈递细胞的成熟。此外,幼稚的CD8+T细胞通过在表面表达CTLA-4而失活,CTLA-4与抗原呈递细胞上的B7结合,从而抑制CD8+T细胞的激活。
抗CTLA-4抗体通过结合幼稚T细胞上的CTLA-4阻断抑制信号(①).抗PD-L1抗体阻断激活的CD8+T细胞表达的PD-L1抑制信号(②).抗CTLA-4抑制Treg上B7和CTLA-4之间的结合(③). 最后,CD8+T细胞被诱导和激活成为CTL(④).在效应期,PD-L1在癌细胞和肿瘤浸润巨噬细胞上表达(①).抗PD-1/PD-L1抗体阻断抑制性信号传导(②).抗CTLA-4抗体通过ADCC消除肿瘤组织中的Tregs(③).这些阻断CTLA-4和PD-1/PDL1通路的作用恢复了CTL在肿瘤免疫微环境中的抗肿瘤活性。
FDA根据CheckMate-040的I/II期疗效数据,批准了二线的纳武利尤单抗±伊匹木单抗的上市。可以看到,PD-(L)1抗体联合CTLA-4抗体的双免联合方案,已经在晚期肝癌领域获得二线和一线适应症的覆盖。
中国肝癌患者的免疫治疗获益机制探讨
汇总CheckMate-459、KEYNOTE-240和IMbrave150三项肝癌临床试验数据分析:非病毒性肝炎所导致的肝癌,获益并不明显。
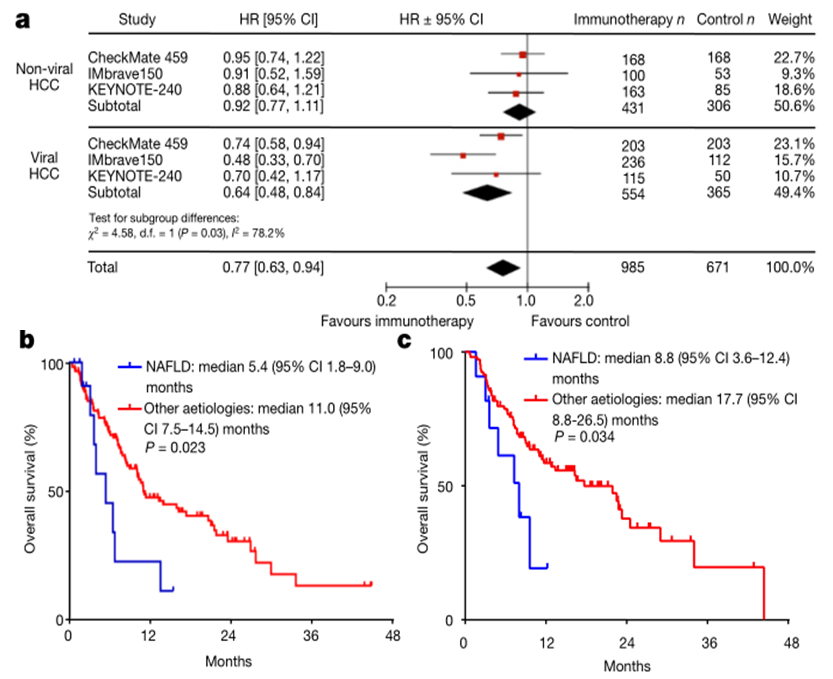
图10. 不同病因的晚期肝癌免疫治疗效果不同
HBV感染导致的HCC更能免疫获益,可能源于抑制性受体在病毒性肝炎中的过度表达。
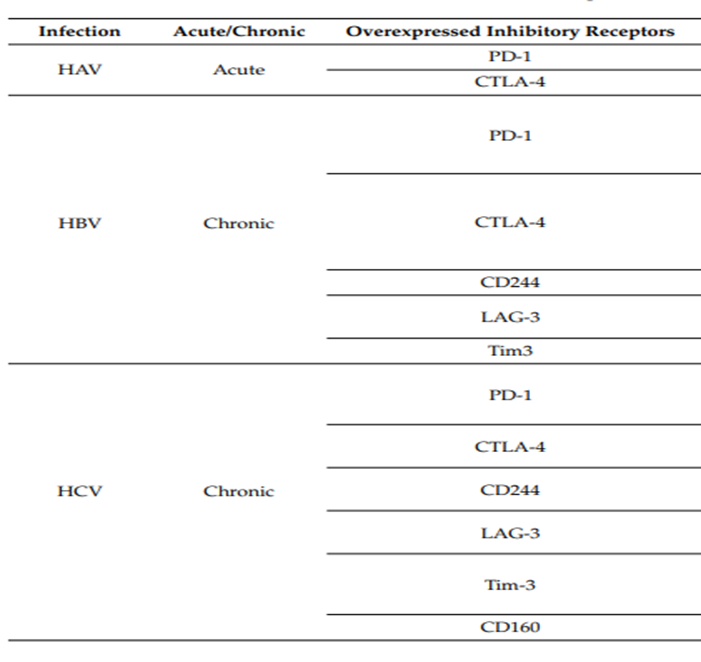
图11. 抑制性受体在病毒性肝炎中的过度表达
肝癌这种异质性非常强的癌种,迎来多靶点,多种类型组合疗法的治疗时代,而双抗作为双靶点的抗体药物,在保证安全性问题之前,如何有效联合抗血管生成药物进行探索,联合抗体还是多靶点TKI,从康方生物和康宁杰瑞两家双抗领军者的选择上都是选择了仑伐替尼。
2022 ASCO KN046+仑伐替尼


KN046(PD-L1/CTLA-4双抗)+仑伐替尼的晚期HCC一线,55例入组患者,ORR(RECIST v1.1)达到了惊人的51.9%,初步来看,疗效方面是没问题的。但是,对于致死性病例的解释上,出现了一些争议。
2021 ASCO AK104+仑伐替尼

AK104(PD-1/CTLA-4双抗)+仑伐替尼的晚期HCC一线,18例可评估的患者,ORR(RECIST v1.1)为44.4%,也处于靶免联合方案在晚期HCC一线的第一梯队。安全性方面,3级TRAE发生率为26.7%,未发生4级TRAE和致死性TRAE的发生。疗效和安全性令人期待在更大样本量上的表现。
参考文献
1.Journal of Hepatology 2022 vol. 76 | 208-210.
2.Liver Cancer 2022;11:192–208.
3.Kudo M. Liver Cancer. 2022. PMID: 35634425.
4.Kelley RK, et al. J Clin Oncol. 2021. PMID: 34292792.
5.Pfister D, Núñez N G, Pinyol R, et al. Nature, 2021.
6.Cell Mol Immunol,2016,13(3):267-276.
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)