肝癌,以肝细胞癌(HCC)为主,是全球第二大癌症相关死因,发病率呈逐年上升趋势。50%的HCC需要接受系统治疗,传统一线治疗为索拉非尼,仑伐替尼,多纳非尼(中国),二线治疗包括瑞戈非尼、卡博替尼和雷莫芦单抗。
近5年,免疫治疗的出现彻底改变了HCC治疗格局。相比索拉非尼,“阿替利珠单抗+贝伐珠单抗”显著改善总生存,成为新的benchmark;同时,“度伐利尤单抗+曲美木单抗”也达到OS终点,是潜在的治疗新手段;进一步讲,帕博利珠单抗(单药)和“纳武利尤单抗+伊匹木单抗”也通过加速审批分别取得经索拉非尼进展HCC二线适应症。
今年ASCO 4098 这项网状Meta比较,相比安慰剂、索拉非尼、仑伐替尼、“阿替利珠单抗+卡博替尼“、纳武利尤单抗,“阿替利珠单抗+贝伐珠单抗“(AB)带来的获益。
共纳入9项III期进行分析,相比安慰剂、索拉非尼、仑伐替尼、“阿替利珠单抗+卡博替尼“、纳武利尤单抗,AB分别降低60%、42%、37%、36%和32%的死亡风险。
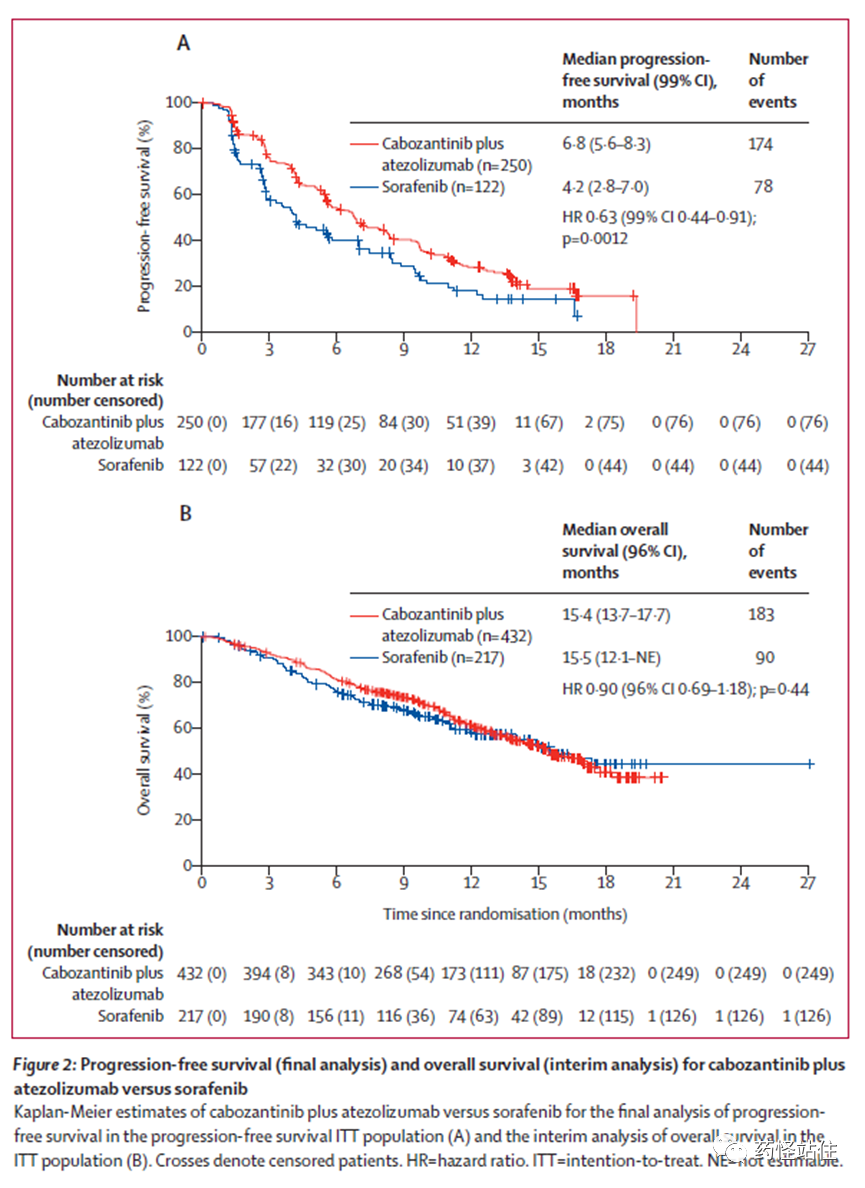
相比“度伐利尤单抗+曲美木单抗“,AB仅有数值上优势;相比”信迪利单抗+贝伐珠单抗生物类似物“,AB获益与之相似。这里还有个比较有意思的插曲,同是“免疫+抗血管”的治疗策略,甚至免疫药都是阿替利珠单抗,区别仅在于联用的抗血管药物,结果却天壤之别,这告诫我们永远不要小看“配菜”。Imbrave-150中使用的是贝伐珠单抗,一战封神,相比索拉非尼,带来绝对OS获益;相反,联合了卡博替尼的COSMIC-312仅带来PFS获益,相比索拉非尼,“阿替利珠单抗+卡博替尼”降低37%疾病进展或死亡风险,mPFS分别为6.8个月(vs 4.2个月),mOS分别为15.4个月(vs 15.5 个月),联合组严重TRAE发生率更高(18% vs 8%),TRAE相关死亡发生率更高(1% vs <1%),联合组的PFS获益主要源自亚洲人群、HBV病因学HCC,进一步讲,联合组仅在HBV病因学HCC亚组中展现OS获益趋势。类似地还有可乐组合和双艾组合, 目前可乐晚期肝癌一线III期结果还未公布,双艾释放了阳性消息,我们是否可以间接推测恒瑞这个研究纳入的人群主要大部分还是HBV病因学HCC,也就是中国人群,但尚未披露具体数据,一起共同期待后续结果。
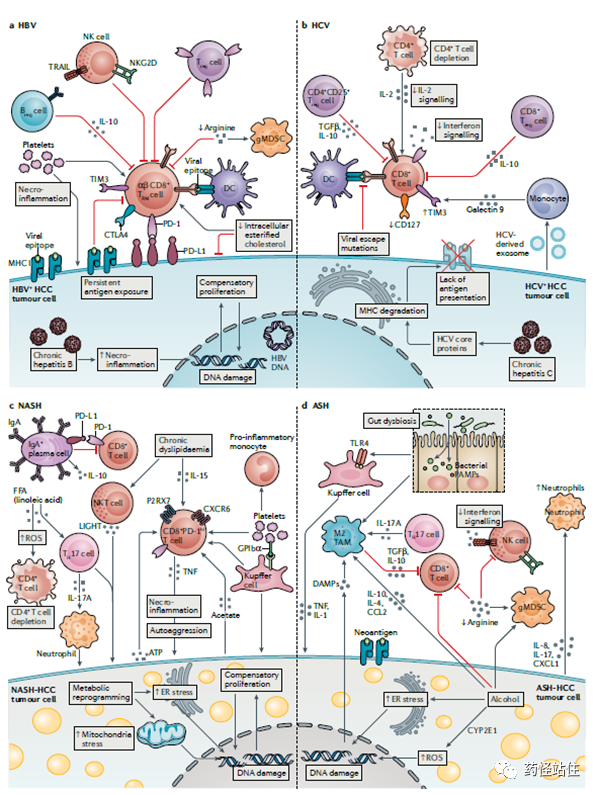
下图为病因学分别为病毒型(HBV和HCV)与非病毒学(NASH和ASH)相关肝癌,这两类肝癌具有不同的免疫微环境,激活特异的通路,未来或需根据病因学进行分类、区隔,采取对应治疗模式。多个研究共同提示,“阿替利珠单抗+贝伐珠单抗“更适合病毒学病因学的肝癌,也就是说,”A+T“可能更利于我们国家乙肝病毒病因学下的HCC(>95%);相反,索拉非尼/仑伐替尼似乎能为欧美多见的非病毒学背景HCC带来更多获益。
今年ASCO poster 4069 再次佐证上述观点,这是一项回顾性队列分析,纳入来自4个国家、36家中心的东西方、不适合接受局部治疗的中晚期HCC,一线治疗使用“阿替利珠单抗+贝伐珠单抗”(AB)、索拉非尼(S)、仑伐替尼(L),主要终点为OS(AB vs L),次要终点为OS(AB vs S)。
L组、AB组和S组分别纳入569例、190例和210例受试者。全人群中,L组和AB组中位OS分别为17.8个月和12.1个月,相比AB,L降低29%死亡风险,调整受试者基线后,L可带来更多OS获益,降低35%死亡风险。NASH/NAFLD病因学HCC中,L组和AB组分别有254例和82例受试者,中位OS分别为21.2个月和12.2个月,相比AB,L降低54%死亡风险,调整受试者基线后,L获益不变,依旧降低54%死亡风险。
非病毒学/NASH/NAFLD病因学HCC中,AB和L具有相似的中位OS值。所有结果经PSM分析确认,PSM,倾向性匹配评分,一种消除已知偏倚的方法。
无论是总人群,还是NASH/NAFLD或非病毒/非NASH/NAFLD病因学的HCC,AB组与S都具有相似的中位OS值,没有统计学差异。
这项回顾性队列分析,提示非病毒学病因学HCC可能从仑伐替尼中获益更多,同属于小分子多靶点的TKI,索拉非尼和仑伐替尼获益也可能不同(通过间接参照物AB比较)。
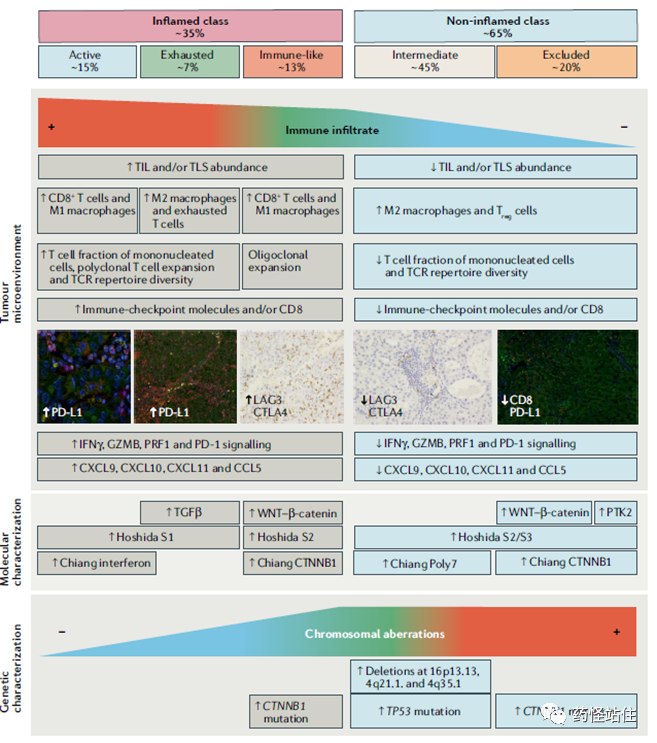
尽管取得了这些重大进展,但现阶段,我们仍不清楚调节免疫反应/逃逸的分子机制。免疫微环境在肝细胞癌的发生和发展中发挥重要作用,通过定义不同病因依赖性免疫特征,发现炎症/非炎症HCC和基因组特征与免疫检查点抑制剂的反应相关,目前尚无有效的生物标志物可用于指导肝癌治疗临床决策。最后,借用Nature Review内容,未来设计免疫治疗HCC研究,我们应该注意些什么?
OS仍是晚期HCC最重要的主要终点。然而随着后续治疗的增多,这可能降低组间OS差异,在一些III期研究中,可使用PFS作为OS的替代终点,PFS获益HR≤0.6与OS获益强相关;HR获益处于0.6-0.7,与OS获益相关性不明;HR≥0.7,不太可能取得OS获益结果。进一步讲,一项系统性综述显示,免疫药治疗晚期实体瘤中,6个月PFS率与OS相关,因此6个月PFS率将来也可能被推荐作为终点。
Recist
1.1标准在评估免疫治疗引起的超进展、假性进展中存在不足。免疫治疗下,HCC假性进展发生率近2.5%,超进展发生率近12.7%。为了更好的评估,目前提出了Ir-Recist标准,然尚缺乏充足、前瞻性研究探索其合理性及科学性。
血清AFP水平、血管内/肝外侵犯、ECOG评分、地域被推荐作为HCC研究分层因素;免疫治疗研究发现,病毒和非病毒相关HCC疗效存在差异,因此推荐其或可成为未来免疫药研究的分层因素。
免疫治疗可带来延迟效果,延长疾病控制时间,部分患者可以实现“长生存”,这对依靠等比例风险模型建立下的传统统计学假设提出了新的挑战,未来或可采取其它统计分析模式,如界标生存分析、非等比例风险模型等。
肿瘤临床试验中常使用CTCAE量表用于评估不良反应,但CTCAE产生于化疗年代,化疗药毒性一般有一个可定义和可预测的时间,所以对于免疫治疗引起的长期毒性,即便程度是轻度,由于持续性或可极大影响患者生活质量并导致治疗中断。在这种情况下,PRO可能为TRAE的评估带来更多信息。 版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。






发表评论
注册或登后即可发表评论
登录注册
全部评论(0)