2022-09-21 来源 : e药安全 ,作者lin冷无冰
系列研究概要
非小细胞肺癌
拉开研究序幕
1. KEYNOTE-001:初步确立了K药的使用方法和剂量,奠定了PD-L1的检测方法和cut-off值,同时也探索了PD-L1表达对免疫治疗的预测价值。
单药探索
2. KEYNOTE-010:PD-L1≧1%,K药对比多西他赛,二线,生存获益。
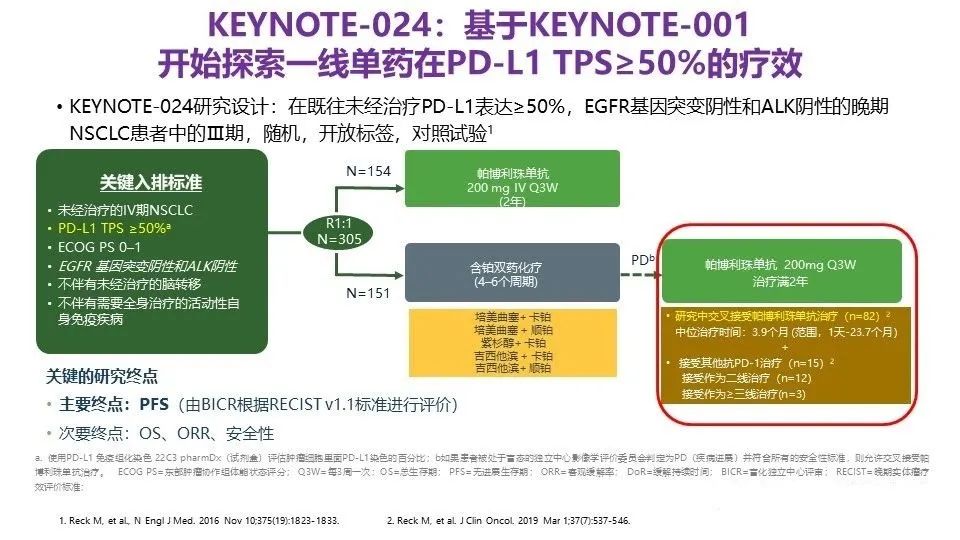
3. KEYNOTE-024:PD-L1≧50%,K药对比化疗,一线,生存获益。
4. KEYNOTE-042:PD-L1≧1%,K药对比化疗,一线,生存获益。
联合化疗探索
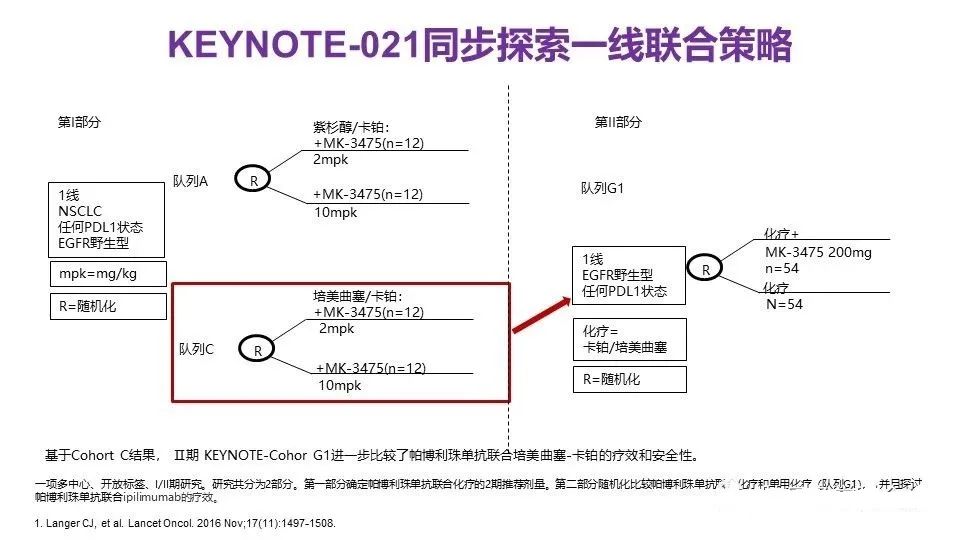
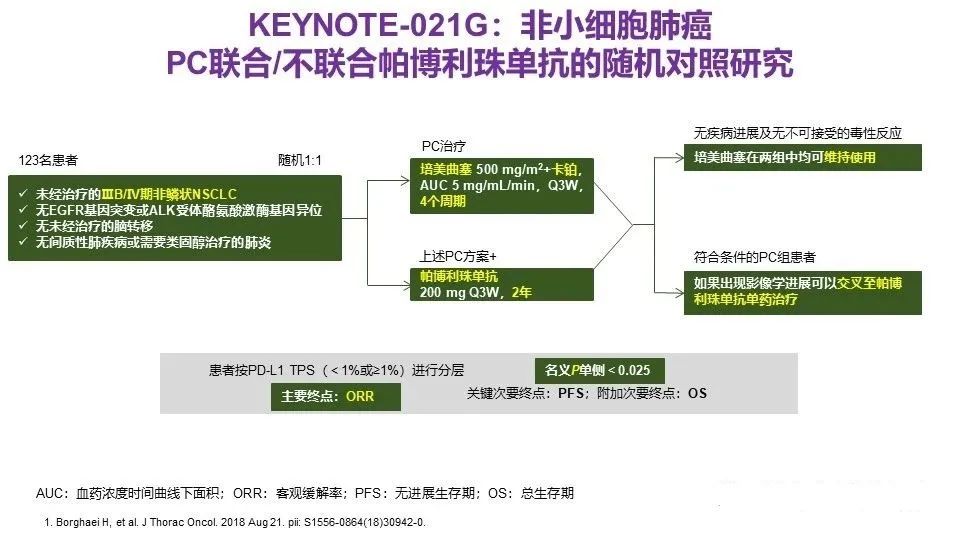
5. KEYNOTE-021:I-II期,K药+化疗 VS 化疗,一线,生存获益。
6. KEYNOTE-189(非鳞):III期,K药+化疗 VS 化疗,一线,生存获益。
7. KEYNOTE-407(鳞):III期,K药+化疗 VS 化疗,一线,生存获益。
联合免疫探索
8. KEYNOTE-598:K药+Y药 vs K药,一线,双免没有任何获益。
术后辅助治疗
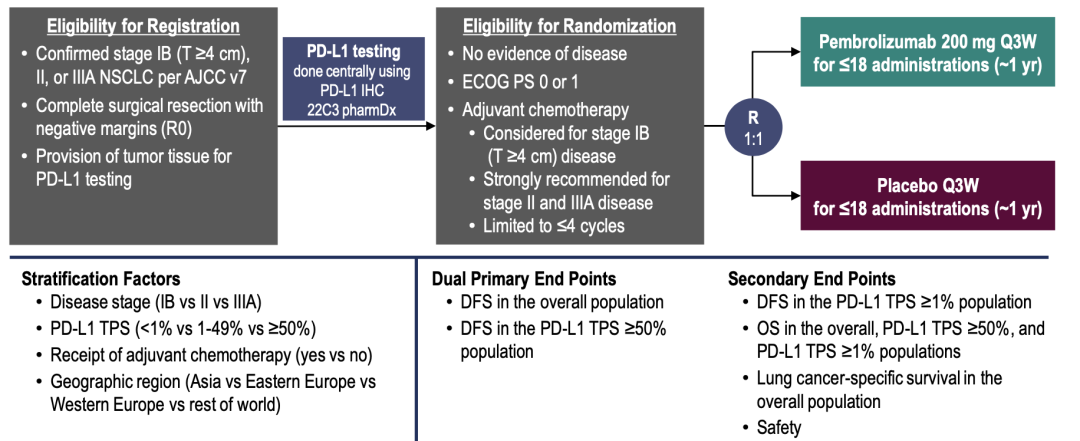
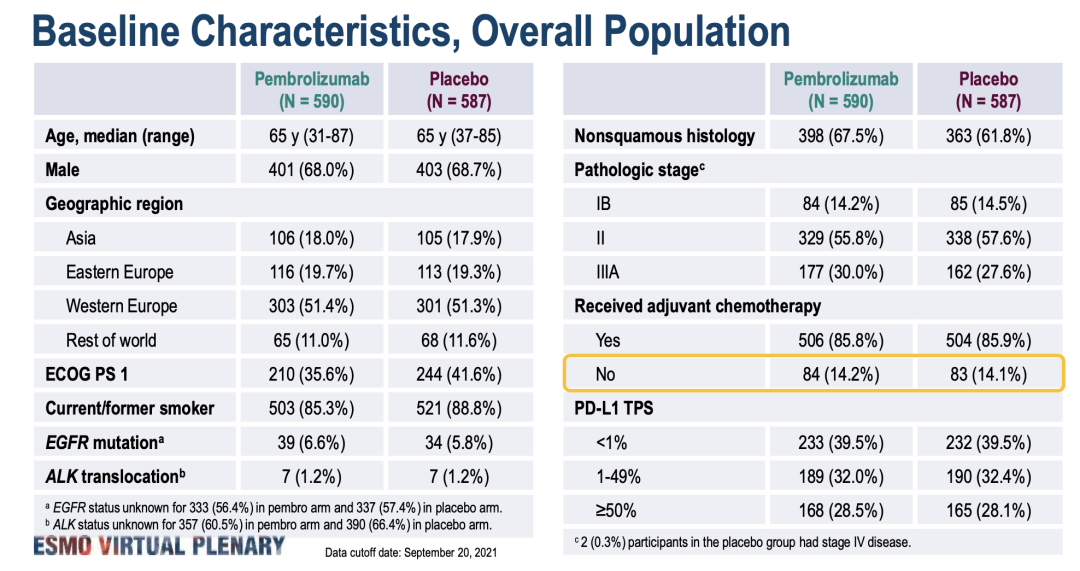
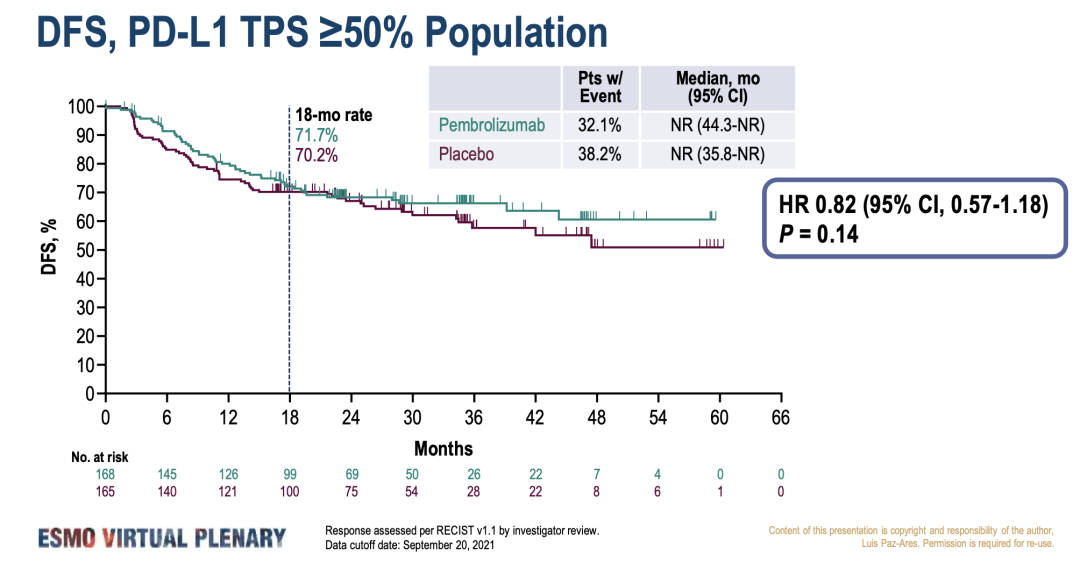
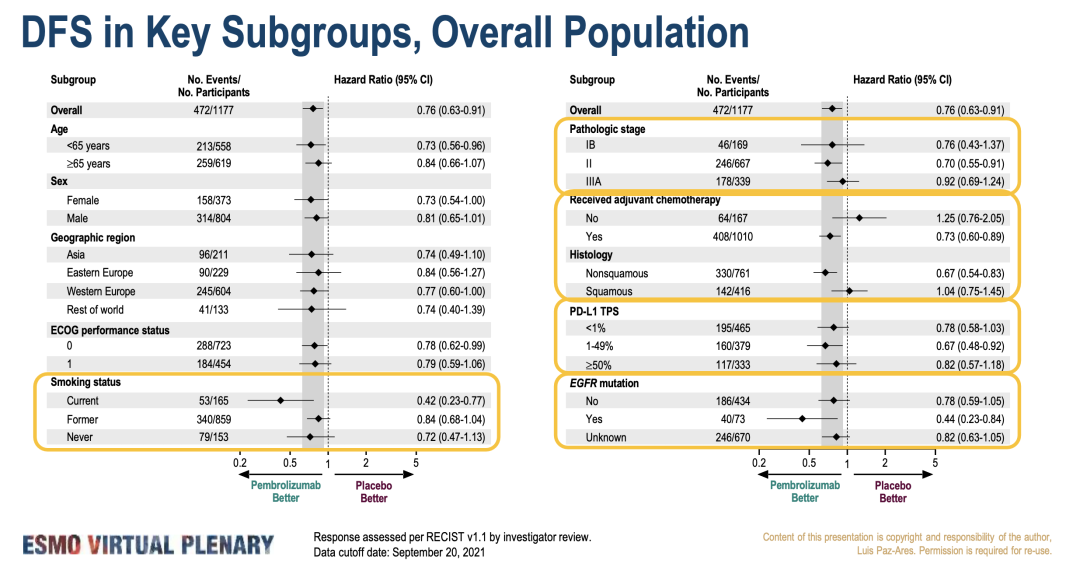
9. PEARLS/KEYNOTE-091研究:III期,帕博利珠单抗 vs 安慰剂,DFS为53.6 vs 42.0 个月,PDL1高表达无统计差异
III期不可切除
10. KEYNOTE-799:K药+同步放化疗,ORR约70%。
小细胞肺癌(已退市)
一线
11. KEYNOTE-604:OS失利,错失一线
三线
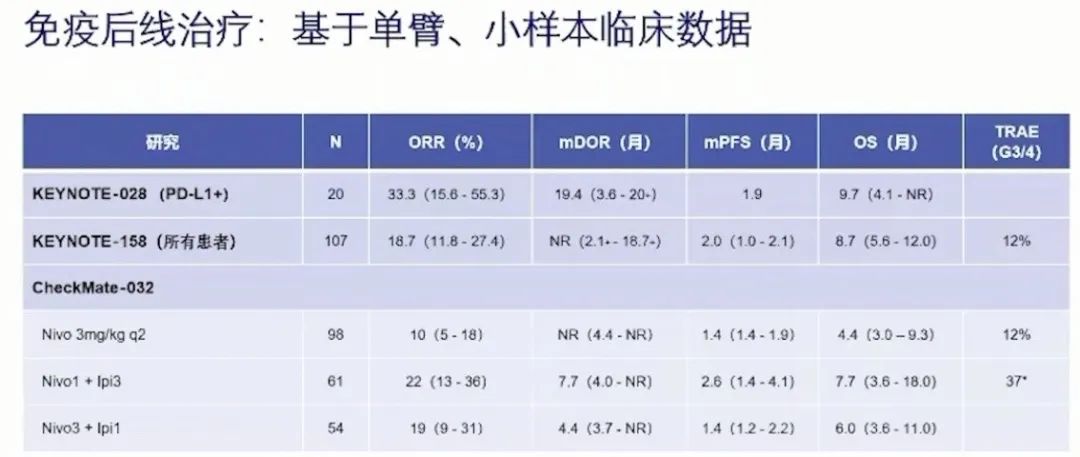
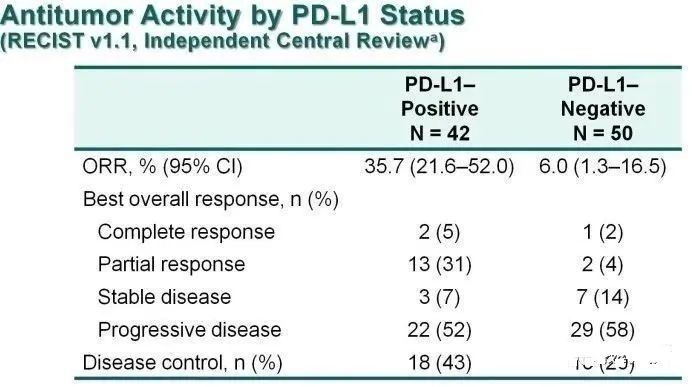
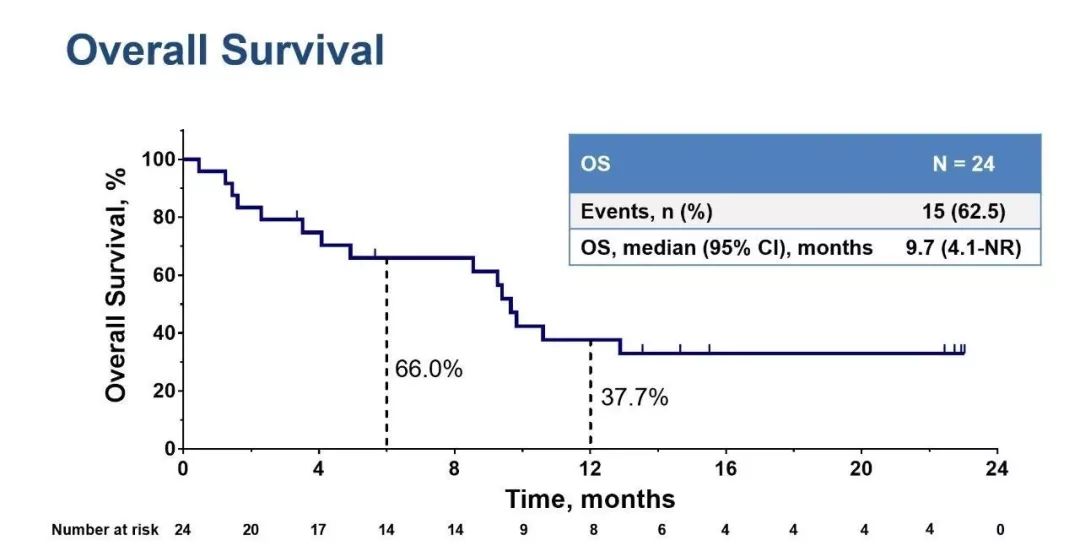
12. KEYNOTE-158、KEYNOTE-028:小样本,证据有限
不限瘤种
13. 基于生物标记物(MSI-H/dMMR、TMB-H)的第一个“广谱抗癌药”
拉开序幕
<< 滑动查看下一张图片 >>
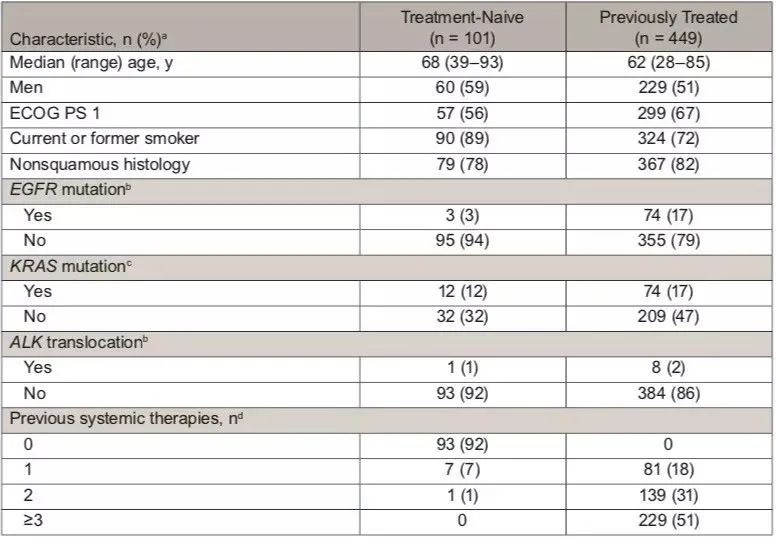

NSCLC队列患者基线特征,根据irRC研究者评估的患者疗效,5年生存率
安全性:帕博利珠单抗的安全性数据与以往已发布的晚期非小细胞肺癌研究相一致。接受帕博利珠单抗治疗的患者中所有级别的治疗相关不良事件(TRAEs)发生率为71%(n=388),3 - 5级TRAEs的发生率为13%(n=69)。17%(n=92)的患者报告了免疫相关不良事件,其中最常见的是甲状腺功能减退症,其次是肺炎、甲亢和皮肤毒性。
单药探索
前期研究提示不同剂量的患者疗效无差异,因此,在随访31个月时,更新的数据对两者进行了合并。帕博利珠单抗组患者接受超过6个月治疗且出现CR后,可停止帕博利珠单抗的治疗。这部分患者和接受全疗程帕博利珠单抗治疗(2年或35周期)的患者,在疾病确认进展且未接受其他抗肿瘤治疗的患者,可以再次接受17周期(1年)的帕博利珠单抗治疗。2020年,《J Clin Oncol》杂志公布了其中位随访42.6个月的结果,并公布了完成2年/35疗程帕博利珠单抗治疗后,再次使用该药患者的数据。2020WCLC公布最新随访数据,截至2020年4月8日,从随机分组到数据截止的中位时间为67.4个月(60.0-77.9)。

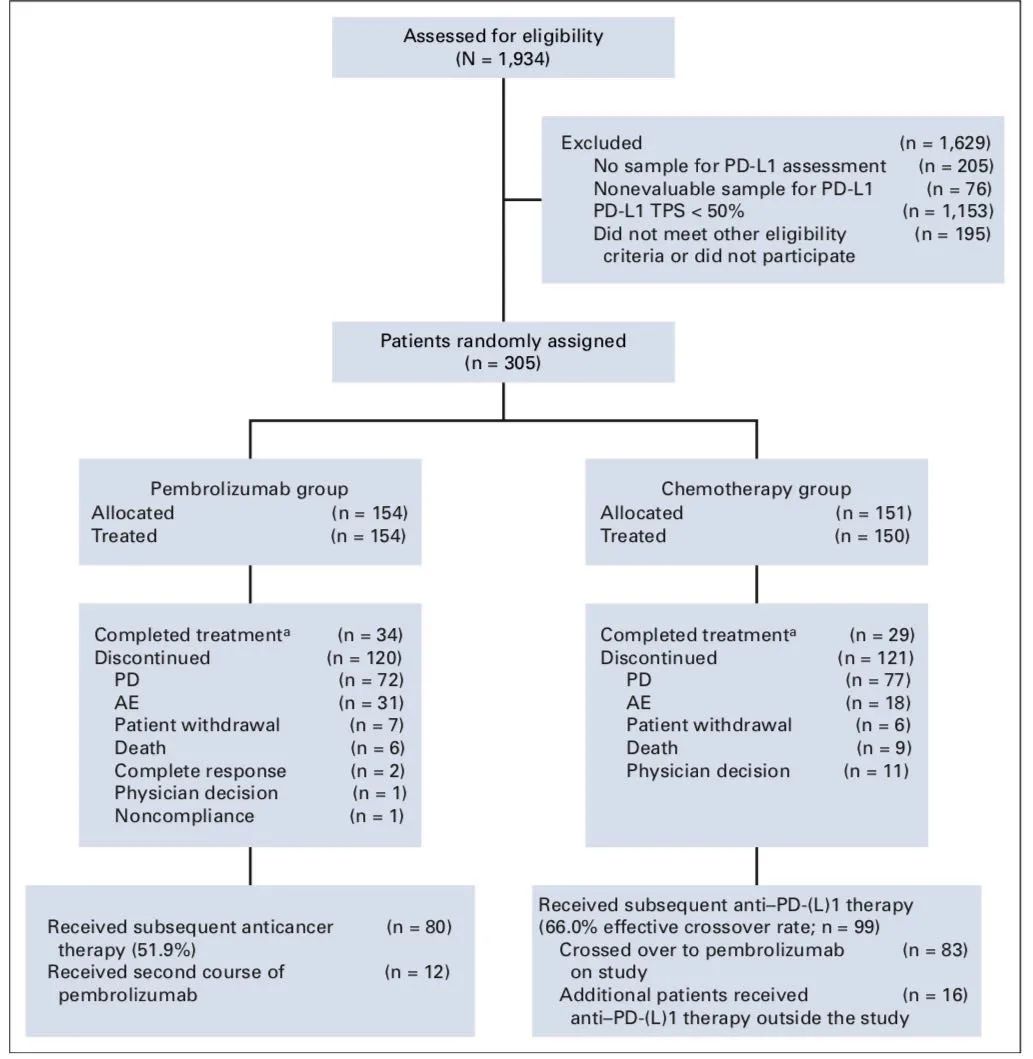
患者入组流程



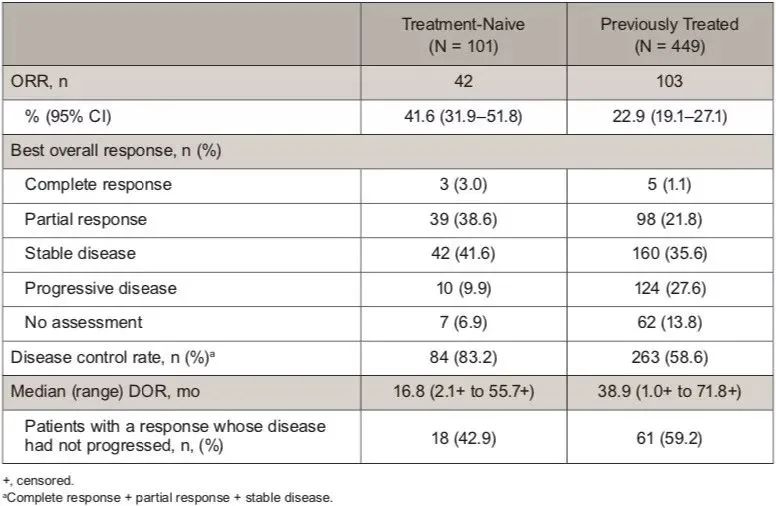
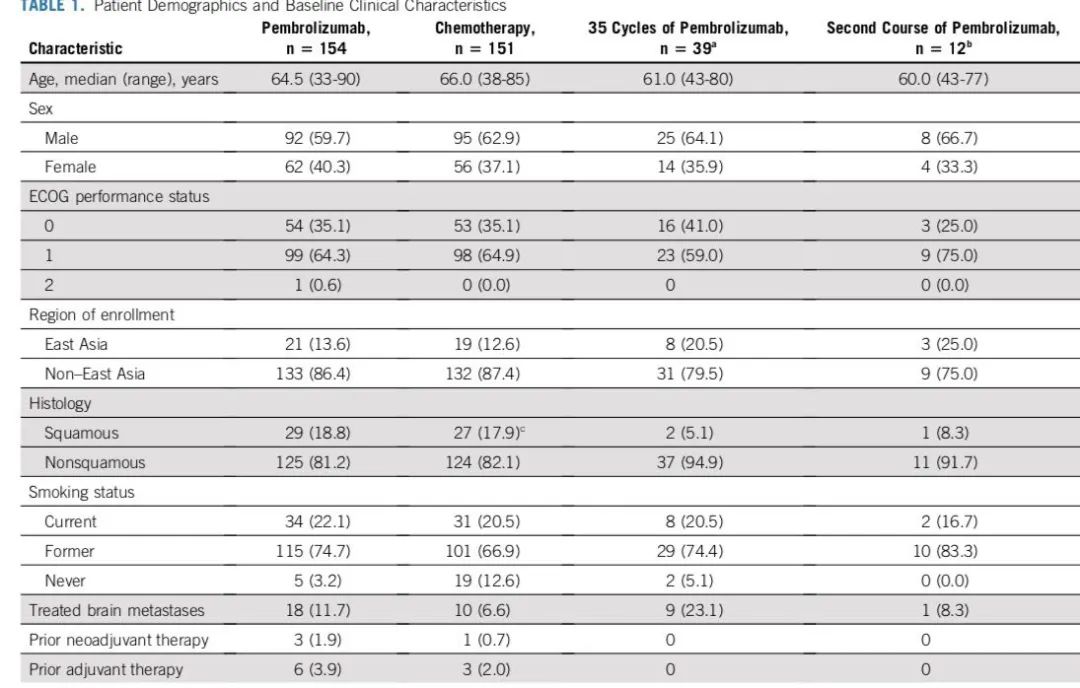
疗效数据总结
↑ 患者基线特征
← 研究设计
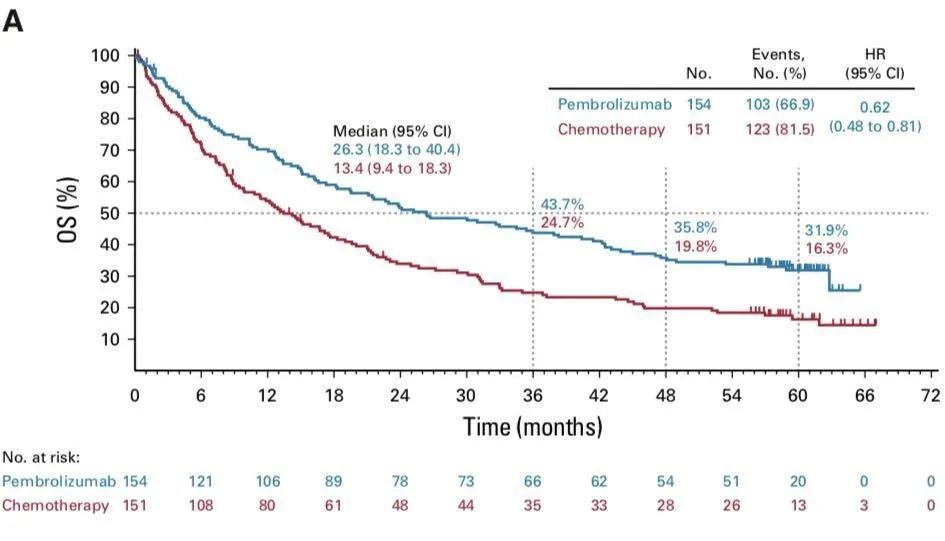
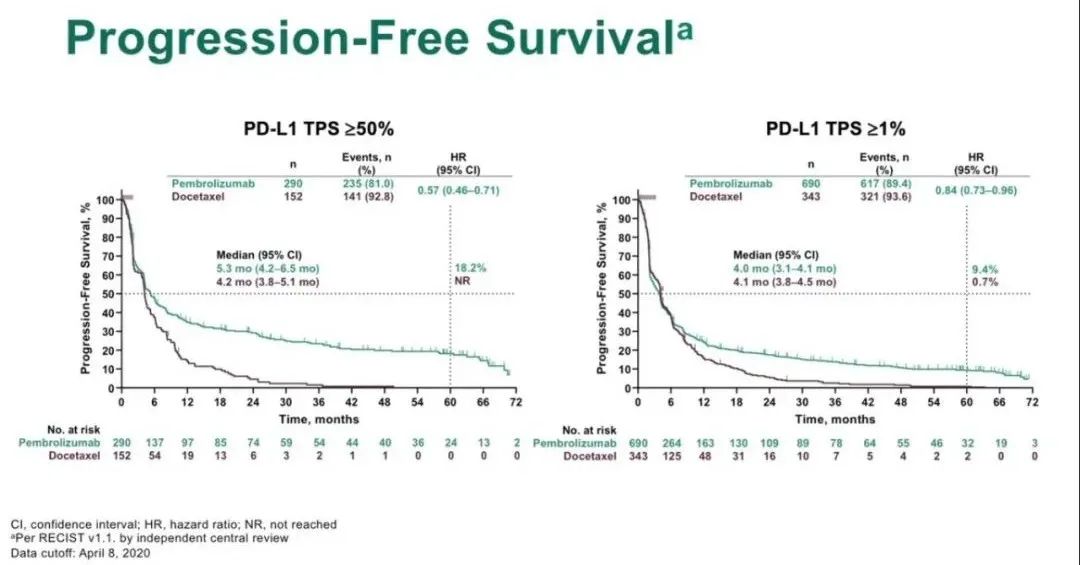
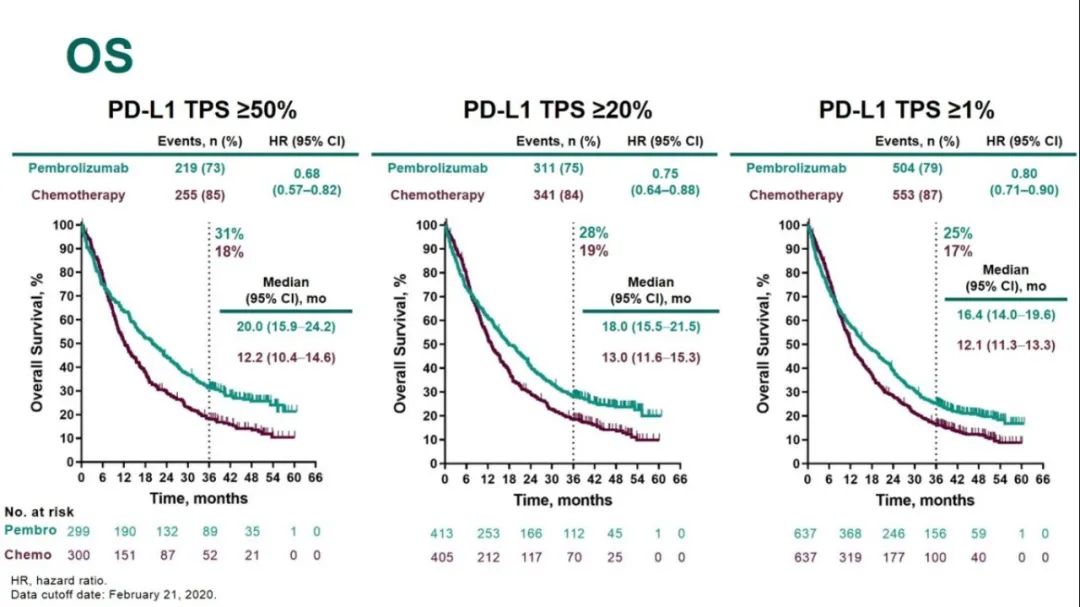
OS

PFS

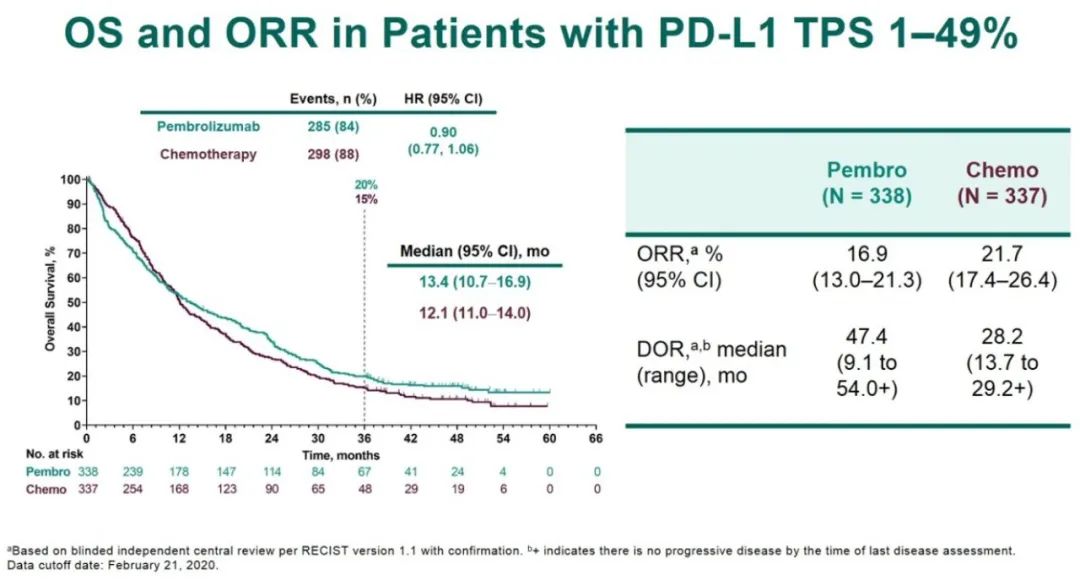

完成35周期患者的疗效
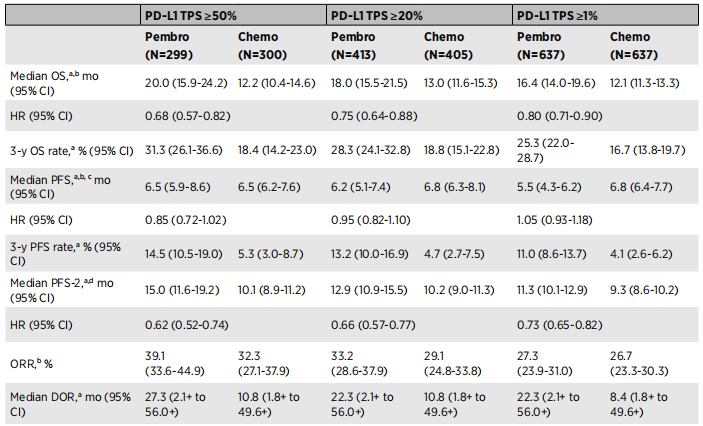
KN042疗效数据汇总
联合治疗探索

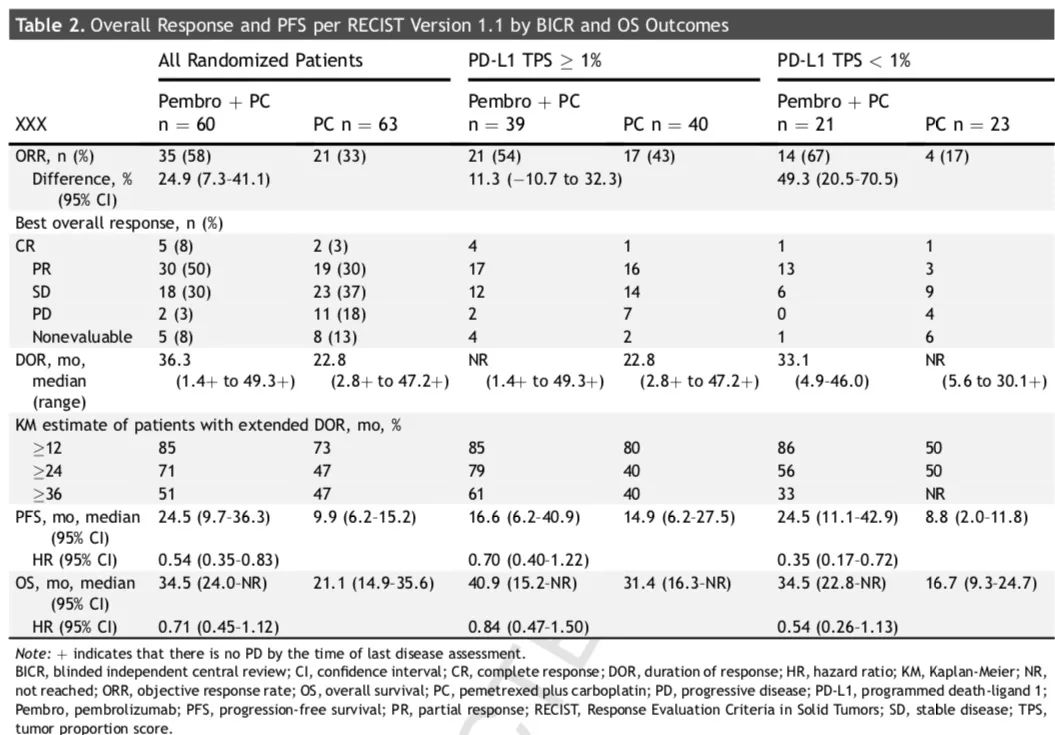
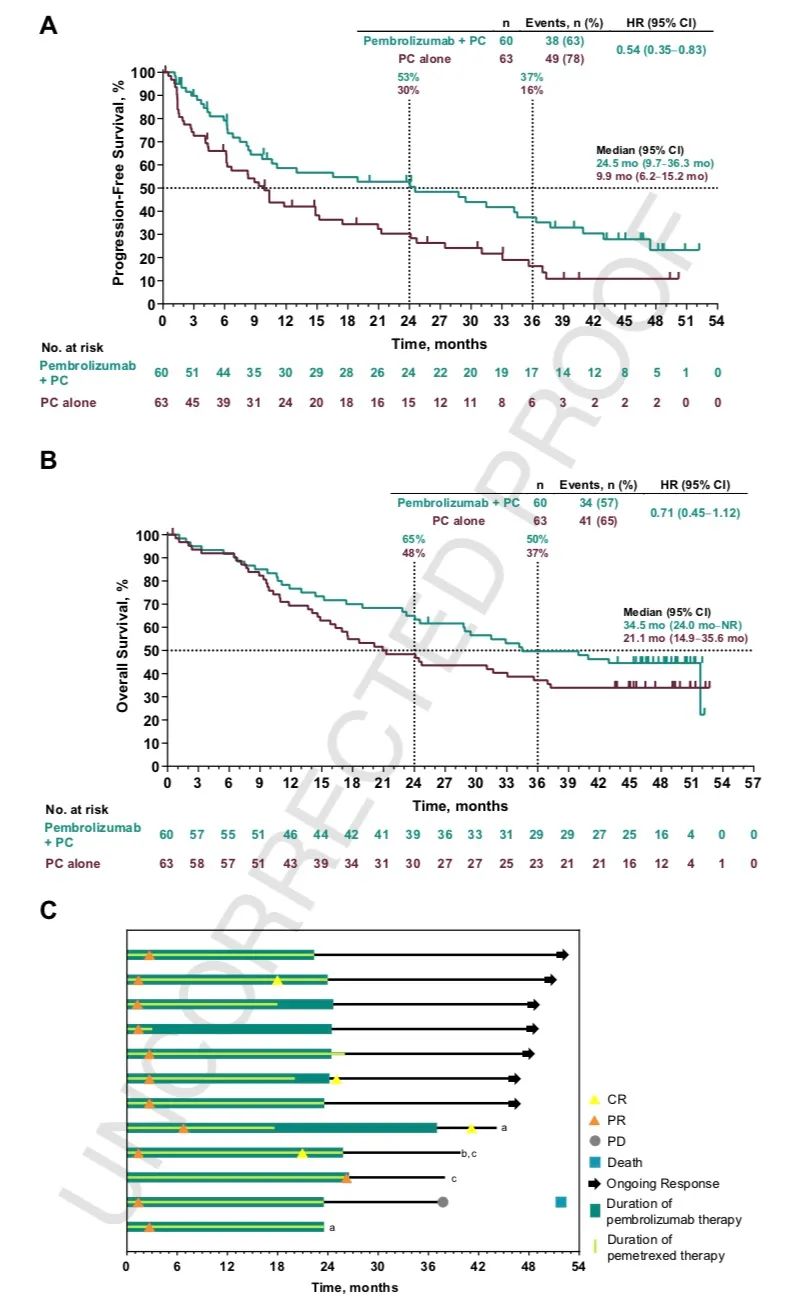

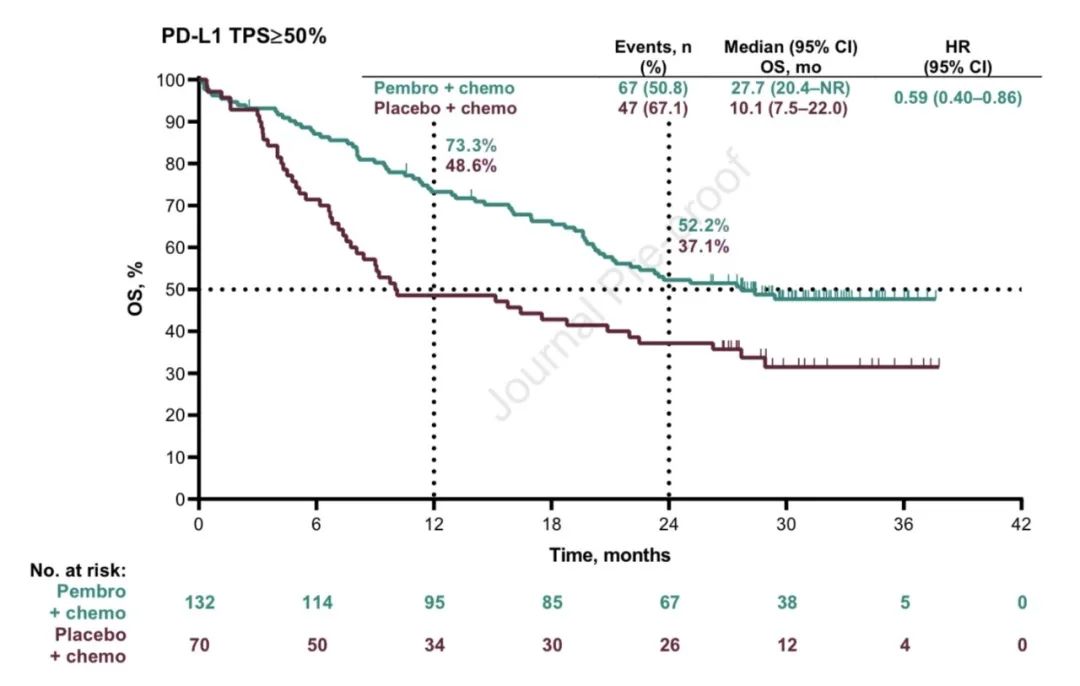
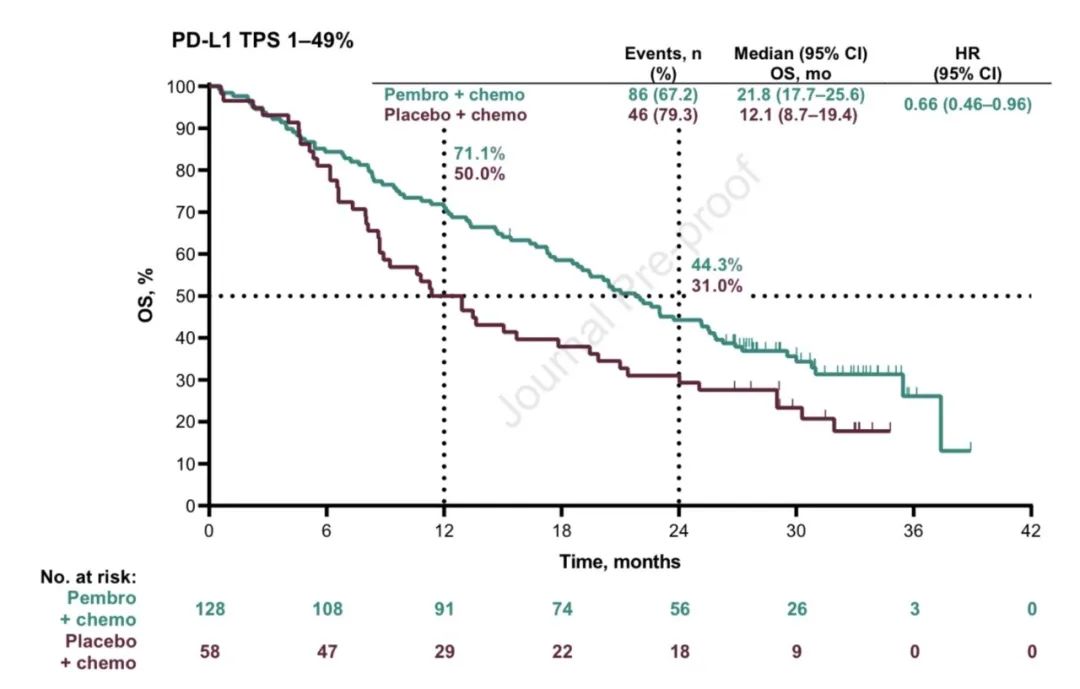
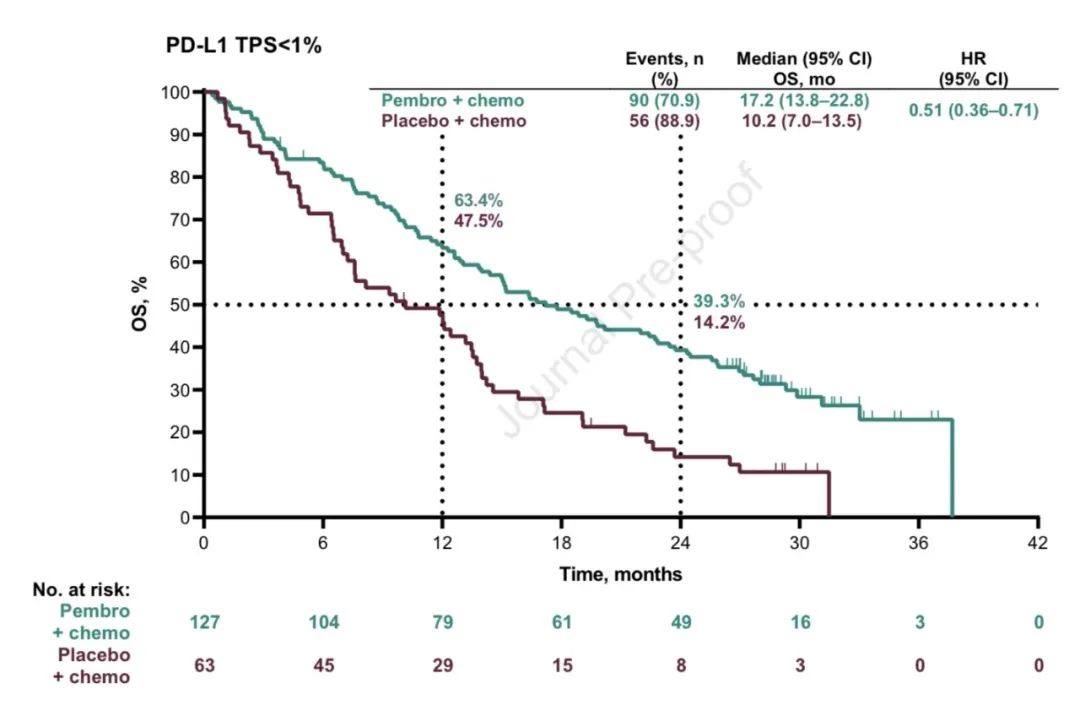
2)PFS,中位PFS分别为:9.0个月 vs 4.9个月(HR,0.49;95% CI,0.41-0.59)。亚组分析中,不论PD-L1表达及其他情况,帕博利珠单抗联合化疗均获更优的OS和PFS(详见附图)。


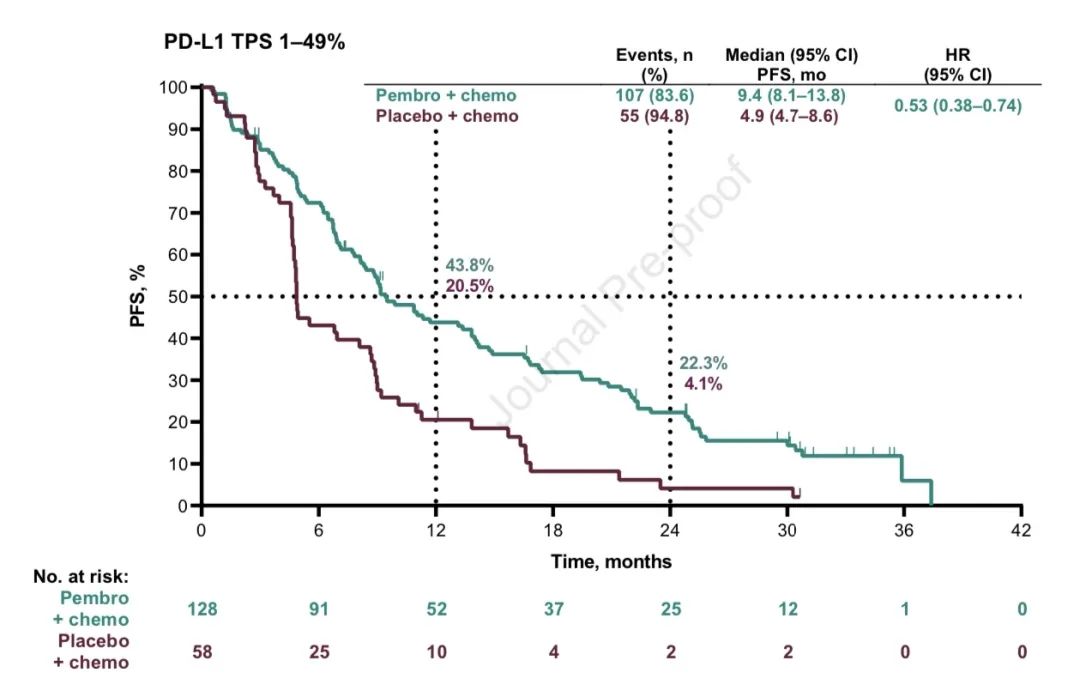
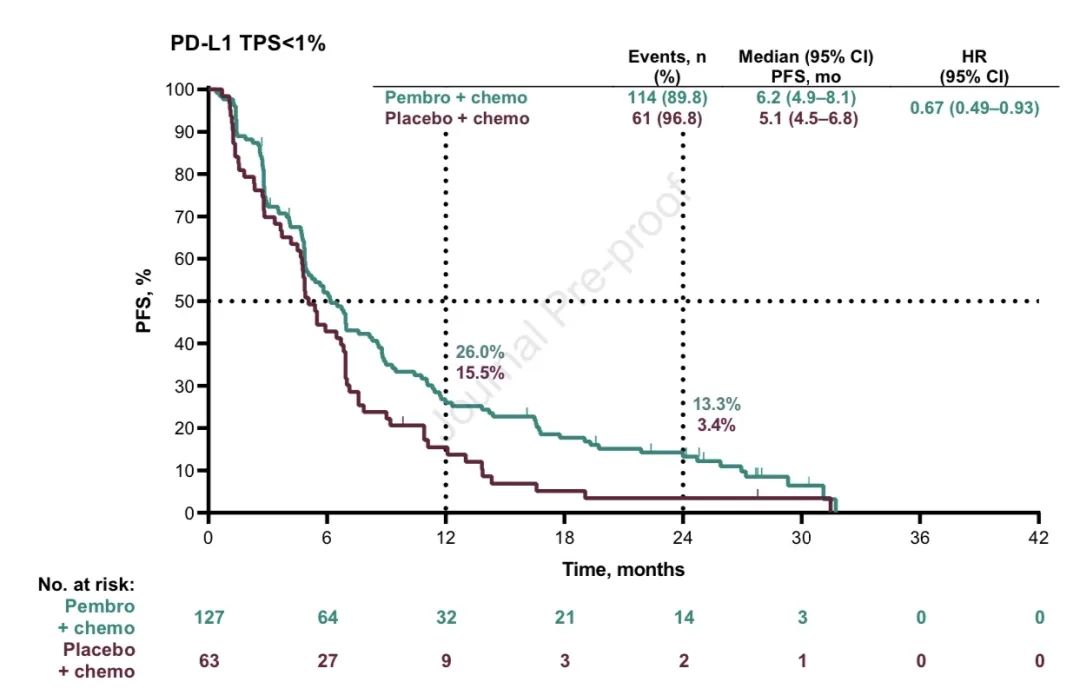
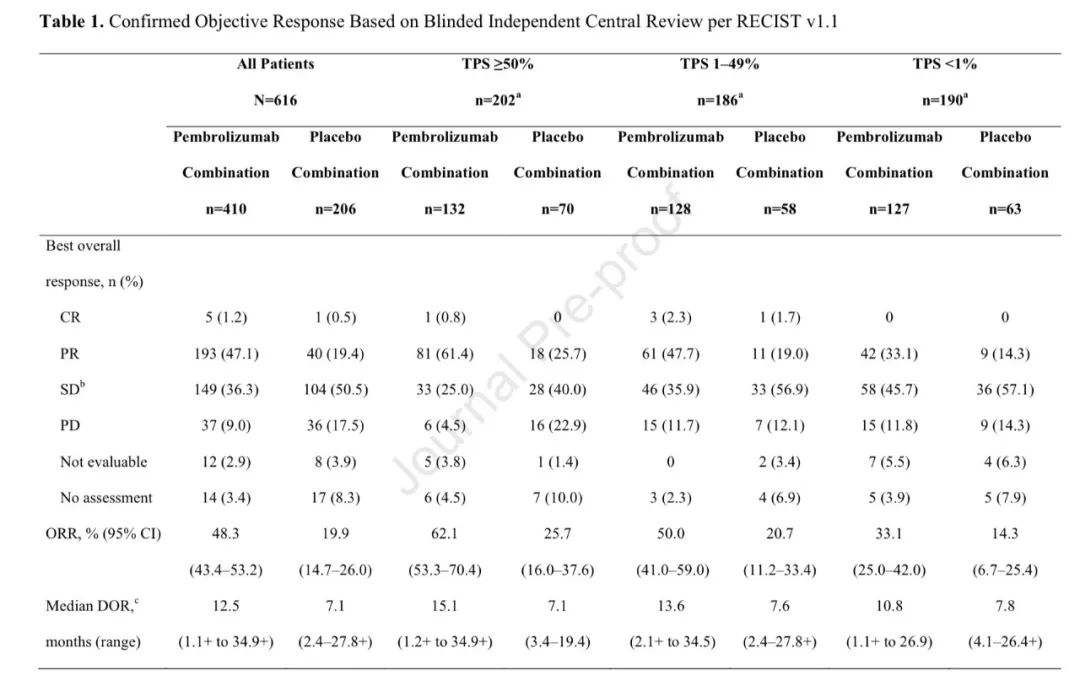
3)两组ORR分别为:48.3% vs 19.9%;中位DOR分别为:12.5个月 vs 7.1个月;中位PFS2分别为:17.0个月 vs 9.0个月(HR,0.50;95% CI,0.41-0.61)。
化疗组有84例患者疾病进展后接受帕博利珠单抗治疗,其中28.6%的患者PD-L1≤1%,中位交叉时间为6.9个月,患者接受帕博利珠单抗治疗后,中位PFS为2.8个月,24个月的PFS率12.1%。


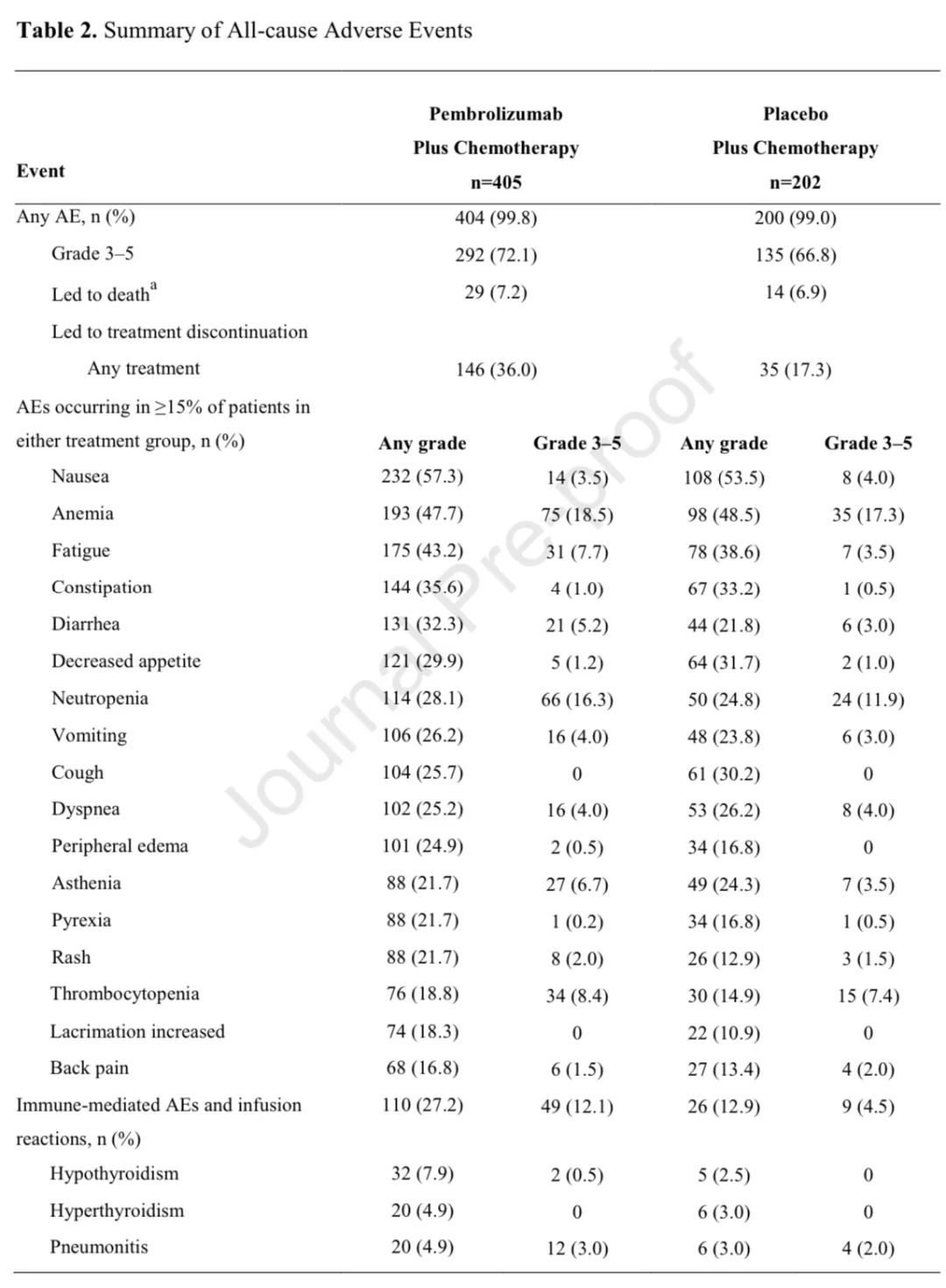
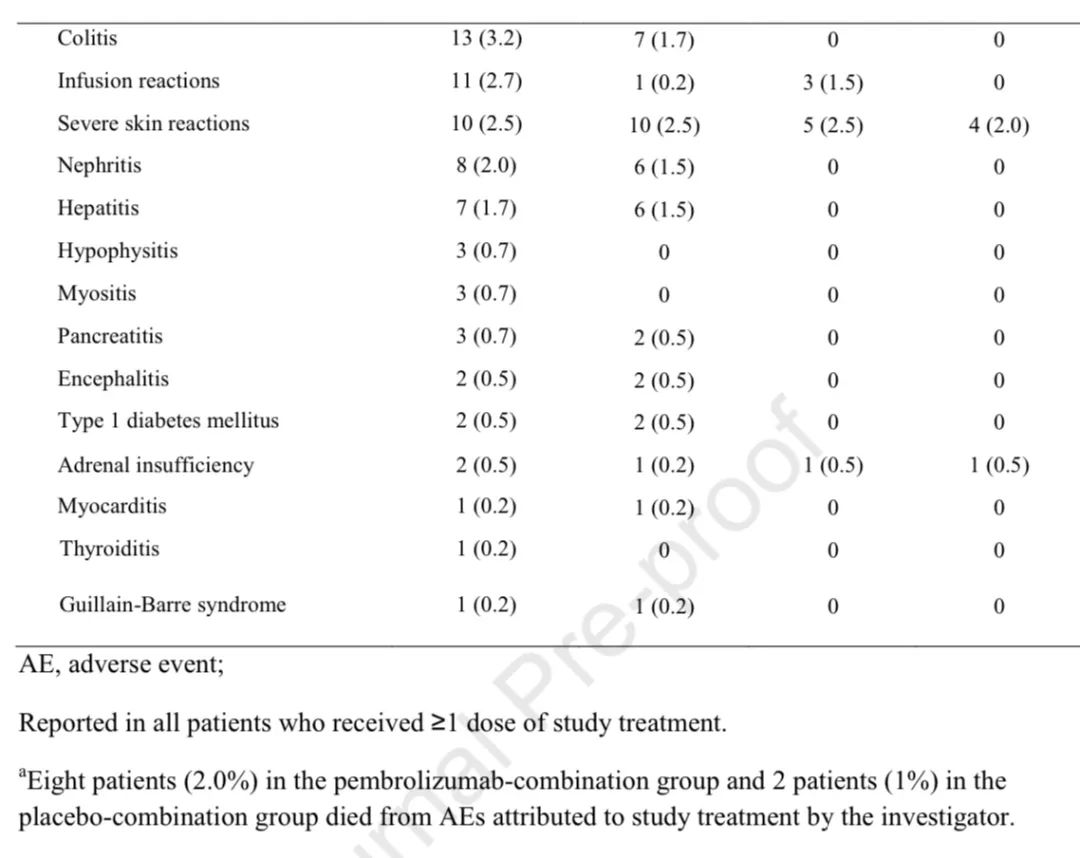
不良反应
安全性:两组分别有99.8%和99.0%的患者出现全因任何级别不良反应,其中治疗相关不良反应发生率分别为92.8%和90.6%。3-5级全因不良反应发生率分别为72.1%和66.8%。两组分别有7.2%和6.9%的患者出现致死性不良反应。
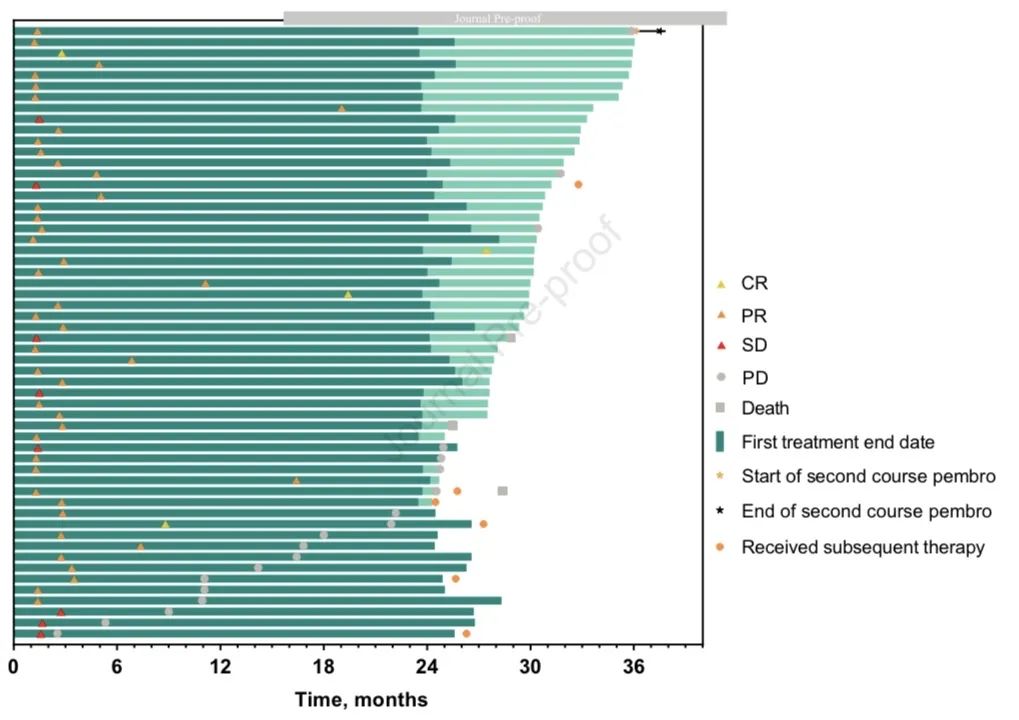
研究中,56例患者完成35周期治疗,基线特点和ITT人群相似,其中83.9%的患者PD-L1≥1%,中位治疗时间为25.6个月,ORR为85.7%,包括4例CR,44例PR及8例SD,中位响应持续时间为34.5个月,中位OS未达到。在数据截止时,53例【(94.6%),PD-L1≥50%,n=30;1-49%,n=15;<1%,n=6,和2例无法评估】 存活,33例无疾病进展或后续治疗,14例在完成35周期前出现疾病进展并允许按照方案规定在进展后继续治疗。这部分患者中,3~4度不良反应发生率为60.7%。
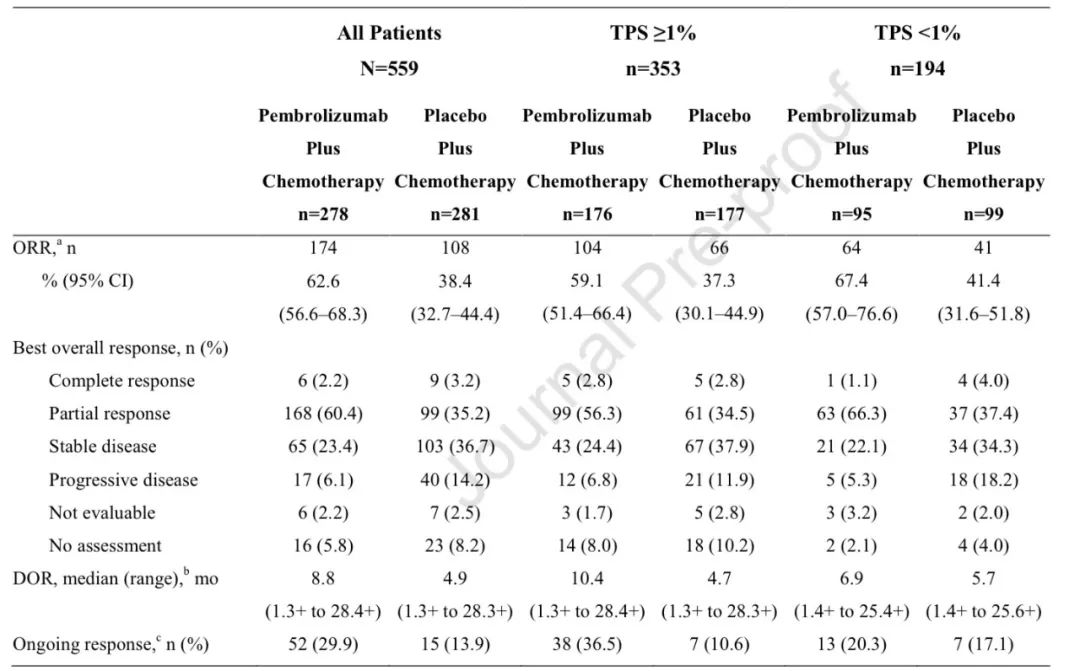
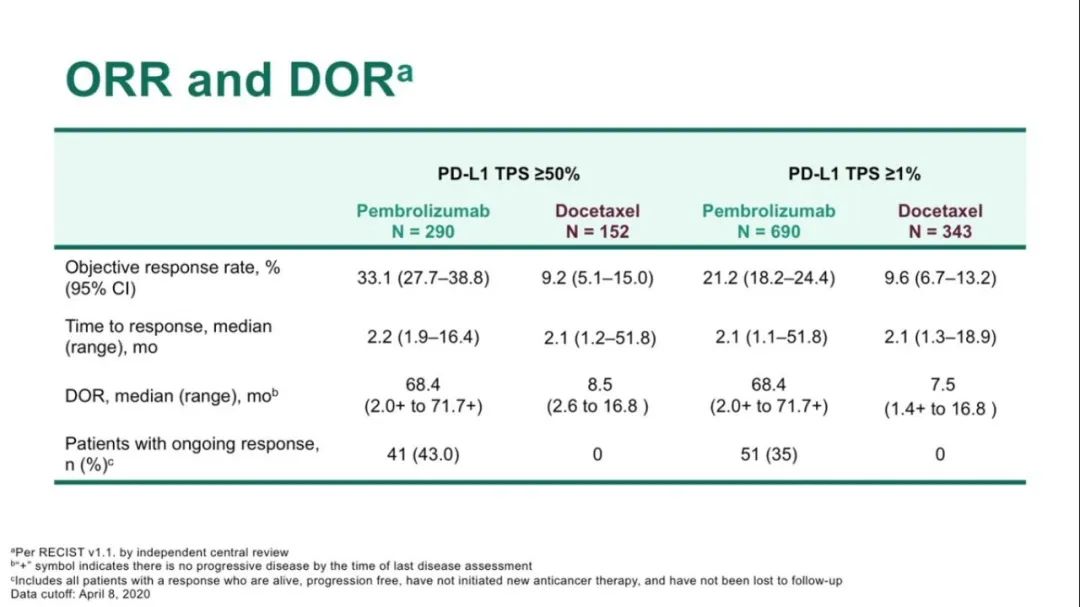
全组患者ORR
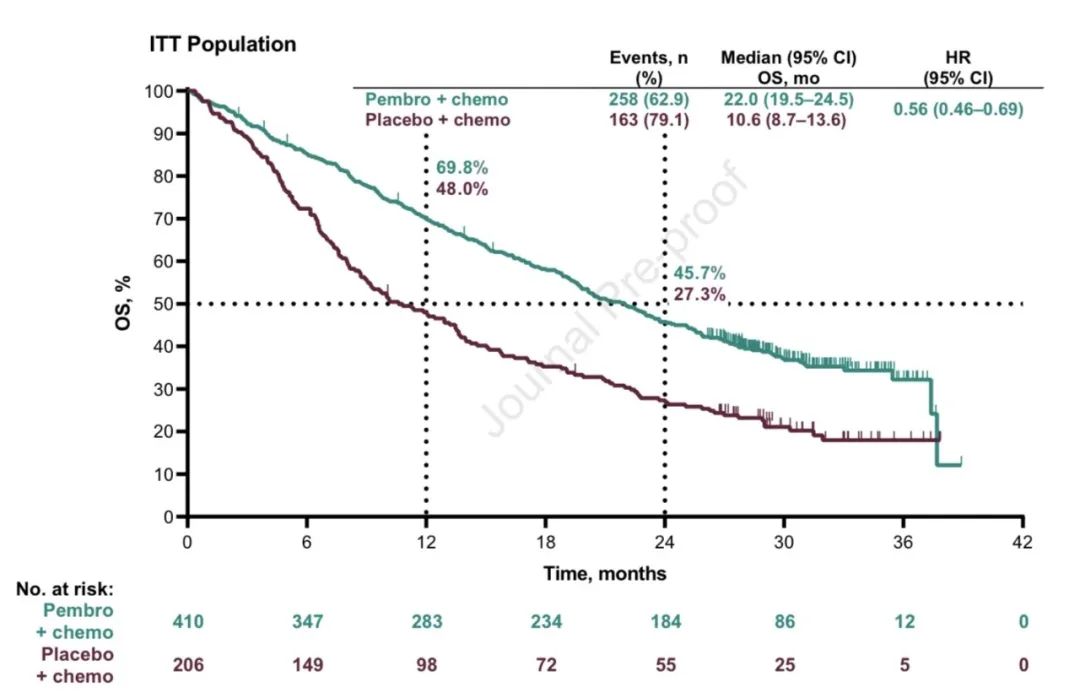
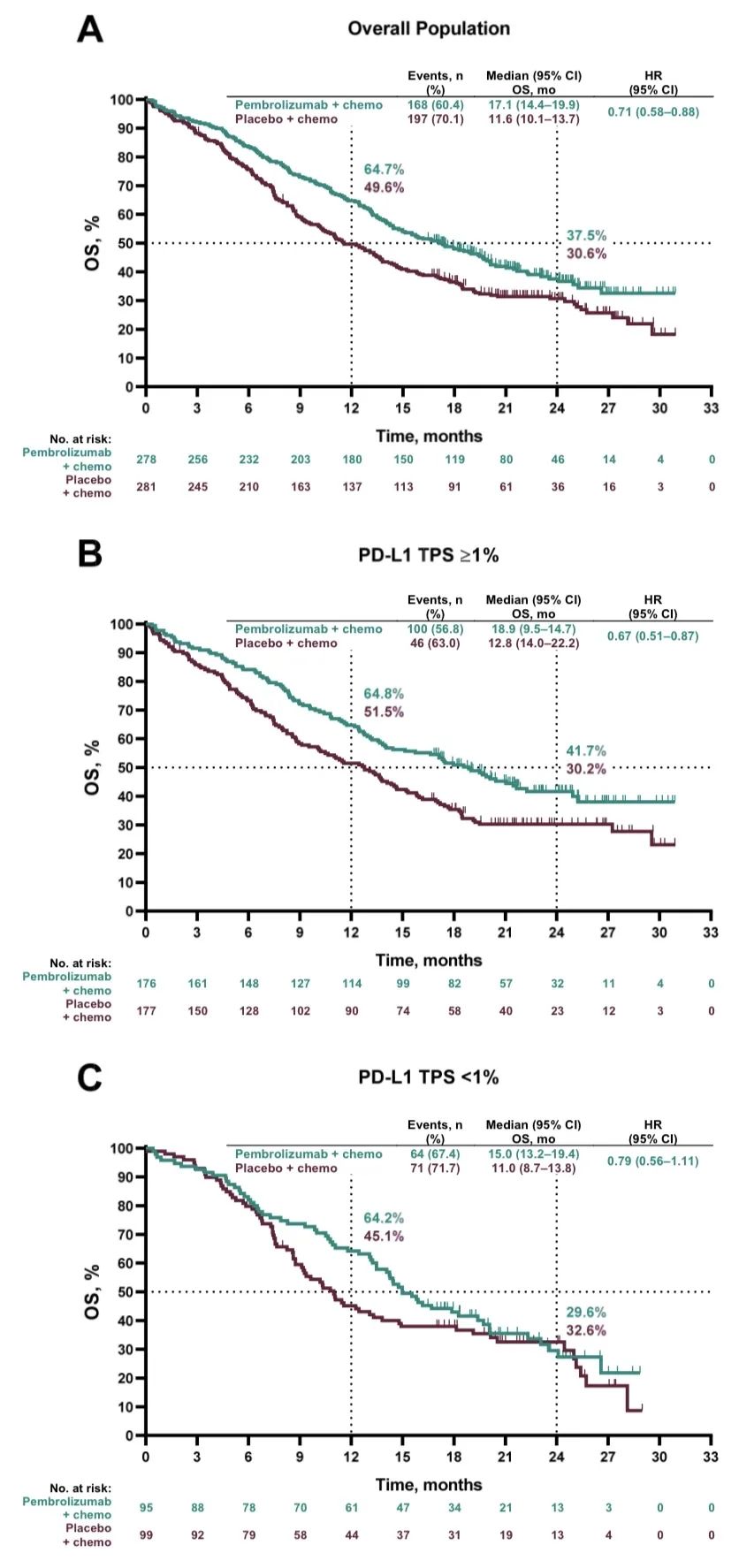
数据分析时,全组共出现365例死亡事件,两组的OS分别为17.1 vs 11.6个月(HR=0.71, 95% CI, 0.58‒0.88),PFS分别为8.0 vs 5.1个月(HR=0.57, 95% CI, 0.47‒0.69),ORR分别为62.6% vs 38.4%,DOR分别为8.8 vs 4.9个月。
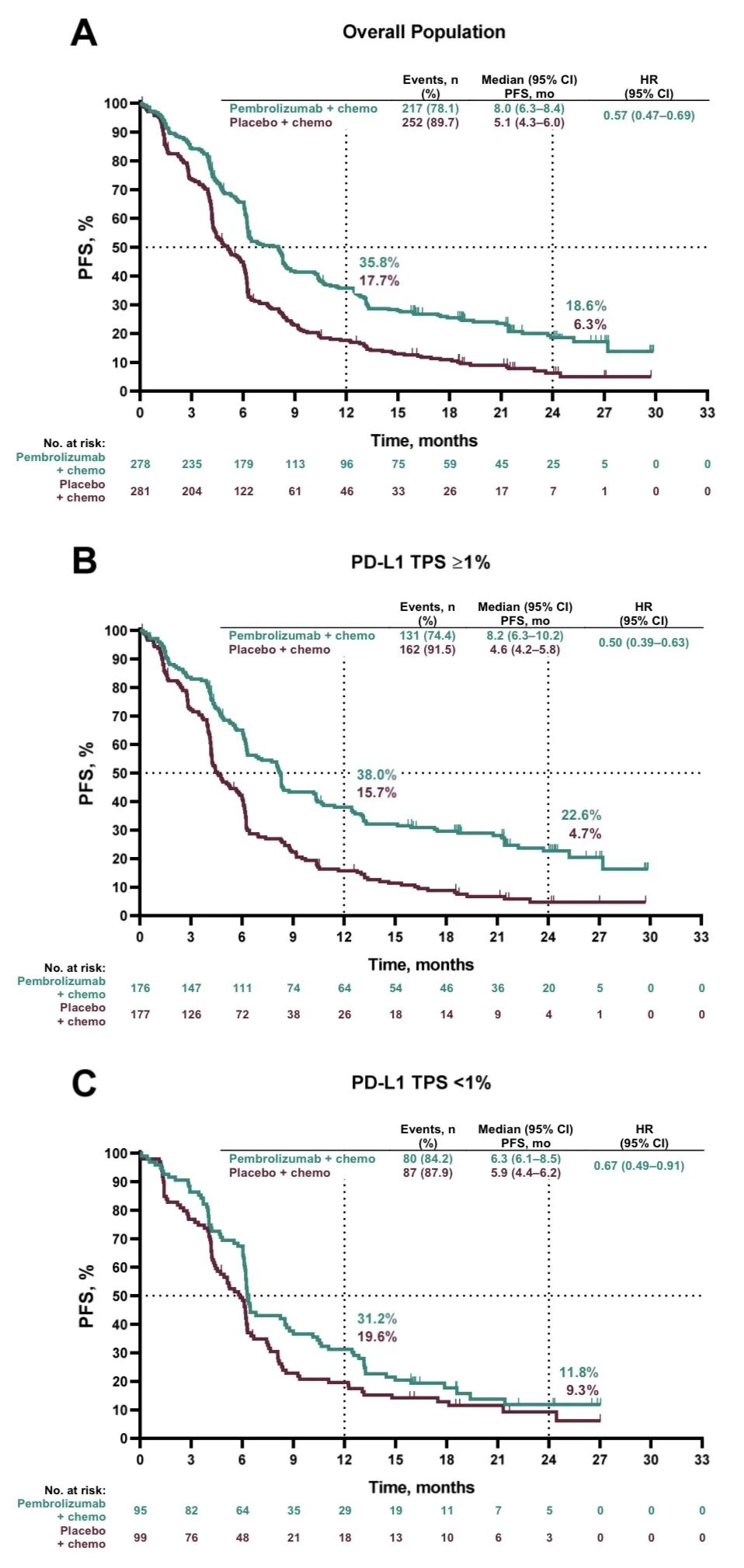
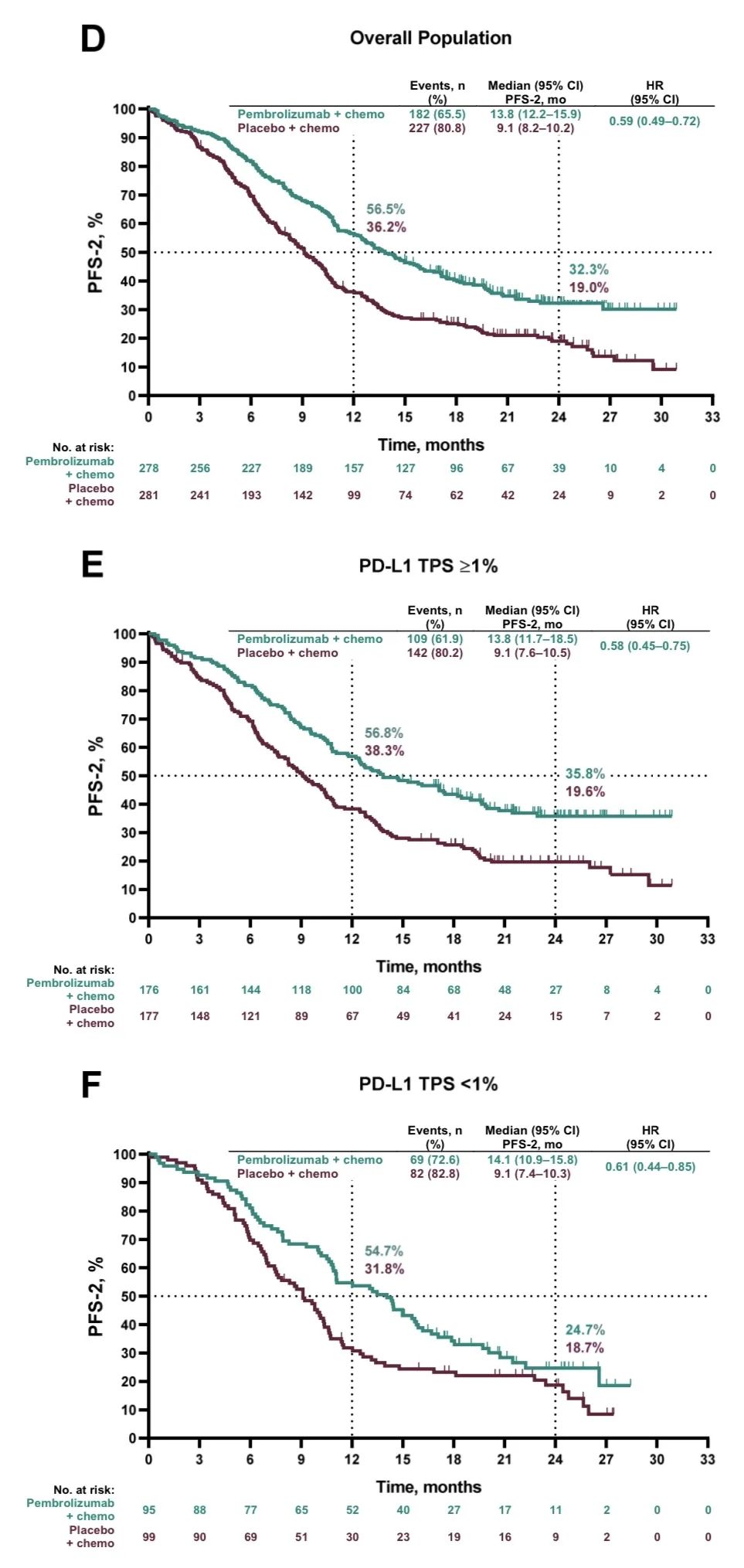
PFS2:从随机分组开始至第二次疾病进展或死亡的时间
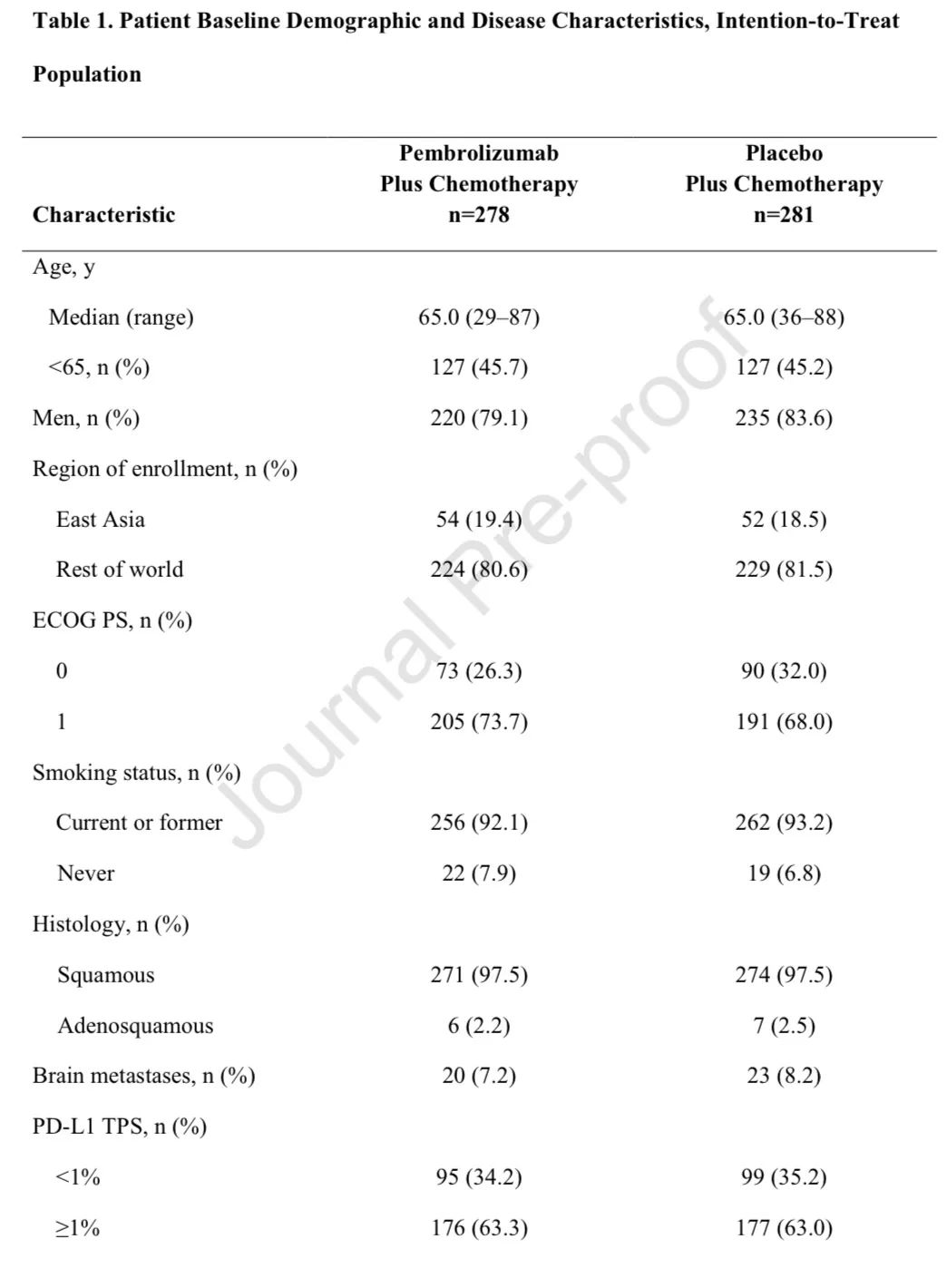
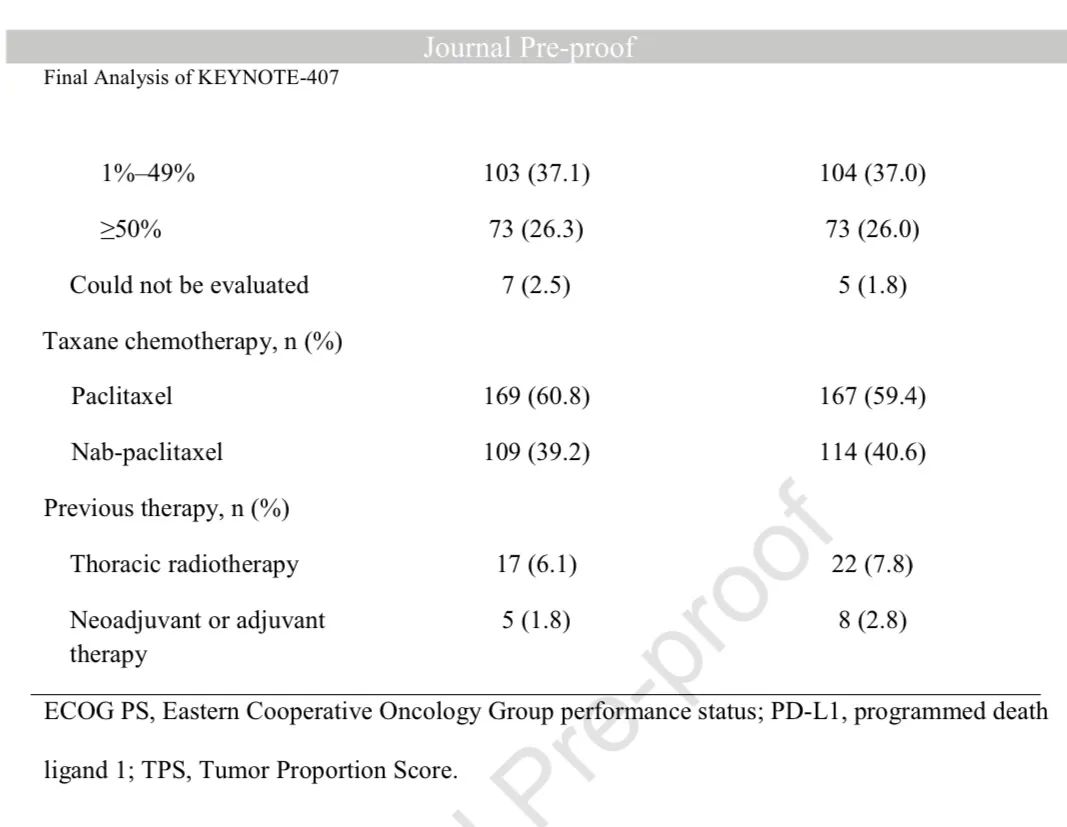
基线特征
安全性→
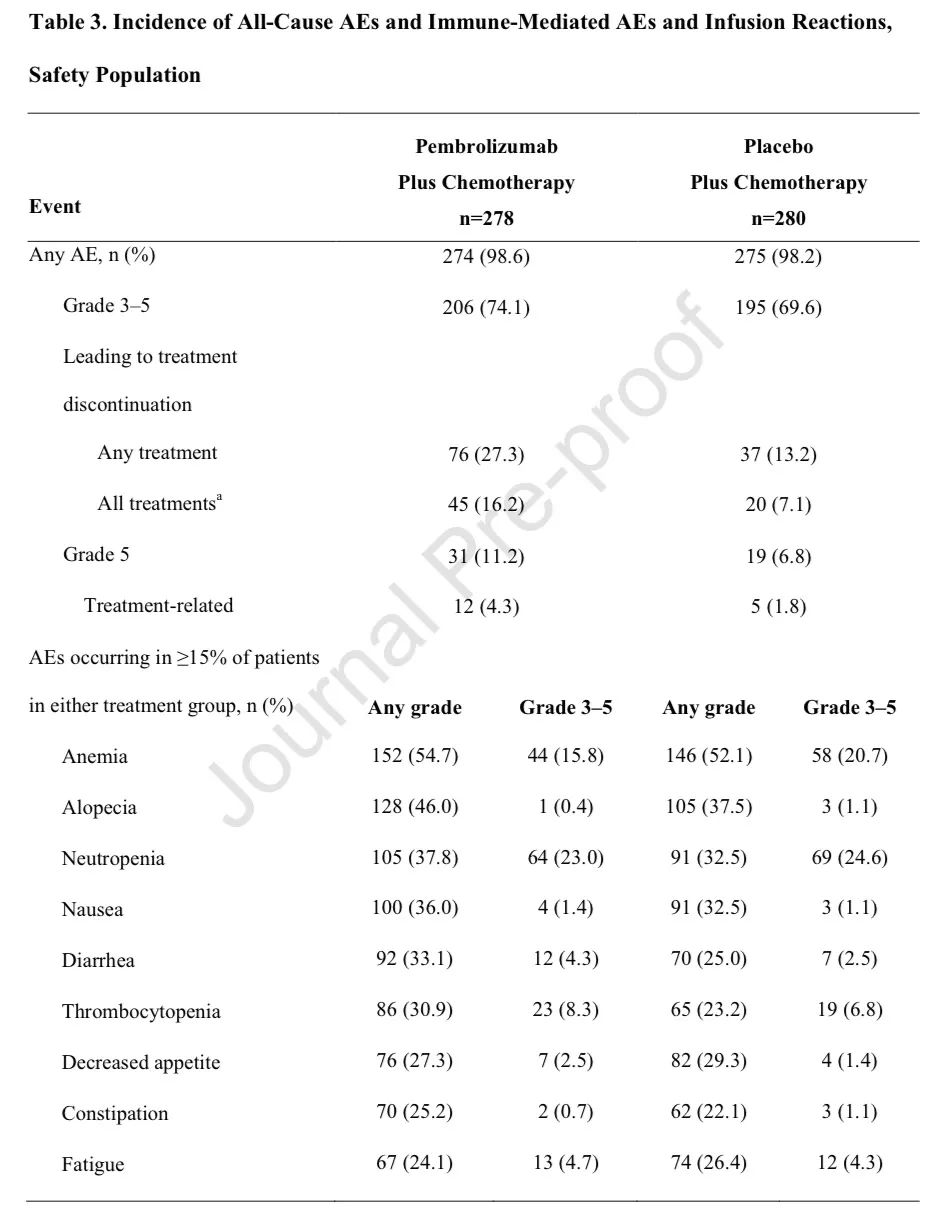
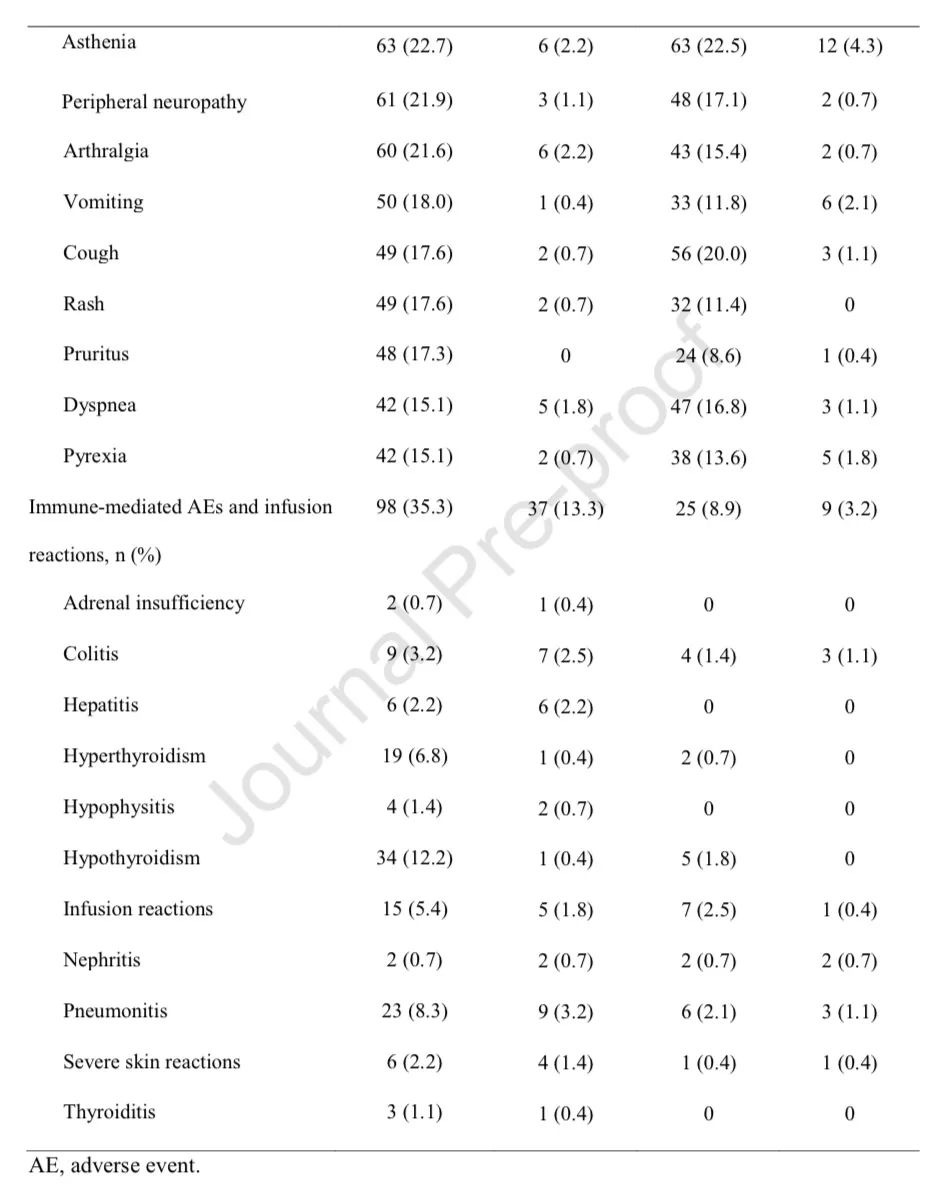
2020年ELCC大会上,研究者报告了完成35个疗程(约2年)的患者的长期数据和结局。在55例完成帕博利珠单抗35个周期的患者中,ORR为92.7%(5例 CR,46例 PR),其中4例患者(7.3%)疾病稳定(SD)。51例(92.7%)存活,完成35个周期后的1年OS和PFS率分别为96.0%和82.6%。7例患者在数据截止时开始了第二疗程的帕博利珠单抗治疗。
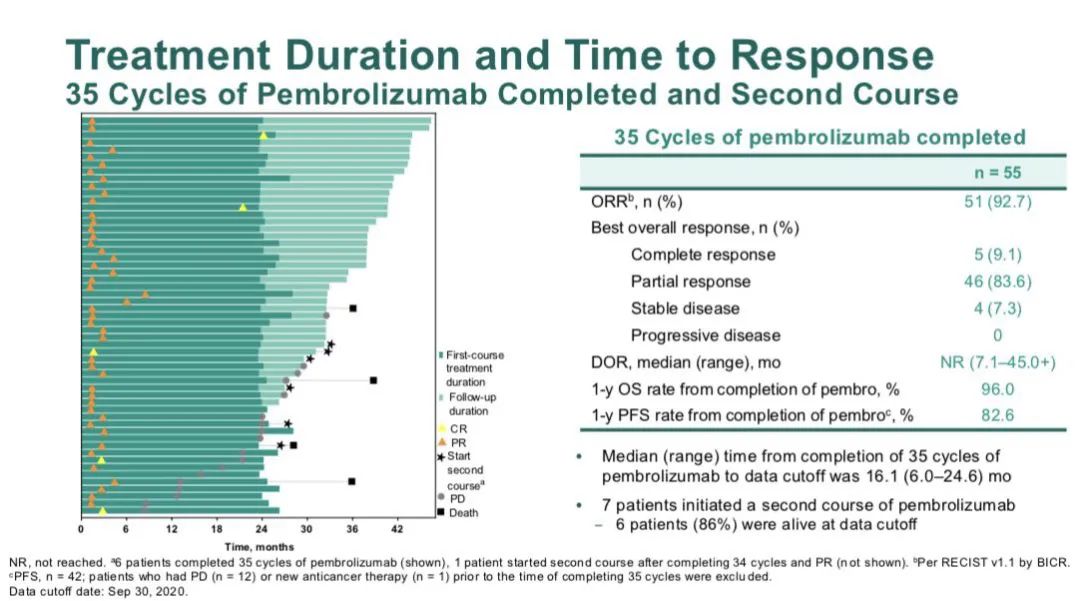

患者入组流程图
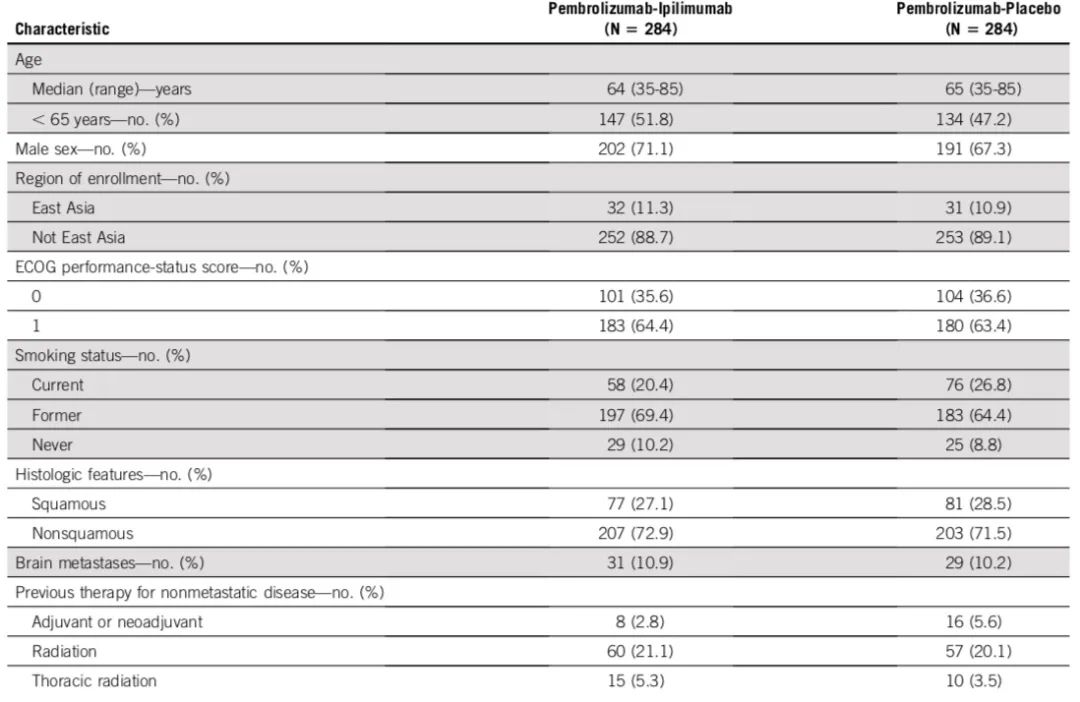
患者基线特征
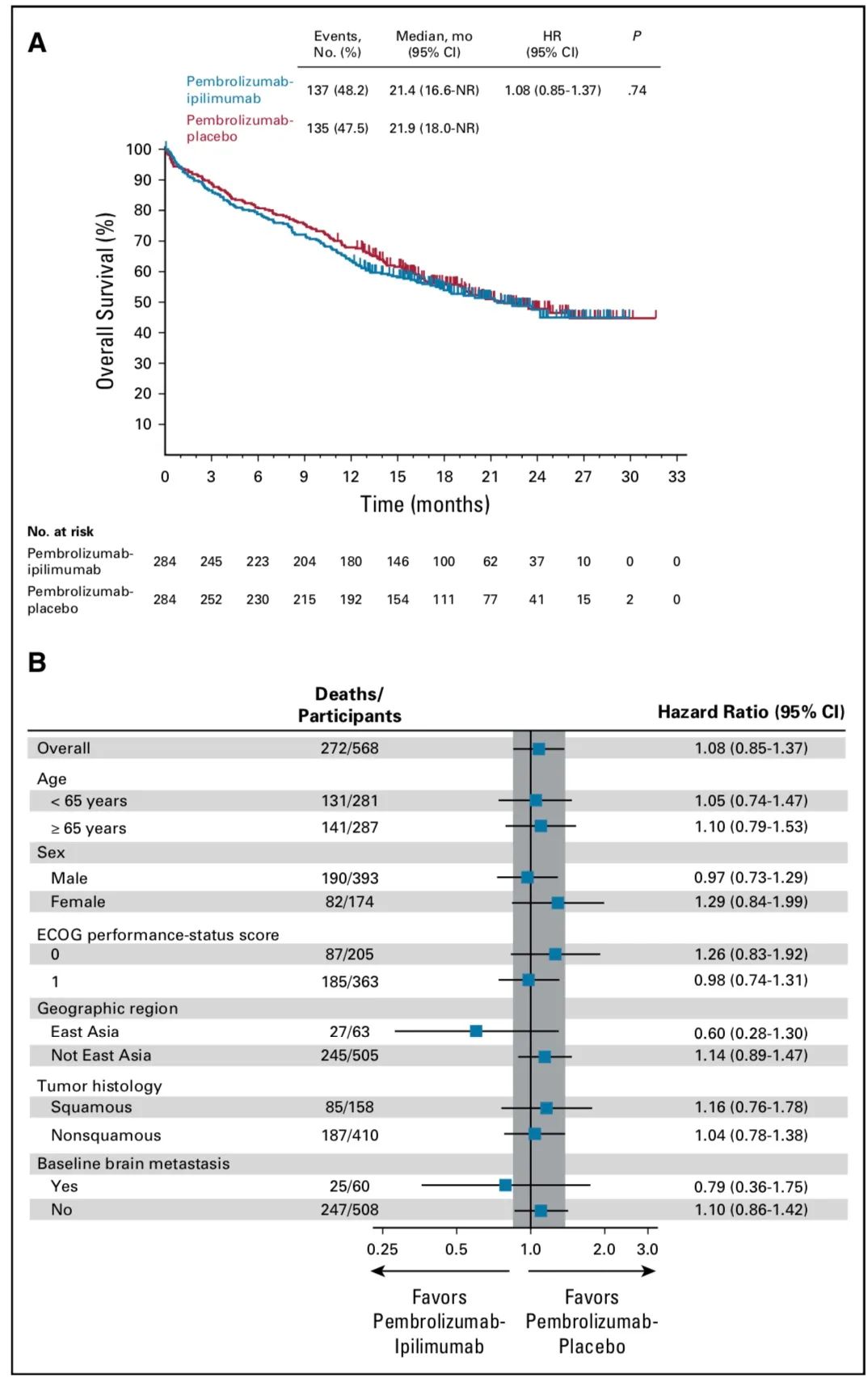
OS及亚组分析
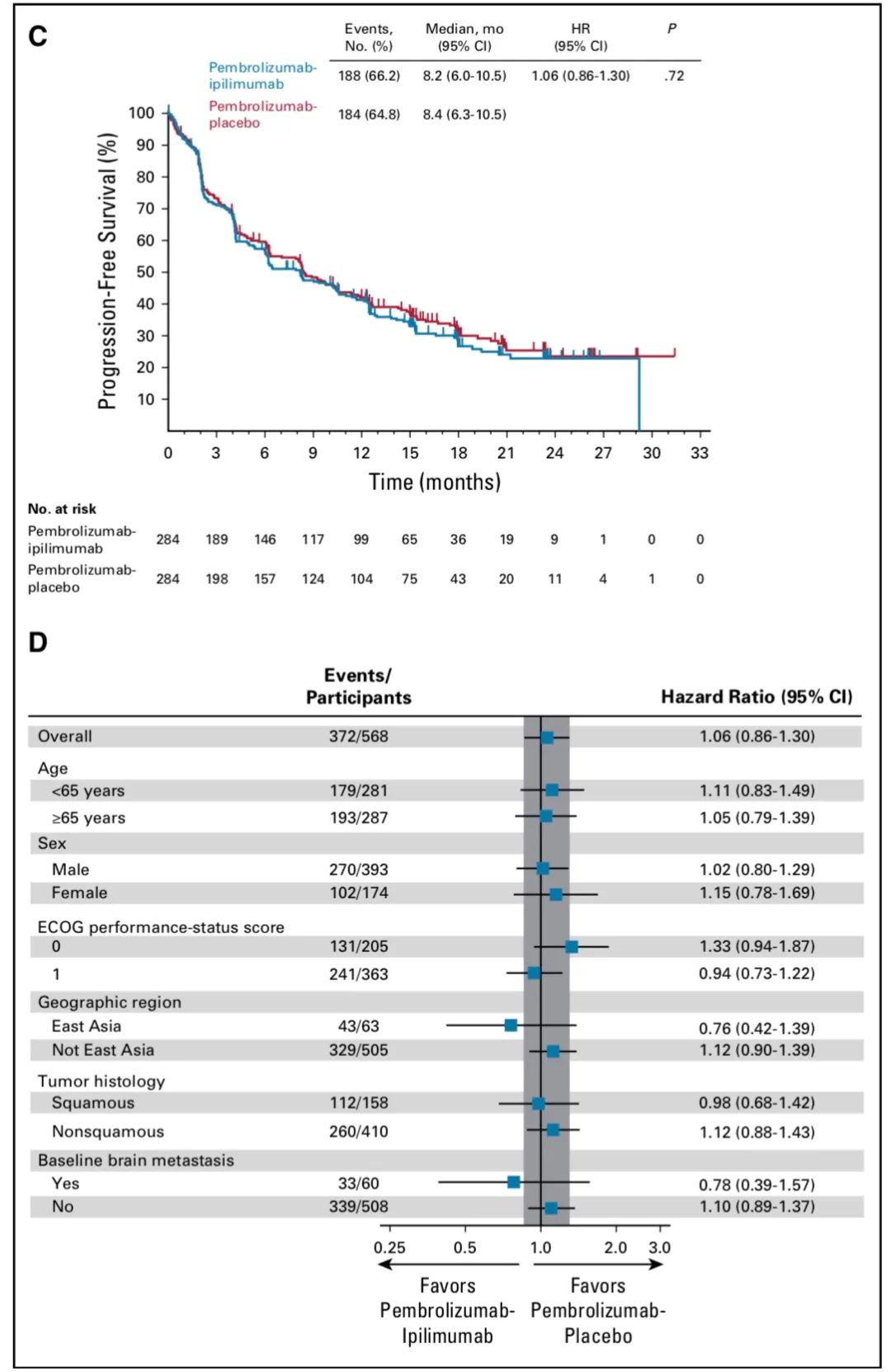
PFS及亚组分析
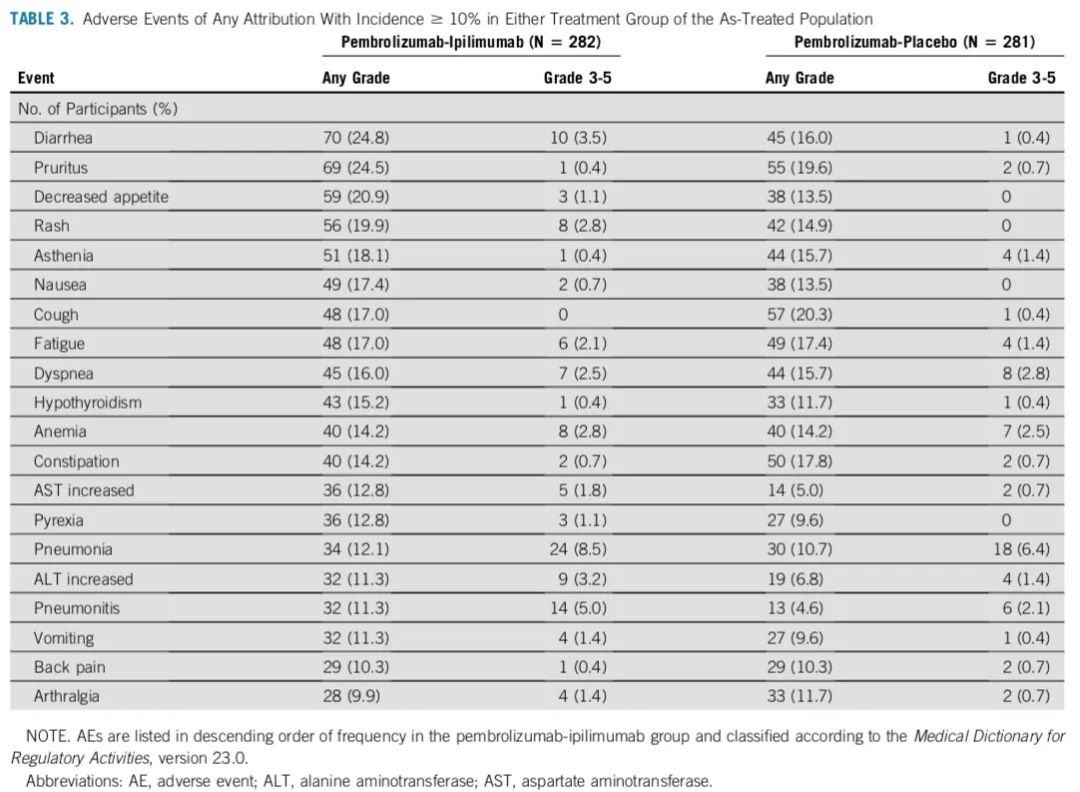
两组的安全性数据
术后辅助治疗
PEARLS/KEYNOTE-091研究
研究设计、基线特征


III期不可切除
KEYNOTE-799(NCT03631784)是一项正在进行中的非随机、开放标签的II期研究,评估了Pembrolizumab(Pembro)联合同步放化疗(cCRT)治疗既往未治疗、不可切除、病灶可测量、IIIA-C期非小细胞肺癌(NSCLC)的疗效。主要研究终点是客观缓解率(ORR)和≥3级肺炎的发生率。既往中期分析显示,A队列(鳞状/非鳞状NSCLC)和B队列(非鳞状NSCLC)的客观缓解率(ORR)分别为67%和56.6%。≥15周随访时,A队列和B队列中,3级及以上肺炎发生率分别为8.0%和5.5%。本次会议报道了另外随访6个月的研究结果。研究方案如下:
A队列:患者接受1周期卡铂(AUC6)+紫杉醇(200mg/m2)+Pembro(200mgQ3W)治疗;3周后,患者接受卡铂(AUC2 QW)+紫杉醇(45mg/m2 QW)共6周,以及Pembro(200mgQ3W)2个周期加标准胸部放疗(TRT);
B队列:患者(仅非鳞NSCLC)接受顺铂(75mg/m2 Q3W)+培美曲塞(500 mg/m2 Q3W)+Pembro(200mg Q3W)治疗3个周期,其中第2和第3个周期联合TRT。
此后,两组患者均接受了额外14个周期的Pembro(200mg Q3W)治疗。

研究设计

ORR、DoR
<< 滑动查看下一张图片 >>
一线治疗
KEYNOTE-604研究[14]与IMpower133研究相似,是一项随机双盲安慰剂对照的III期研究;CASPIAN研究则是研究者和患者为非盲状态,申办方为盲态的III期研究。KEYNOTE-604研究比较的是帕博利珠单抗(pembrolizumab)联合标准化疗(卡铂或者顺铂/依托泊苷)与安慰剂联合标准化疗一线治疗ES-SCLC的疗效和安全性。
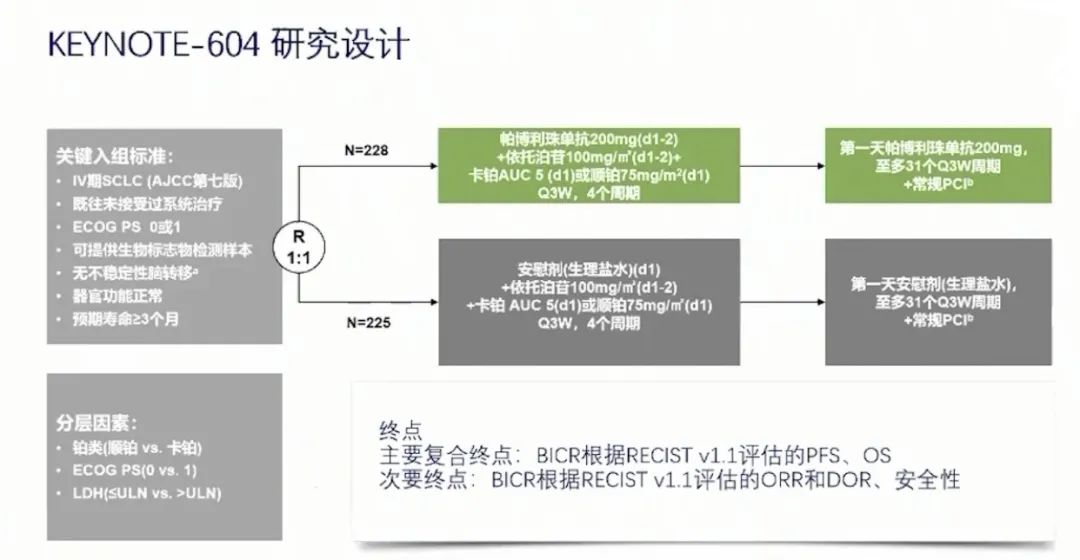

这项研究中453例患者被随机化,帕博利珠单抗联合化疗组为228例,安慰剂联合化疗组为225例,两组分别有223例和222例接受了至少1剂研究治疗。
从患者的基线特征看,患者在年龄、性别、ECOG评分、吸烟状态、乳酸脱氢酶水平、肝转移的情况是均衡的;帕博利珠单抗联合化疗组脑转移患者占14.5%,化疗组占9.8%;帕博利珠单抗联合化疗组PD-L1联合评分≥1的38.6%,化疗组占43.1%。
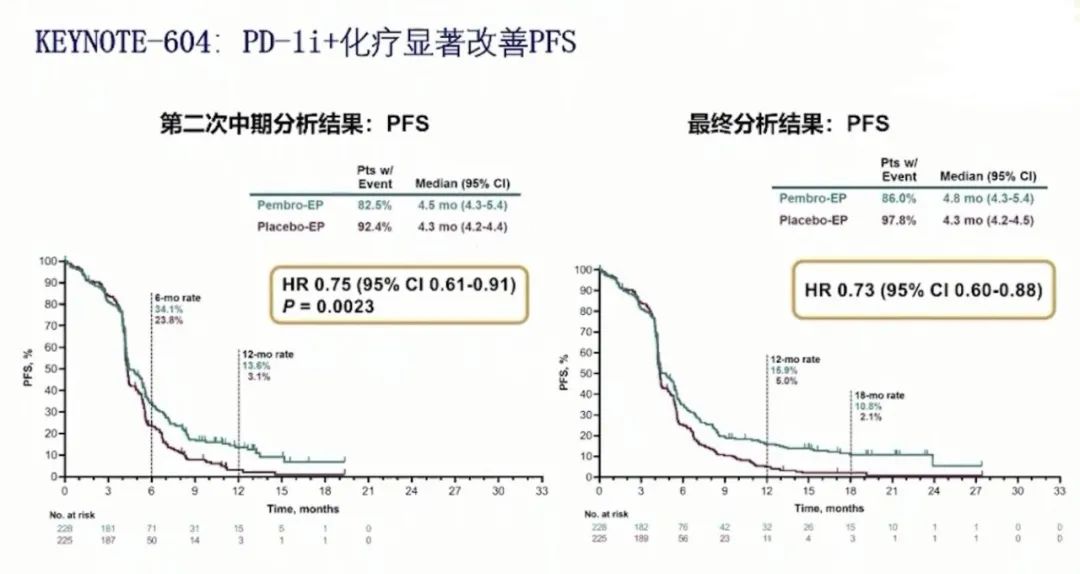
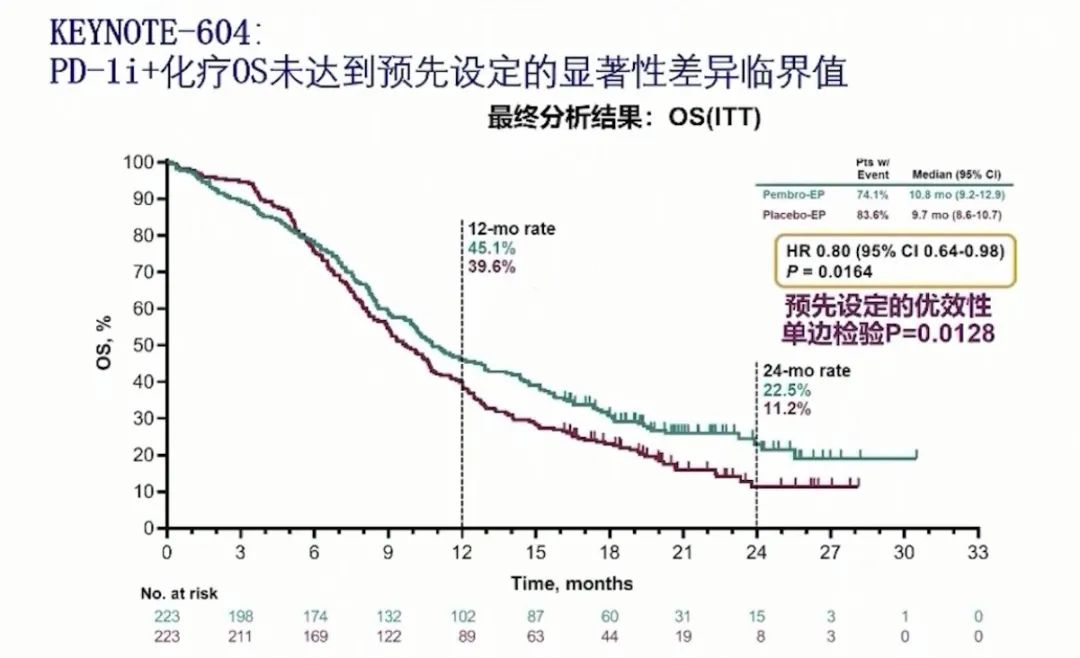
这项研究进行了2次中期分析,第二次中期分析时,在意向治疗人群中,帕博利珠单抗联合化疗组和化疗组的中位PFS分别为4.5个月和4.3个月(HR:0.75,P=0.0023),达到了预设的单边的P=0.0048;在最终分析时,帕博利珠单抗联合化疗组和化疗组中位的PFS分别为4.8个月和4.3个月(HR:0.75);中位的OS分别为10.8和9.7个月(HR:0.80 , P=0.0164),但是最终的OS没有满足预设的P=0.0128。两组患者的12个月OS率分别为45.1%和39.6%,24个月OS率为22.5%和11.2%,帕博利珠单抗联合化疗组在OS率方面具有优势。在ORR方面,帕博利珠单抗联合化疗组和化疗组分别为70.6%和61.8%,DOR分别为4.2个月和3.7个月。
安全性:治疗导致的任何级别的AE,帕博利珠单抗联合化疗组与化疗组分别为100%和99.6%,3-4级不良反应是76.7% vs 74.9%,5级AE为6.3% vs 5.4%;两组因AE导致治疗终止的患者比例分别为14.8% vs 6.3%。需要治疗的免疫相关的所有级别AE,帕博利珠单抗联合化疗组和化疗组分别为24.7%和10.3%,其中3/4级AE分别为7.2%和1.3%。
研究认为:帕博利珠单抗联合化疗显著改善了一线治疗ES-SCLC的PFS,尽管与化疗相比,帕博利珠单抗联合化疗一线治疗ES-SCLC的OS没有获得的预测的统计学差异,但是从OS的风险比来看是有获益趋势的。
三线治疗


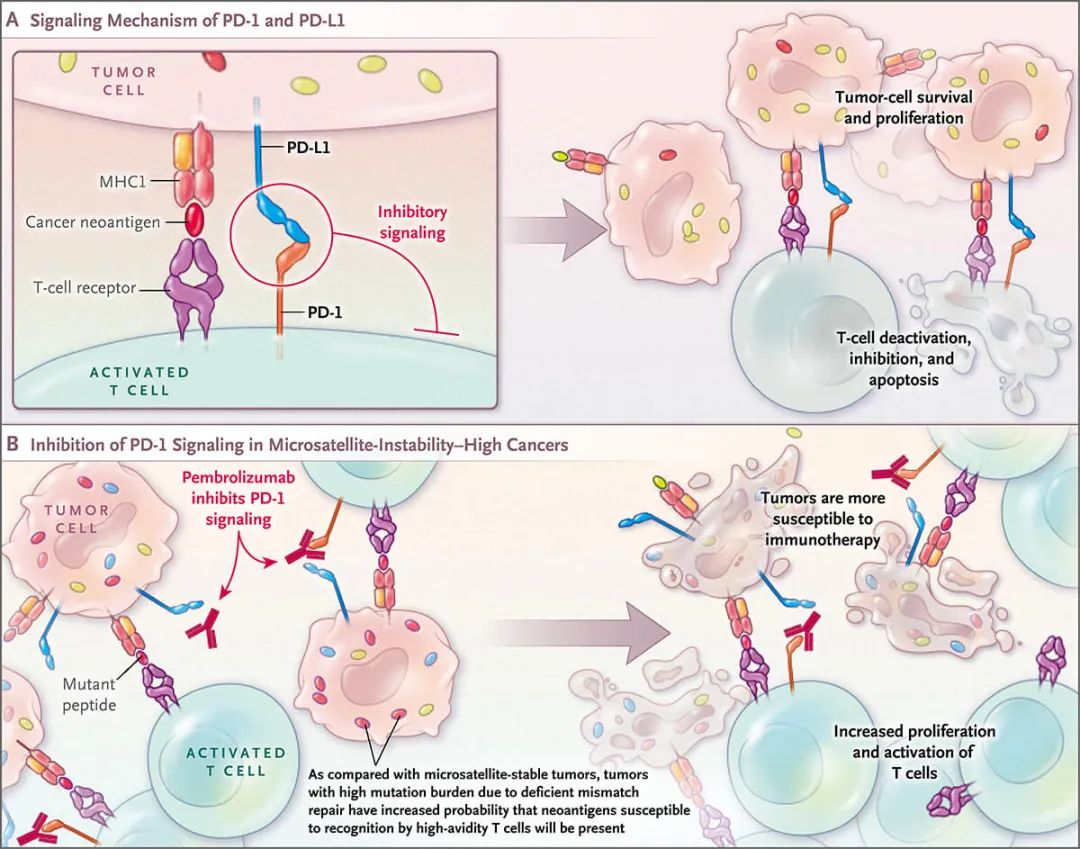
PD-1和PD-L1的信号机制以及高微卫星不稳定癌症中PD-1信号的抑制作用
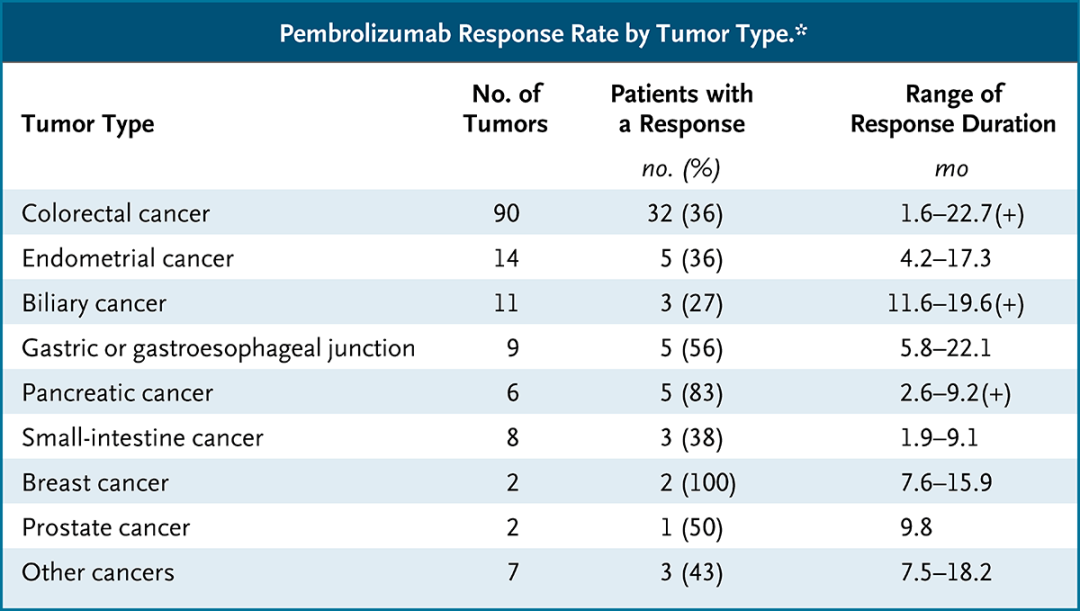
帕博利珠单抗在不同肿瘤中的应答率[15]
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)