肺癌 NGS 肿瘤研究可以怎么学的文章,如下图所示。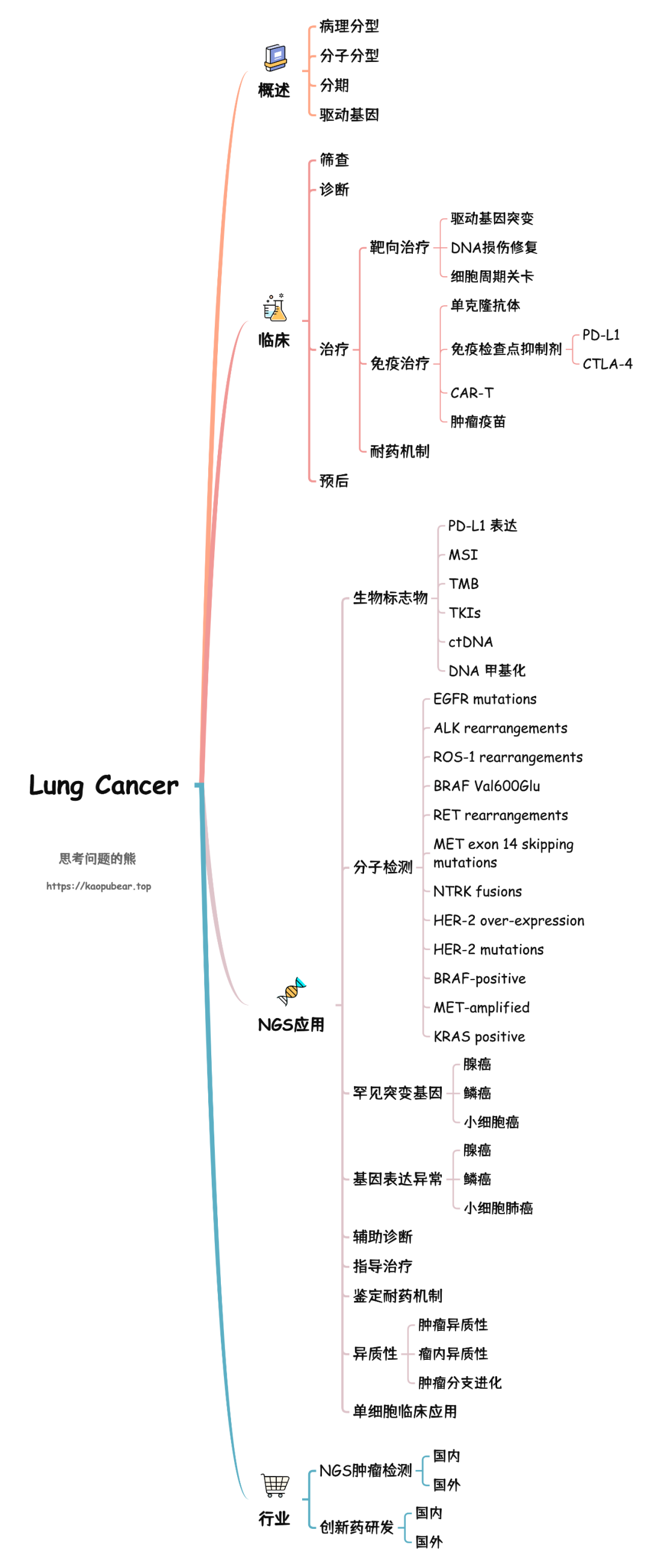
那个时候刚刚从生信涉及到癌症研究,看着上面这个图,我就寻思有没有一个类似于编年史的肿瘤重要研究进展。比如可以按照编年体的样子梳理重要的临床研究或癌症药物开发历史。转眼一年时间过去,最近「网上冲浪」的时候我突然发现 ASCO 竟然把这个事情做了。或许是为了纪念他们的国家癌症法案颁布 50 周年,ASCO 官网专门建立了一个叫做 Cancer Progress Timeline 的页面,https://www.asco.org/research-guidelines/cancer-progress-timeline。这个抗击癌症里程碑的进展时间表提供了癌症主要进展的历史概述,记录了跨越 170 年的 400 多个里程碑。从 19 世纪中期全身麻醉的出现为癌症手术打开大门,到 2017 年 FDA 批准了第一个癌症基因疗法。时间线内容突出了癌症治疗和研究领域的一些最重要的进展,几乎所有的里程碑都是严格进行的临床试验结果。我挑选其中靶向治疗相关内容进行学习梳理后有了今天这篇文章。如果你觉得这篇文章太长不看,可以直接保存下面这张图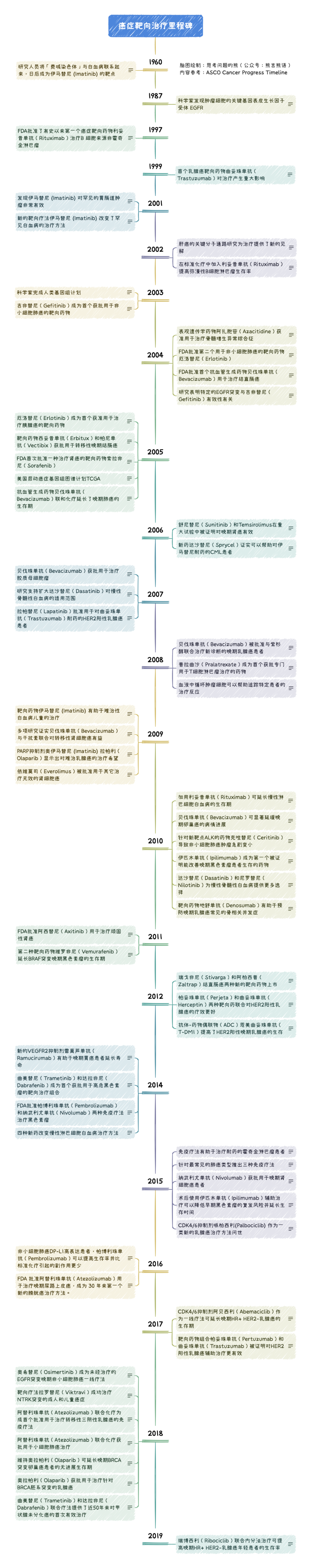
接下来就让我们一起开始这趟跨越70年的癌症靶向治疗的里程碑回顾。对了,如果能耐心看到文末还可以找到为你准备的一个彩蛋。
1960 年,来自美国费城的研究人员发现了一种与许多白血病患者有关的染色体异常。直到十年后,研究人员发现,当 9 号和 22 号两条染色体的一部分发生易位时,就会产生这种异常。后来,它成为有史以来第一种靶向癌症治疗药物伊马替尼 (Imatinib) 的靶点,而伊马替尼 (Imatinib) 则改变了慢性粒细胞白血病和其他癌症的治疗方法。距离白血病患者染色体异常被发现的 27 年之后的 1987 年,研究人员首次确定癌细胞上一种名为表皮生长因子受体(EGFR)的基因在非小细胞肺癌的生长和扩散中起着重要作用。正是这一发现为我们提供了一个新的治疗目标,并导致了之后几十年来多个靶向药物的开发,比如厄洛替尼(Erlotinib)。又过了 10 年,1997 年,美国 FDA 批准了第一个癌症分子靶向药物利妥昔单抗(Rituximab),用于治疗其它治疗方法无效的 B 细胞来源非霍奇金淋巴瘤患者。利妥昔单抗(Rituximab)属于一类新的药物,如今被我们称为单克隆抗体,它针对免疫 B 细胞来干扰癌症的发展。日后,这类药物可以与其他癌症治疗方法相结合,从而提高患者的生存。1999 年,人们在准备迎接千禧年的同时,大约 25%的乳腺癌患者则迎来了一种名为曲妥珠单抗(Trastuzumab)的靶向药物。在过度表达 HER2 蛋白质的乳腺癌,化疗中加入这种单克隆抗体可以极大的提高晚期乳腺癌的生存率。而曲妥珠单抗(Trastuzumab)的作用还远不止于此,2006 年,它被批准用于早期 HER2 阳性乳腺癌妇女术后辅助治疗,研究显示药物可以将复发的风险降低 50%以上,这是一个前所未有的结果。如今,曲妥珠单抗(Trastuzumab)也被 FDA 批准用于治疗有类似 HER2 过表达的胃癌患者。
时间跨过千禧年,2001 年 FDA 仅仅在三个月的审查之后就批准了伊马替尼 (Imatinib),研究数据显示该药物在大多数患者中可以阻止慢性骨髓性白血病(CML)的进展。伊马替尼 (Imatinib) 作为是第一种被证明能够对抗所谓 「费城染色体」分子缺陷的药物,在 1960 年首次被发现后,它已成为 CML 的标准治疗方法,其有效性和易于服用优势使大多数患者能够将 CML 作为一种可控的慢性疾病。这一年可以说是伊马替尼 (Imatinib) 的高光年,在被批准用于治疗慢性骨髓性白血病仅数周后,靶向药物伊马替尼 (Imatinib) 就被证明对一种名为 GIST(胃肠道间质瘤)的罕见肿瘤有效。在伊马替尼 (Imatinib) 之前的药物治疗对 GIST 肿瘤几乎都没有效果。
一年之后,2002 年,已于 1997 年被 FDA 批准的靶向药物利妥昔单抗(Rituximab)在加入标准的化疗方案(CHOP)后,被证明能够提高老年弥漫性 B 细胞淋巴瘤患者的生存率。随后试验则证实了其在所有年龄段患者中的结果,"R-CHOP "组合很快就成为这种类型的非霍奇金淋巴瘤的标准治疗方案。话分两头,2002 年 8 月 1 日,Nature genetics 发表了一篇肝癌分子发病机制的研究进展。研究人员发现了调控肝癌细胞生长的遗传途径,表明肝癌的发展是由于多种途径的破坏进而导致了许多遗传上不同形式的肝癌。这些发现一方面解释了为什么基因靶向药物的开发在过去十年中被证明极具挑战性,另一方面也为研究人员提供了一些潜在的治疗目标来进行探索。
2003 年是人类生物学研究进程中有重要纪念意义的一年,来自七个国家的研究人员宣布他们已经成功绘制了人类基因组中 30 亿个 DNA 地图。这项历时 13 年的人类基因组结果将免费提供给世界各地的科学家,而基因组序列如今是我们所有基于高通量测序肿瘤研究的基础。同年 FDA 批准了首个非小细胞肺癌靶向治疗药物,来自于阿斯利康的吉非替尼(Gefitinib),此前的研究显示它能缩小一部分采用了其他疗法但仍进展的晚期癌症患者肿瘤,吉非替尼(Gefitinib)所靶向的,正是我们上文提到 1987 年就被科学家发现的 EGFR 基因。然而,16 年的等待并没有立刻换来吉非替尼(Gefitinib)大显身手,仅仅 2 年之后,FDA 就限制了吉非替尼(Gefitinib)的使用场景。因为 2005 年的一项大型临床研究发现,和安慰剂相比吉非替尼(Gefitinib)治疗根本就没有延长患者的寿命,不过这项研究也提到从未吸烟的患者和亚裔患者可以从中受益。直到 2009 年和 2010 年,两篇先后发表在新英格兰医学的临床研究才有力的表明吉非替尼(Gefitinib)确实有作为一线治疗的价值,只不过它是在携带 EGFR 突变的患者中比化疗更有效。
2004 年,一系列重要的研究表明,具有 EGFR 特定突变的肺癌肿瘤对 EGFR 靶向药物的反应很强。表皮生长因子受体是刺激癌细胞分裂的重要信号通路,这些发现为确定最有可能对吉非替尼(Gefitinib)产生反应的患者群体提供了关键信息。于此同时,FDA 批准了第二个用于非小细胞肺癌的靶向药物厄洛替尼(Erlotinib)。来自于罗氏的厄洛替尼(Erlotinib)被批准用于接受至少一次化疗方案后病情恶化的晚期非小细胞肺癌患者。先前的研究数据显示厄洛替尼(Erlotinib)与安慰剂相比可提高两个月的生存。而后续分析显示,厄洛替尼(Erlotinib)还能改善患者的生活质量,减少疼痛和改善身体功能。2004 年是罗氏风光的一年,除了厄洛替尼(Erlotinib),FDA 批准的首个 "抗血管生成 "药物贝伐珠单抗(Bevacizumab)同样来自于罗氏。被称为抗血管生成药物的贝伐珠单抗(Bevacizumab)是新一代靶向药,它通过阻断肿瘤生长所需的血管生长来攻击癌症。2004 年它首次被批准用于治疗结直肠癌,此后也成为晚期肺癌、卵巢癌和肾癌以及某些脑瘤患者的重要治疗手段。此外,阿扎胞苷(Azacitidine)在这一年获准用于治疗骨髓增生异常综合征,作为一款表观遗传学药物,阿扎胞苷(Azacitidine)在低剂量时能够通过与 DNA 甲基化酶 DNMT 蛋白家族形成共价键抑制其酶活性,使细胞的 DNA 甲基化水平降低。阿扎胞苷(Azacitidine)的一种脱氧类似物地西他滨(Decitabine)在 2006 年同样获批。
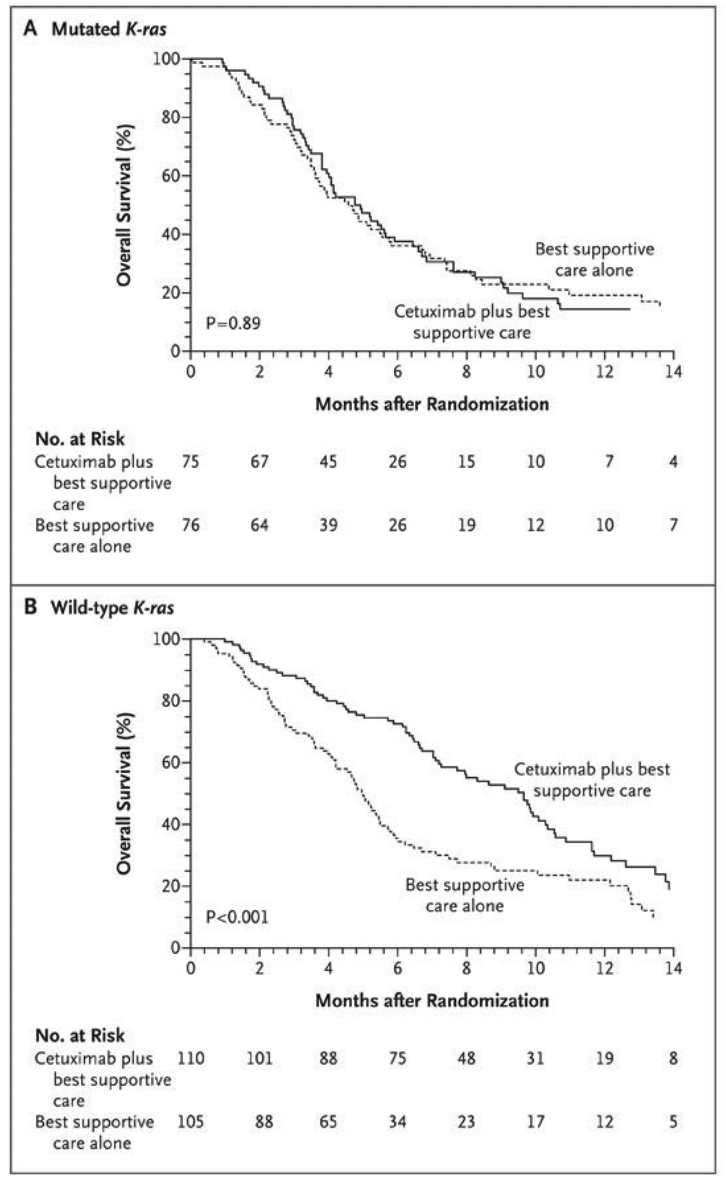
从 2005 年开始,靶向药物开始逐渐走上更多癌种治疗的历史舞台。但聊靶向药之前,还有一件事情不得不提。2005 年 2 月,为了全面了解导致所有主要癌症的基因组变化,美国国家癌症咨询委员会下设的生物医学技术工作组,建议启动一个「人类癌症基因组计划」(Human Cancer Genome Project)。到了 6 月,美国国家癌症研究所和国家人类基因组研究所举办了题为「癌症的全面基因组分析」的研讨会,共同讨论如何实施人类癌症基因组计划的试点阶段。12 月 NIH 就启动了为期三年、耗资 1 亿美元的「癌症基因组图谱」试点项目。这就是后来在某些层面帮助了大量研究生博士生毕业的 TCGA。伴随着 TCGA 项目启动,2005 年,厄洛替尼(Erlotinib)成为首个获准用于治疗胰腺癌的靶向药物。一项重要的临床试验发现与单独使用吉西他滨(Gemcitabine)化疗相比,将靶向药物厄洛替尼(Erlotinib) (Tarceva) 加入标准的吉西他滨(Gemcitabine)化疗能延长无法手术的胰腺癌患者寿命。这是自近十年前吉西他滨(Gemcitabine)问世以来,首次发现晚期胰腺癌患者使用新药存在生存益处的试验。索拉非尼(Sorafenib)则在 12 月批准用于肾癌治疗,因为研究表明它能延缓晚期肾细胞癌患者的肿瘤进展。西妥昔单抗(Cetuximab)和帕尼单抗(Panitumumab)也被批准用于治疗转移性结肠癌,他们同样是对抗表皮生长因子受体(EGFR)的单克隆抗体。不过后来的多项研究分析表明,西妥昔单抗(Cetuximab)和帕尼单抗(Panitumumab)只对 KRAS 野生型的患者有效,这一发现有助于医生确保药物只用于那些能够受益的患者,同时为不会受益的患者减少不必要的治疗和费用。
2006 年和 2007 年,在肾癌治疗领域舒尼替尼(Sunitinib)和另一种靶向药物 Temsirolimus 相继被 FDA 批准,研究表明前者与以前的标准治疗方法干扰素相比能够减慢疾病进展,而后者作为 mTOR 抑制剂可以将晚期肾癌患者的中位总生存期延长 3 个月以上。这两年,在针对已有靶向药耐药的问题上,达沙替尼(Dasatinib)被证实可以帮助对伊马替尼 (Imatinib) 耐药的 CML 患者并随后进入一线治疗的行列;拉帕替尼(Lapatinib)被批准与卡培他滨联合用于肿瘤 HER2 过表达的晚期乳腺癌患者,可以减缓对曲妥珠单抗(Trastuzumab)耐药肿瘤的疾病进展,等到 2010 年又被批准与芳香化酶抑制剂来曲唑联合作为 HER2 阳性患者的首选疗法。2007 年,贝伐珠单抗(Bevacizumab)适应症也向前迈进了一步。两项早期试验表明,单独或与化疗药物伊立替康连用,贝伐珠单抗(Bevacizumab)可能会使治疗后病情进展的胶质母细胞瘤患者的肿瘤缩小。基于这些发现,FDA 对贝伐珠单抗(Bevacizumab)治疗胶质母细胞瘤给予加速批准,使其成为十年来第一个被批准用于治疗脑瘤的新药。而此后很多年,贝伐珠单抗(Bevacizumab)也开启了各种联合用药之路。
2008 年,因为可以延迟肿瘤生长,贝伐珠单抗(Bevacizumab)又被 FDA 加速批准与紫杉醇联合治疗新诊断的晚期乳腺癌患者。然而,后来的长期研究显示贝伐珠单抗(Bevacizumab)并不能延长生存期。关于这种药物用于乳腺癌的争论仍在继续,尽管它在治疗其他常见癌症,如肺癌和结直肠癌方面有既定作用。这一年,普拉曲沙(Pralatrexate)成为首个获批专门用于 T 细胞淋巴瘤治疗的药物,一项研究显示它可以使近三分之一常规治疗后仍然存在或复发的外周 T 细胞淋巴瘤患者的肿瘤缩小,研究中超过 10%患者的肿瘤完全消失了。随后,FDA 加速批准其用于复发或对其他化疗反应不佳的外周 T 细胞淋巴瘤,这是第一个被专门批准用于治疗 T 细胞淋巴瘤的药物。与此同时,除了药物本身的研发,实验室技术的最新进展使得利用简单的血液样本检测已经脱离肿瘤的癌细胞(称为循环肿瘤细胞)成为可能。同样在 2008 年,发表于新英格兰医学的一项表明,跟踪这些循环肿瘤细胞的数量有助于评估非小细胞肺癌患者对治疗的反应。尽管彼时使用的检测方法是 PCR,但这种治疗过程中使用血液检测进行动态监控的方法将在 10 年之后大放异彩。
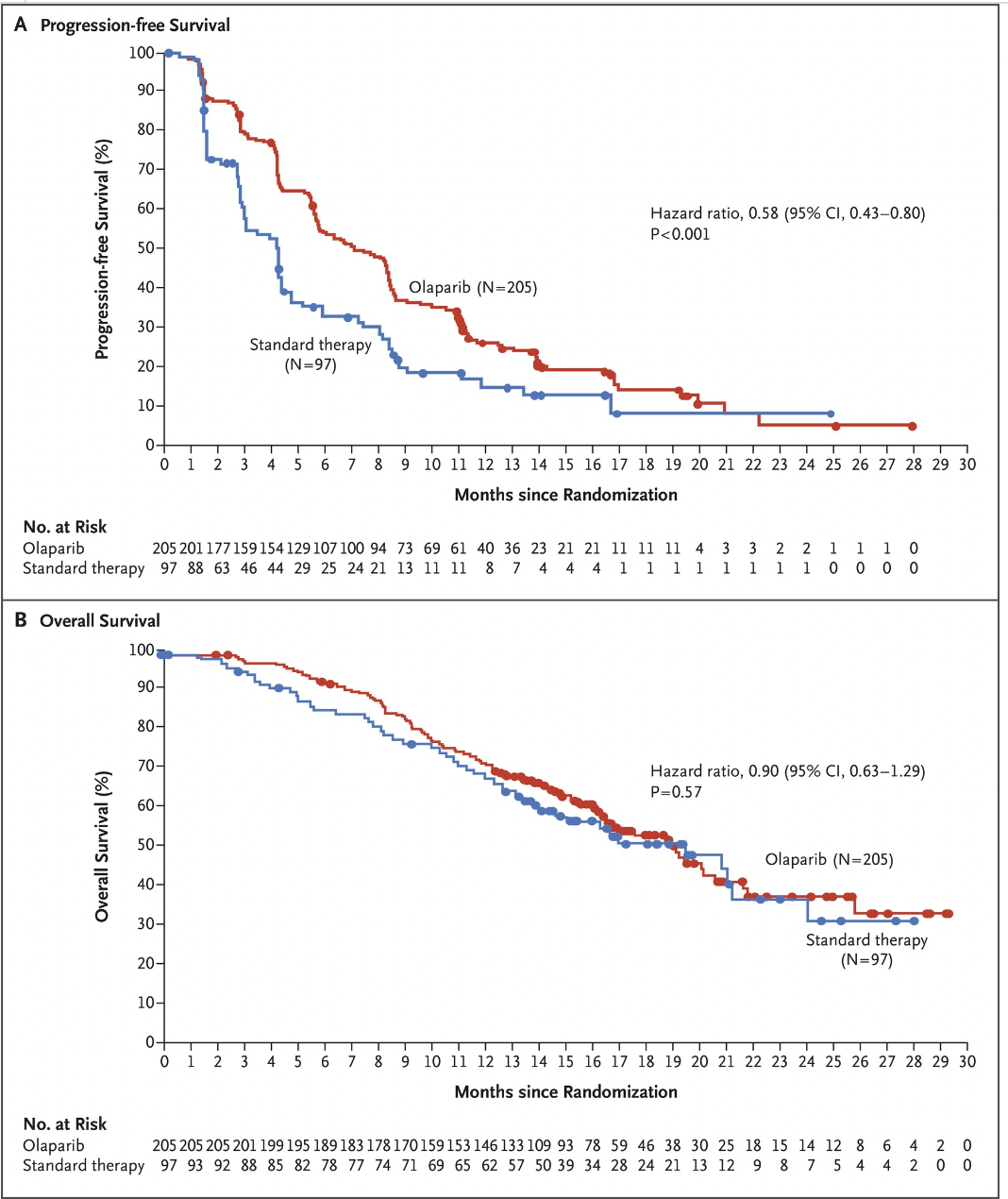
2009 年之前,我们看到值得纪念的里程碑大多数是少数几个药物在不同癌种或者条件下的应用突破。但 2009 年的 ASCO 大会,研究人员分享了一类新型靶向药物首个令人鼓舞的发现,代号为 AZD2281 的药物适用于难以治疗的 "三阴性 "乳腺癌和那些涉及到 BRCA1 BRCA2 基因突变的乳腺癌。这类药物就是如今我们所知的 PARP 抑制剂,而 AZD2281 的中文名字叫做奥拉帕利(Olaparib)。PARP 抑制剂旨在使癌细胞用于修复 DNA 损伤的关键酶失效并促使癌细胞死亡。它们还可能使癌细胞对其他治疗如化疗药物更加敏感。当然,彼时还需要进一步长期随机临床试验来确定 PARP 抑制剂是否真正有益于乳腺癌患者,如果是的话,哪些特定类型的乳腺肿瘤最有可能对该药物产生反应呢?其它癌种效果如何?这些都是以后的故事。
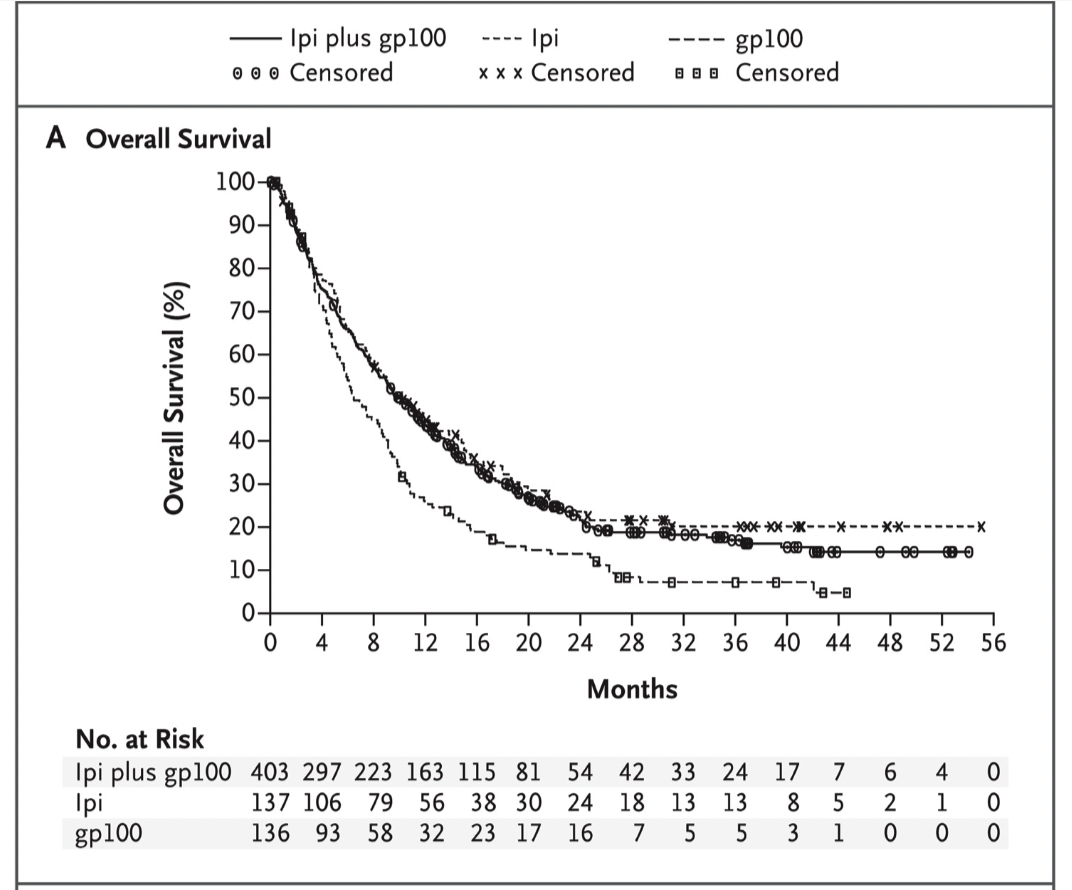
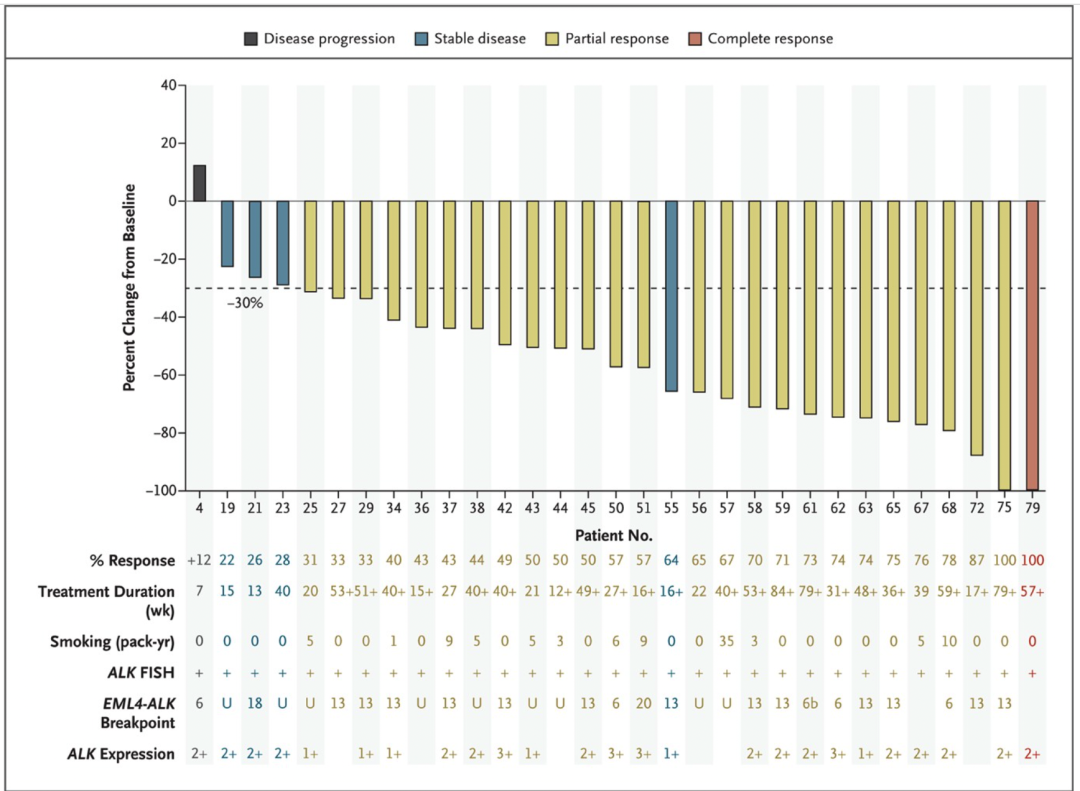
时间来到 2010 年,从 2010 年开始靶向药物抗击肿瘤的里程碑逐渐增多。旧的明星药物继续在其它领域开疆拓土,用于后线治疗的药物慢慢上位,新的靶点药物也在这一年问世。大约 80%的转移性乳腺癌妇女经历了癌症扩散到骨骼,这种并发症会导致疼痛、骨骼变弱和其他影响生活质量的副作用。2010 年,一项大型研究显示名为地舒单抗(Denosumab)的靶向药物可以预防或明显推迟骨转移。达沙替尼(Dasatinib)和尼罗替尼(Nilotinib)用于慢性骨髓性白血病的一线治疗可能比当时的标准药物伊马替尼 (Imatinib) 更有效,尽管这三种药物针对的都是 「费城染色体」上相同的活性遗传途径,但研究表明较新的药物可能会引起更快、更强的反应,并且比伊马替尼 (Imatinib) 引起的副作用更少。一项大型长期试验确定,在标准药物氟达拉滨的初始治疗中加入靶向药物利妥昔单抗(Rituximab)可以减缓慢性淋巴细胞白血病的进展并改善患者生存。这是有史以来发现的第一个能明显延长该疾病患者生命的药物治疗方案。试验发现,超过 10%的接受这种方案治疗的病人在十年后没有出现疾病进展。这一年的 ASCO 大会报道了一项研究,在一线化疗中加入靶向药物贝伐珠单抗(Bevacizumab),然后将其作长期的 "维持 "疗法,可以显著减缓卵巢和周围组织中患有癌症的妇女的疾病扩散速度。对于新药,在一项 III 期研究中发现 BMS 研发的靶向药物伊匹木单抗(Ipilimumab)能够改善晚期黑色素瘤患者的生存期,并延迟疾病进展。该药物在 2011 年初被 FDA 批准。不久之后,第二个试验发现,与单独使用化疗相比使用伊匹木单抗(Ipilimumab)联合化疗的组合治疗也延长了患者生存期。伊匹木单抗(Ipilimumab)是靶向 CTLA-4 的单克隆抗体,可促进 T 细胞活化及其随后的抗肿瘤免疫作用,日后其它不少免疫相关药物也都不约而同选择在黑色素瘤中和大家见面。这一年的另一个重头戏,来自于针对钻石突变 ALK 的药物出现。间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)融合基因是非小细胞肺癌的驱动基因,其发生率 3%-7%,在从未吸烟的患者中更为常见。EML4 和 ALK 两个基因分别位于 2 号染色体的 p21 和 p23。两个基因片段的倒位融合能够使得组织表达新的融合蛋白 EML4-ALK,这种融合基因又能导致肿瘤发生。之所以被称为钻石突变,是后来研究发现具有这类突变的患者使用靶向药物后疗效往往都比较好。克唑替尼(Ceritinib)就是由辉瑞研发的一款 ALK 抑制剂。在 2010 年发表于新英格兰医学的研究数据显示,在有 ALK 基因异常的癌症患者中有很高比例肿瘤会缩小。2011 年,根据长期实验数据,该药物被 FDA 批准用于肿瘤携带 ALK 基因突变的晚期肺癌患者。
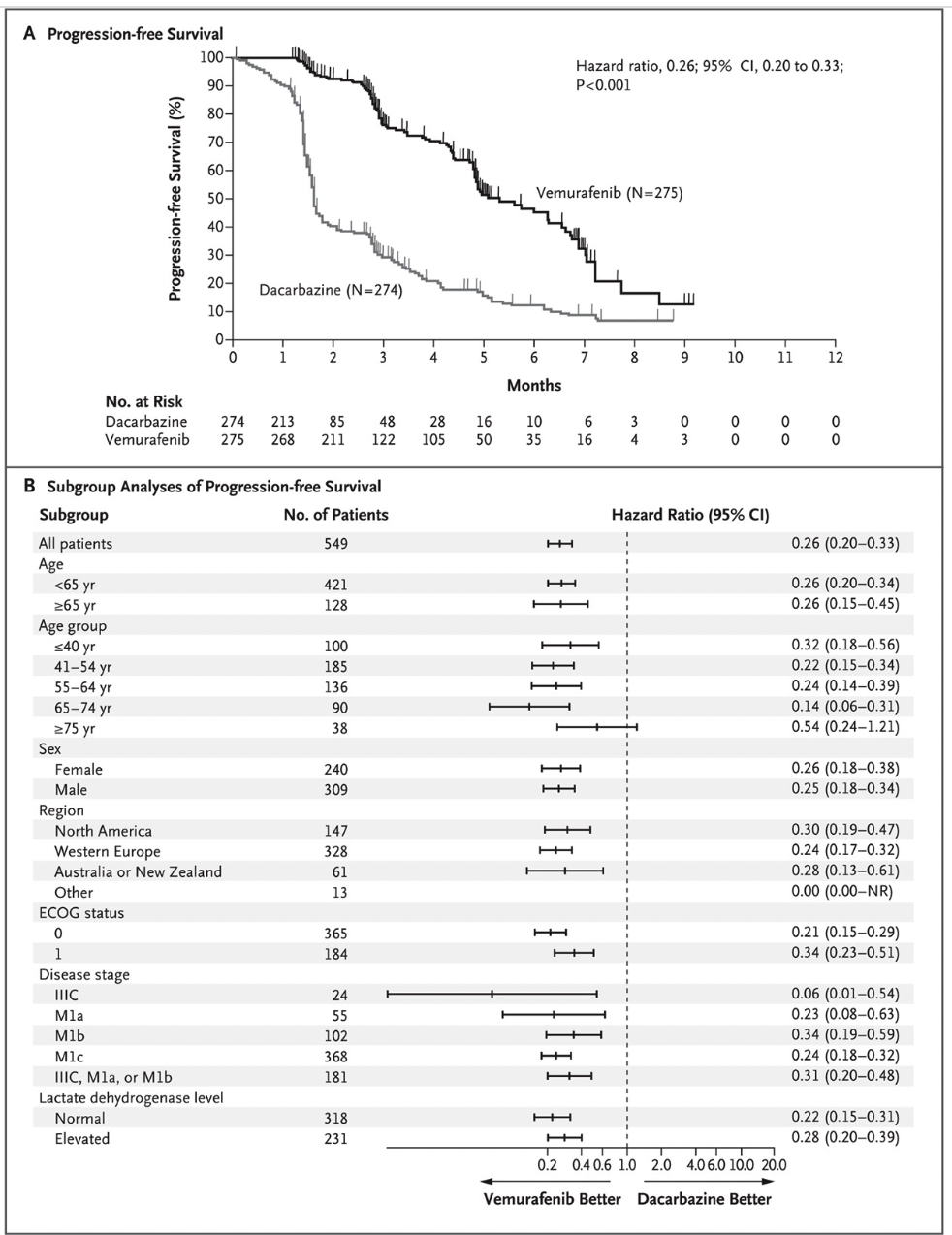
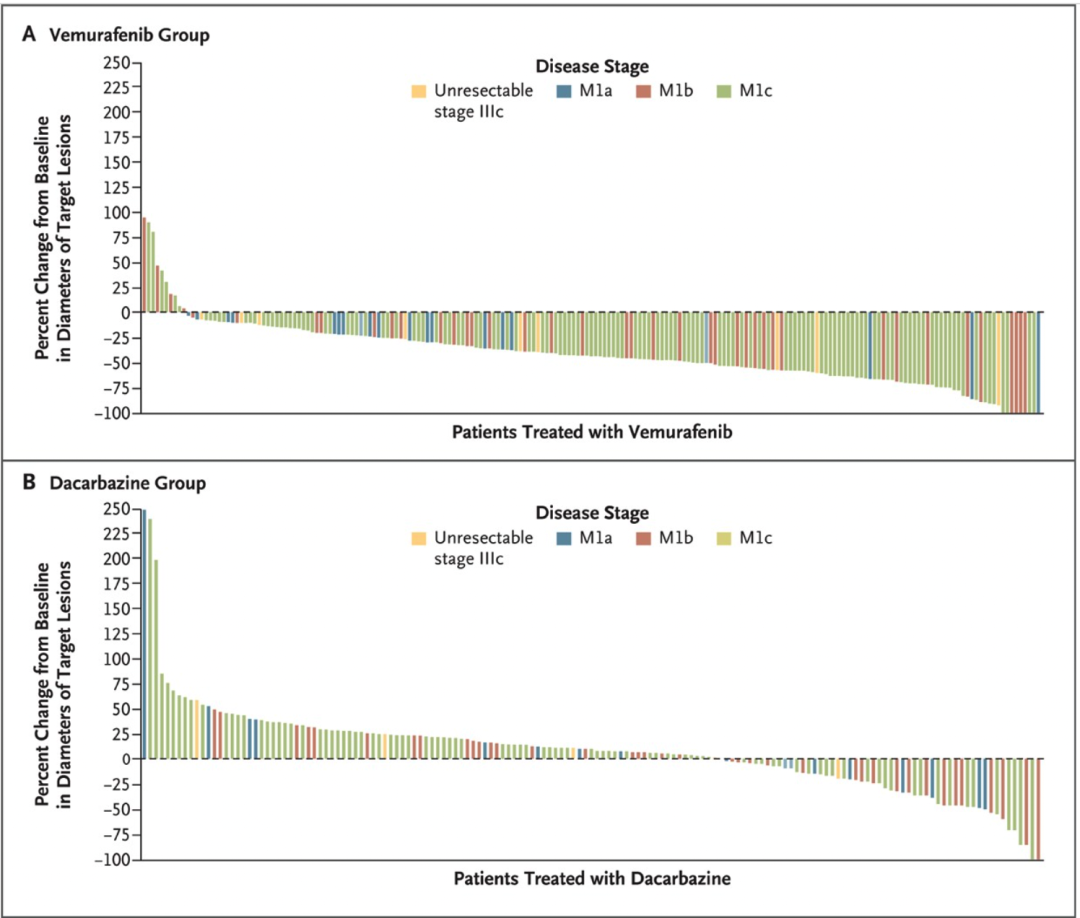
2011 年,FDA 批准了靶向药物维罗非尼(Vemurafenib),对于 BRAF 基因中存在特定突变的患者而言,数据显示该药物可以缩小肿瘤并提高晚期黑色素瘤患者的生存率。在许多情况下,患者开始这种治疗的几天内就会出现疼痛的大幅减少和肿瘤缩小。不过似乎癌症通常在几个月后又会停止对这种新型药物的反应。维罗非尼在黑色素瘤细胞系中可以引起程序性细胞凋亡。如果 BRAF 具有 V600E 突变,维罗非尼会中断 BRAF/MEK/ERK 通路上的 BRAF/MEK 步骤。至于 Plexxikon 和 Genentech ,作为共同研发这款药背后的两家公司,后者于 2009 年已经被罗氏收购,前者则在 2011 年 4 月被日本制药公司第一三共 (Daiichi Sankyo) 收购。
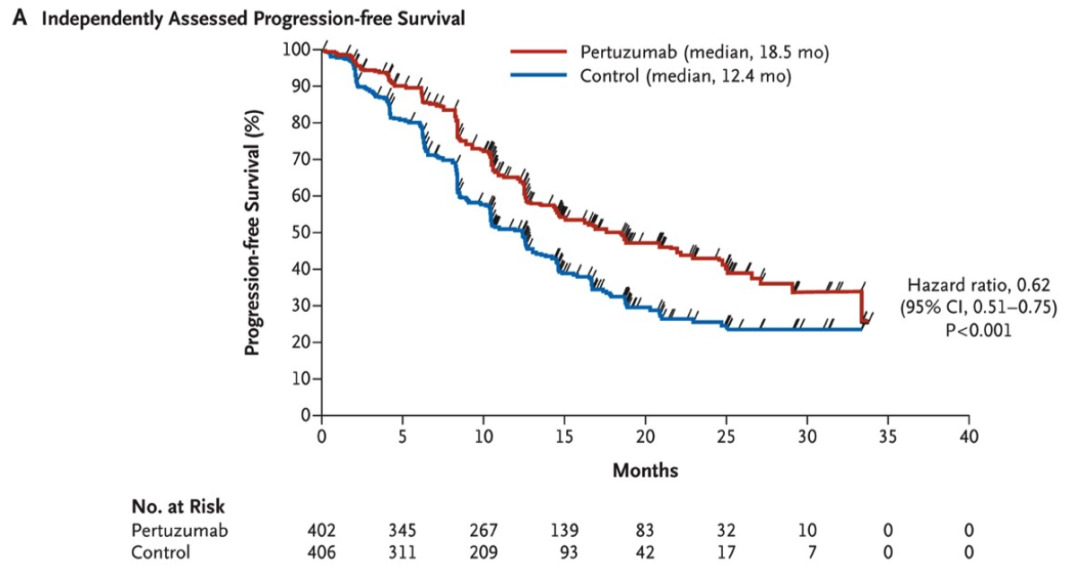
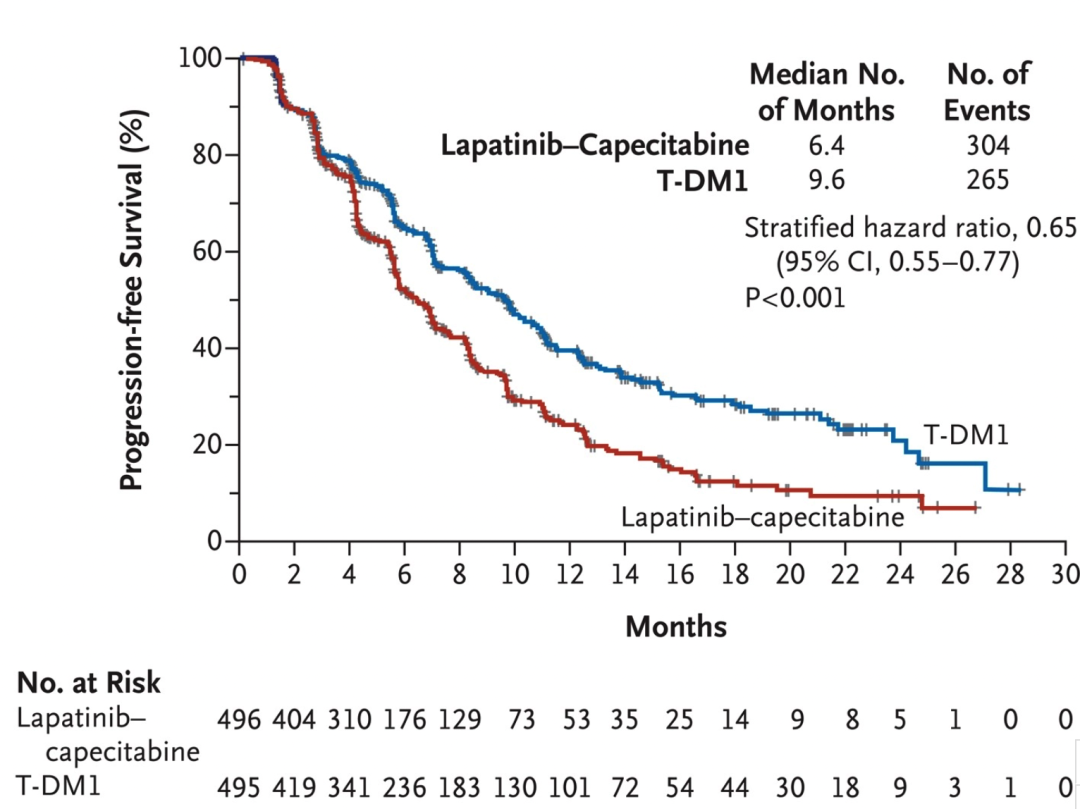
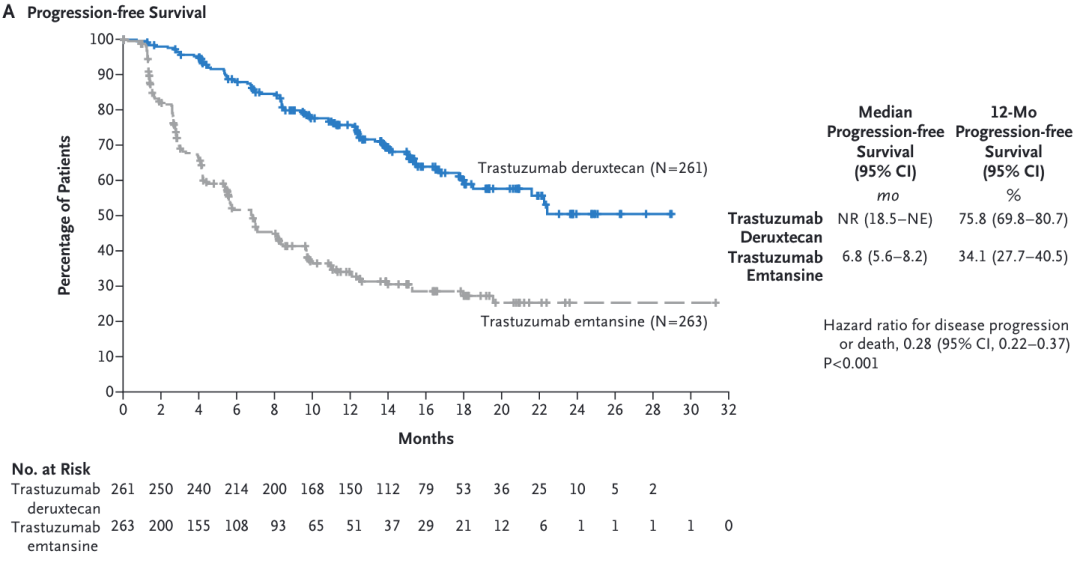
要在 2012 年挑一个癌种来讲,那应该是 HER2 阳性乳腺癌。同样在新英格兰医学杂志,2012 年初和 2012 年末先后发表了两项 HER2 阳性的乳腺癌研究。在 2012 年初的研究结果中显示,培妥珠单抗(Pertuzumab)和曲妥珠单抗(Trastuzumab)两种针对 HER2 的药物与标准化疗一起进行治疗,可大幅减缓晚期 HER2 过表达的乳腺癌肿瘤生长速度。这项研究的另一个意义在于为探索将两种或更多针对相同分子途径的药物结合的研究增添了新的思路和信心。2012 年 11 月发表的文章又将开启一个新的靶向药物时代。恩美曲妥珠单抗(T-DM1)是一种抗体-药物偶联物,兼有曲妥珠单抗(Trastuzumab)靶向 HER2 抗肿瘤作用和微管抑制剂 DM1 的细胞毒性作用。抗体和细胞毒性药物通过稳定的连接物共价连接。该药物旨在与癌细胞上的 HER2 蛋白结合,并直接将这些药物输送到肿瘤中,最大限度地减少对体内健康组织的不良影响。在一项研究中,将曾接受曲妥珠单抗(Trastuzumab)和紫杉醇治疗的 HER2 阳性晚期乳腺癌患者随机分配到 T-DM1 组和拉帕替尼(Lapatinib)联合卡培他滨组。T-DM1 组的中位无进展生存期为 9.6 个月,拉帕替尼(Lapatinib)联合卡培他滨组为 6.4 个月,且 T-DM1 组的客观有效率较高(43.6%对拉帕替尼联合卡培他滨组的 30.8%;P<0.001)。基于此,FDA 在 2013 年批准了 Genentech 研发的 T-DM1 用于晚期 HER2 阳性乳腺癌,而 9 年之后的 2022 年,第一三共和阿斯利康共同研发推广的 ADC 药物 T-DXd(Enhertu) 通过 DESTINY-Breast03 研究狂虐 T-DM1 又是另外一个新的故事。
如果说 2012 年是乳腺癌备受关注的一年,那么到了 2014 年黑色素瘤又一次重新走到了前端。2014 年也是 PD-L1 和 PD-1 抑制剂正式走上历史舞台的一年,FDA 批准了帕博利珠单抗(Pembrolizumab)和纳武利尤单抗(Nivolumab)两种免疫疗法治疗黑色素瘤,也加速批准了曲美替尼(Trametinib)和达拉非尼(Dabrafenib)对携带某些 BRAF 基因突变的晚期或无法手术的黑色素瘤患者进行联合治疗。2014 年 11 月,新英格兰医学发表了一项 BRAF 抑制剂和 MEK 抑制剂联用与单独使用 BRAF 抑制剂治疗黑色素瘤的比较研究,研究表明新方案能使大多数患者获得持久的反应。2014 年 7 月的柳叶刀杂志,一项被称为 KEYNOTE-001 研究中的黑色素瘤相关结果发表,对于伊匹木单抗(Ipilimumab)治疗后进展的晚期黑色素瘤患者接受默沙东的帕博利珠单抗(Pembrolizumab)治疗表现出了一定的效果,ORR 为 26%。这对于那些几乎没有有效治疗选择的患者来说可能是一种有效的方法。帕博利珠单抗(Pembrolizumab)作为一种「免疫检查点抑制剂」,通过阻断名为 PD-1 的途径发挥作用,该途径可以阻止身体的免疫系统攻击癌细胞。同样也是免疫检查点抑制剂的纳武利尤单抗(Nivolumab)由 BMS 研发,在 2014 年和 2015 年先后发表了多篇文章。研究结果显示其可以在服用伊匹木单抗(Ipilimumab)和 BRAF 抑制剂后病情恶化的黑色素瘤患者中产生持久反应。对于没有 BRAF 突变的转移性黑色素瘤患者中,纳武利尤单抗(Nivolumab)与化疗相比,在总体存活率和无进展存活率方面有显著改善。
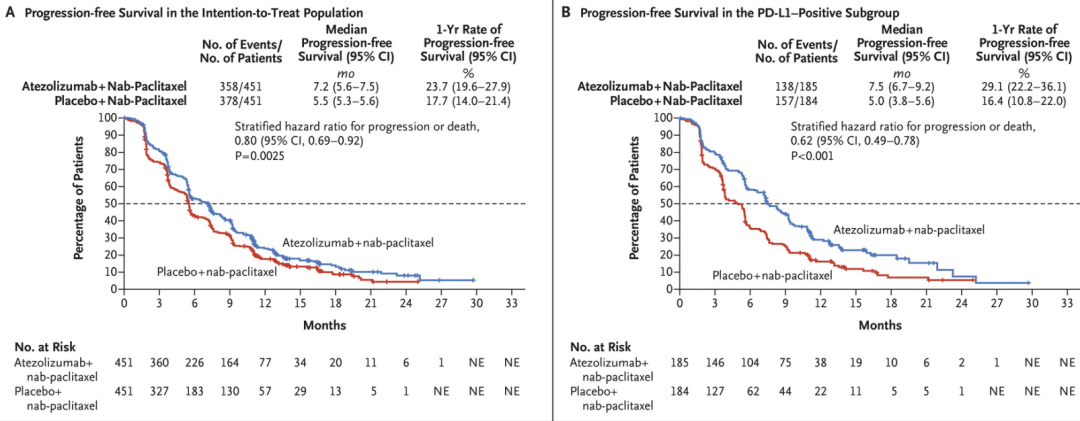
帕博利珠单抗(Pembrolizumab)和纳武利尤单抗(Nivolumab)的比赛,在 2014 年的黑色素瘤治疗中仅是一个开端。之后的三年时间,他们在不同癌种里的治疗竞赛全面展开,也彻底打开了肿瘤免疫检查点抑制剂的时代。当然,紧随其后入局的还有罗氏研发的 PD-L1 抑制剂阿替利珠单抗(Atezolizumab)。2015 年到 2017 年这三年时间,上述三种免疫疗法被 FDA 批准用于化疗恶化的晚期非小细胞肺癌患者,纳武利尤单抗(Nivolumab)获批用于晚期肾细胞癌患者。越来越多的研究表明,对于标准治疗没有反应的霍奇金淋巴瘤患者,使用 PD-1 抑制剂的免疫疗法也可以带来明显的好处,可以使以前接受过许多癌症治疗的患者得到缓解,这使得 FDA 分别在 2016 年和 2017 年对这两种药物的适应症给予加速批准。BMS 眼看自己的伊匹木单抗(Ipilimumab)在免疫治疗道路上被后来的三个弟弟围起来打,就又开辟了另外一种新的免疫治疗角度。在 2015 年和 2016 年先后发表都结果证明术后使用伊匹木单抗(Ipilimumab)辅助治疗可以降低早期黑色素瘤的复发风险并延长生存时间。这也标志着首次研究显示伊匹木单抗(Ipilimumab)对早期黑色素瘤的有效性。除了对一部分患者进行无差别的治疗外,2016 年的研究发现,对于晚期非小细胞肺癌中表达高水平 PD-L1 蛋白的患者来说,帕博利珠单抗(Pembrolizumab)可以提高生存率并比标准化疗引起的副作用更少。此后,这一研究为这种类型的肺癌建立了新的治疗模式,免疫疗法成为 PD-L1 阳性的首选疗法。同样在 2016 年,一项早期临床试验中,阿替利珠单抗(Atezolizumab)迅速缩小了先前接受治疗的晚期尿路上皮癌患者的肿瘤,特别是 PD-L1 含量高的患者。基于此 FDA 批准阿替利珠单抗(Atezolizumab)用于治疗晚期尿路上皮癌,成为 30 年来第一个新的膀胱癌治疗方法。虽说这三年抗击肿瘤都里程碑多数都来自免疫,但仍旧有一类新的乳腺癌治疗方法在此期间问世,那就是细胞周期蛋白依赖性激酶 (CDK) 抑制剂。哌柏西利(Palbociclib)作为CDK抑制剂的首个药物,能阻止控制细胞分裂的关键蛋白。在临床试验中,标准激素疗法中加入哌柏西利(Palbociclib),将癌症恶化的时间在初治患者中延长了 11 个月,对于以前接受过治疗的患者则延长了约 5 个月。2015年,FDA加速批准哌柏西利(Palbociclib)联合来曲唑作为作为一线治疗用于激素受体阳性和 HER2 阴性的晚期乳腺癌患者。2016年,FDA加速批准哌柏西利(Palbociclib)与氟维司群用于治疗激素治疗后病情恶化的晚期乳腺癌。阿贝西利(Abemaciclib)作为另一种CDK4/6抑制剂,2017年被批准为第一个用于先前接受内分泌治疗和化疗转移性患者的CDK4/6抑制剂单药治疗。
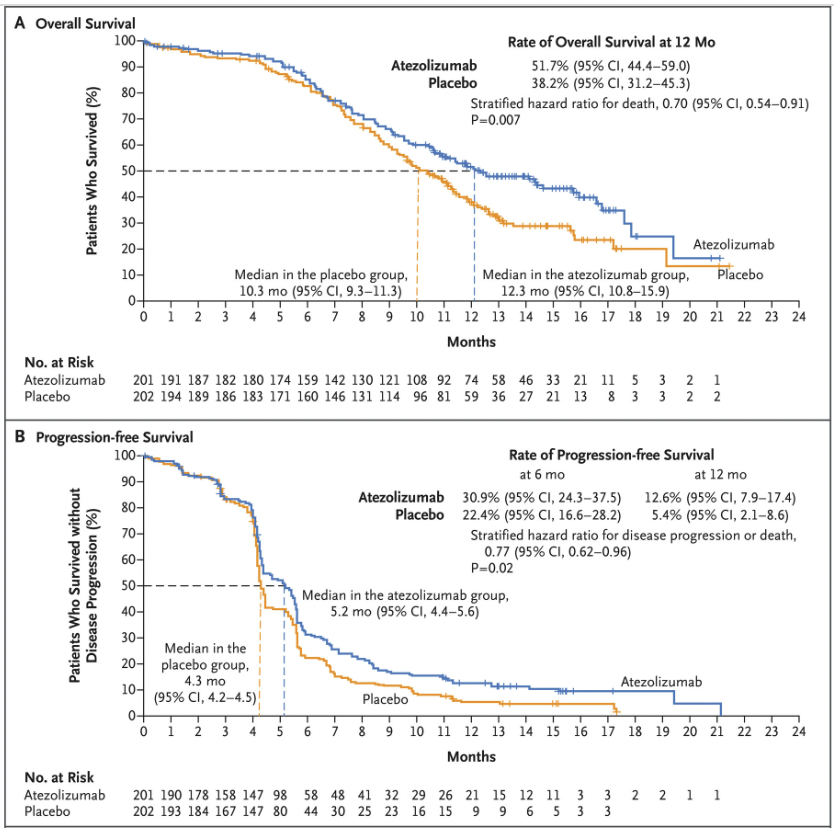
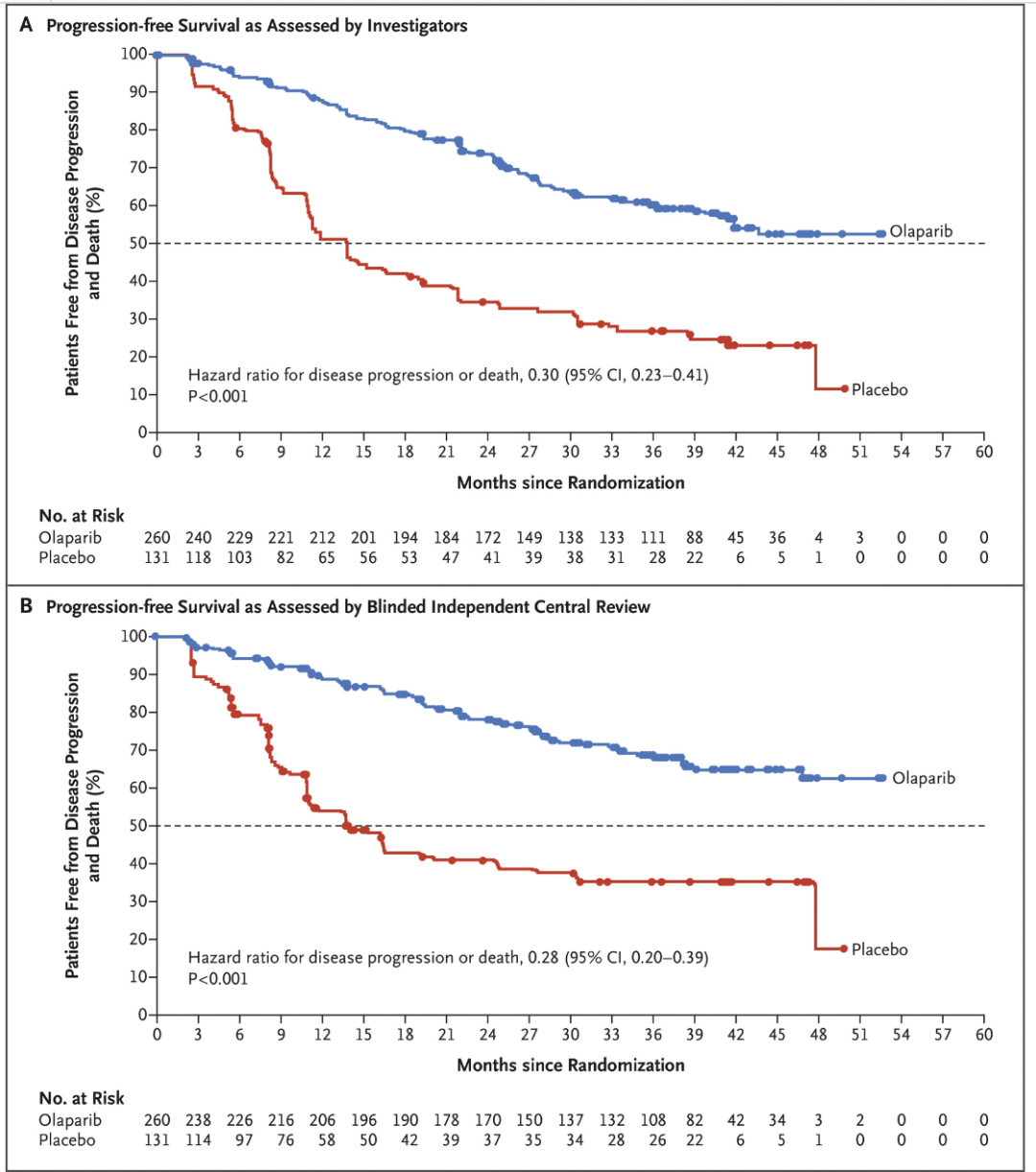
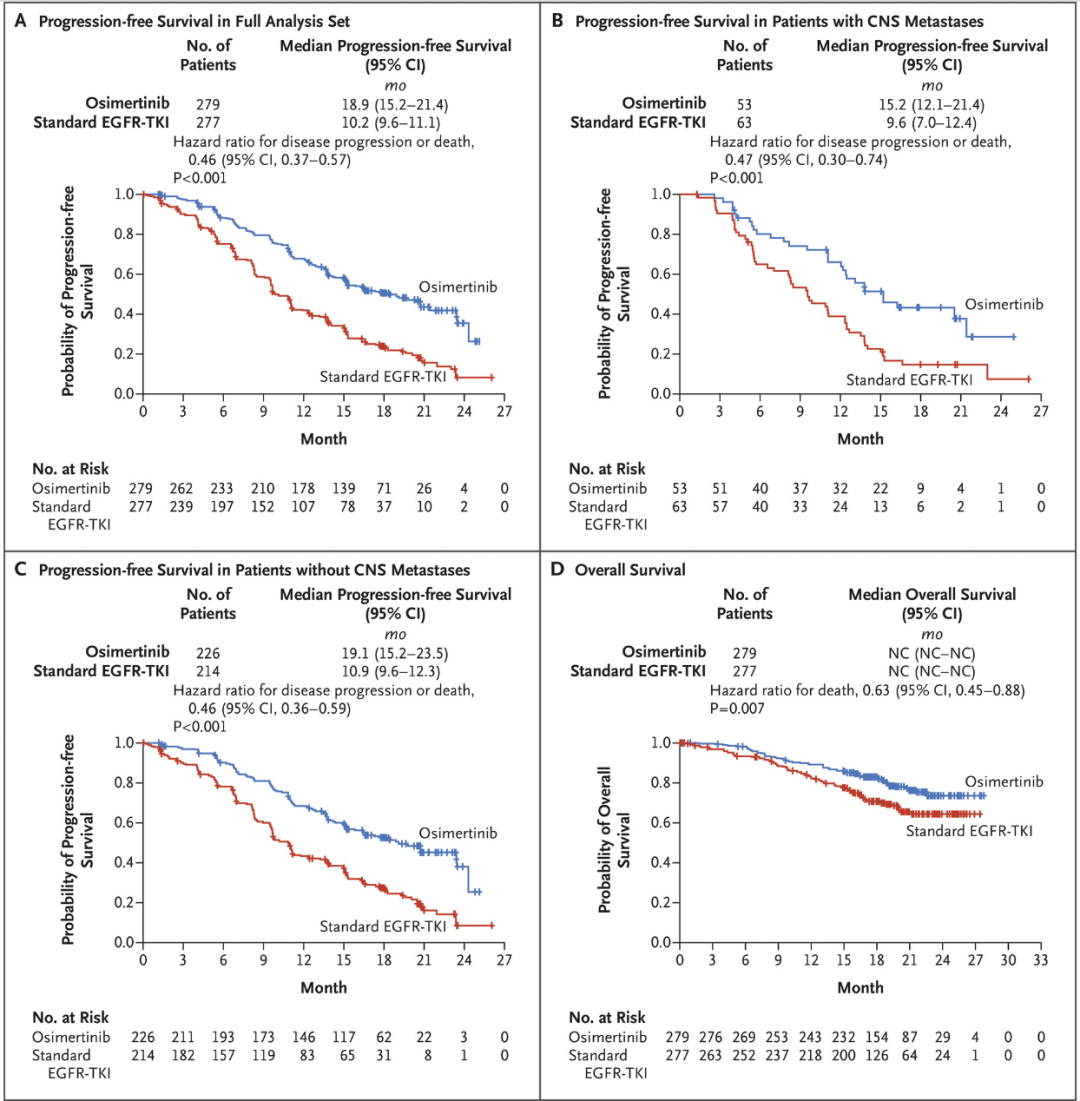
时间来到 2018 年,肿瘤靶向治疗历史中的里程碑大年,这一样在多个癌种中的多种药物都有重大突破。首先是免疫治疗领域。罗氏的阿替利珠单抗(Atezolizumab)为了应对 O 药和 K 药,开始在免疫联合治疗以及一些难治性肿瘤中发力。2018 年发表的 IMpassion 130 试验结果中,表达 PD-L1 的肿瘤患者在接受联合治疗时无进展生存期得到了改善。阿替利珠单抗(Atezolizumab)联合化疗不仅成为了第一个被批准用于乳腺癌的免疫疗法,也是对预后极差的晚期三阴性乳腺癌患者的一个重要进展。同样 2018 年发表,IMpower 133 的实验结果显示化疗基础上加用阿替利珠单抗(Atezolizumab),小细胞肺癌生存期明显延长。这种联合疗法于 2019 年被 FDA 批准,已成为小细胞肺癌的标准疗法。接下来是我们在 2009 年就曾提到的 PARP 抑制剂。2017 年一项针对晚期 BRCA 基因胚系突变相关的乳腺癌临床试验显示,与标准化疗相比,PARP 抑制剂奥拉帕利(Olaparib)能降低癌症进展风险且副作用更少。大约 5% 未经选择的乳腺癌患者携带胚系 BRCA 突变。基于这些数据,2018 年初奥拉帕利(Olaparib)被 FDA 批准用于这一用途,也标志着首次有药物被批准用于治疗有胚系 BRCA 基因突变的转移性乳腺癌患者。除了在乳腺癌里的应用,奥拉帕利(Olaparib)在新诊断晚期卵巢癌患者的维持治疗中也有了新的突破。一项名为 SOLO 1 的三期试验在 2018 年底发表,结果说明患有新诊断的晚期 BRCA 突变卵巢癌患者,手术和化疗后接受 PARP 抑制剂奥拉帕利(Olaparib)的维持治疗与不接受维持治疗相比,疾病进展或死亡风险降低了 70%。这些结果不仅使 FDA 批准了奥拉帕利(Olaparib)用于这一适应症,而且代表着在治疗这种类型的癌症患者方面又向前迈出了一大步。还记得 2004 年获批的厄洛替尼(Erlotinib)么?随后的 14 年时间里,EGFR-TKI 药物有了巨大发展。因为各种耐药情况的出现,已从一代走到三代,2018 年奥希替尼(Osimertinib)登场。由阿斯利康开发的奥希替尼(Osimertinib)是一种口服第三代 EGFR-TKI,它可选择性地抑制 EGFR T790M 耐药突变。在 FLAURA 试验中,奥希替尼(Osimertinib)与两种标准的 EGFR-TKIs 相比,对以前未治疗的 EGFR 突变阳性晚期非小细胞肺癌患者的无进展生存期延长了近 80%,中位无进展生存期为 18.9 个月,疾病进展或死亡的风险比标准组低 54%。在 AURA3 试验中,与化疗相比奥希替尼(Osimertinib)也改善了患者的生活质量。基于这些研究,奥希替尼(Osimertinib)在 2018 年被批准用于一线治疗转移性非小细胞肺癌且存在 EGFR 19del 或 21 号外显子 L858R 突变的患者。同时,它也成为确诊 EGFR T790M 阳性患者的新标准一线疗法,这些患者往往在使用其他 EGFR-TKIs 一线治疗后耐药并复发。最后,还是 2018 年,一种名为拉罗替尼(Larotrectinib)的新药在两项临床试验中表现出了积极的结果。拉罗替尼(Larotrectinib)可以择性地针对存在于各种实体瘤中的一类基因组异常 NTRK 融合。这种异常在常见癌症的发生频率为 0.5%至 1%,但在某些罕见难治癌症中,如唾液腺癌、儿童乳腺癌和婴儿型纤维肉瘤,它的发生率可以高达 90%。一项早期临床试验中,拉罗替尼(Larotrectinib) 在包扩成人和儿童的多种类型的 NTRK 融合癌症中产生了强烈持久的效果。另一项只关注儿童癌症的实验中,发现该疗法几乎能使所有 NTRK 融合患者的肿瘤缩小。这也证明精准医学治疗可使儿童癌症患者受益。基于这些发现 FDA 加速批准拉罗替尼(Larotrectinib)用于患有 NTRK 融合的晚期或无法手术的实体瘤癌症患者。
2019 年,再来关注一下 CDK4/6 抑制剂药物。瑞博西利(Ribociclib)作为一种另一种 CDK4/6 抑制剂药物,与内分泌疗法联合可以为晚期 HR+ HER2- 乳腺癌绝经前和围绝经期的患者带来总体生存获益。这一年发表的 MONALEESA-7 试验结果显示,瑞博西利(Ribociclib)的 42 个月生存率为 70.2%,而接受安慰剂加标准内分泌治疗的妇女仅为 46%。这种治疗组合对于治疗患有这种疾病的年轻女性是一个重要步骤,因为她们的肿瘤往往更具侵略性,生存率比绝经后的患者更差。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。














发表评论
注册或登后即可发表评论
登录注册
全部评论(0)