2022-10-18 来源 : 学术查
糖基化(glycosylation)
糖基化是一种非常重要蛋白质翻译后修饰,其中O-GlcNAcylation是指在细胞内蛋白质的丝氨酸和/或苏氨酸残基上添加单糖修饰,是真核生物中最普遍的糖基化形式,相关研究也最为深入。O-GlcNAc 转移酶 (OGT) 和O-GlcNAc 水解酶 (OGA)分别负责添加和去除O-GlcNAc修饰。O-GlcNAcylation通过对蛋白质稳定性、亚细胞定位、活性以及相互作用等方面进行调控,广泛参与调节关键的细胞生物学过程,包括基因转录、细胞周期进程、DNA修复、凋亡、病毒出芽和受体内吞,进而调控机体的生理、病理等细胞生物学过程。
近些年,关于蛋白质糖基化修饰的高质量研究论文不断发表,越来越多证据表明蛋白质糖基化修饰具有重要的生理病理功能。近几年的国家自然科学基金的资助项目中,蛋白质糖基化修饰的相关项目很多,是当前生命科学和基础医学研究的热点之一。

2021年糖基化修饰相关部分获资助项目
小编为大家整理了10篇蛋白质糖基化修饰相关的高分文章【接上期:2022年糖基化修饰的10种研究思路(上篇)】,另附每篇文章的分子机制图和原文链接,有助于了解蛋白质糖基化修饰的研究思路,感兴趣的文章可跳转具体链接研读全文。
06
Cell Death And Differentiation (IF 12.0667) Pub Date: 2022-01
主要发现及分子机制:作者发现MORC2第556位苏氨酸被糖基化转移酶(O-GlcNAc transferase, OGT)催化形成糖基化(O-GlcNAcylation)修饰。该位点的突变或抑制 OGT会损害 MORC2 介导的体外乳腺癌细胞迁移和侵袭以及体内肺定植。此外,转化生长因子-β1 (TGF-β1)通过增强GFAT(glutamine-fructose-6-phosphate aminotransferase) 的稳定性来诱导MORC2 O-GlcNAcylation,GFAT是产生OGT糖供体的限速酶。糖基化修饰的MORC2是TGF-β1靶基因CTGF和SNAIL的转录激活所必需的。敲低GFAT、SNAIL 或 CTGF 的表达抑制了 TGF-β1 诱导的、MORC2 糖基化介导的乳腺癌细胞迁移和侵袭。临床上,乳腺肿瘤中 OGT、MORC2、SNAIL和CTGF的高表达与患者预后不良有关。本文研究成果揭示了MORC2 O-GlcNAcylation在乳腺癌进展中作用及机制,为通过阻断其 O-GlcNAcylation来靶向MORC2 依赖性乳腺癌提供了理论依据。
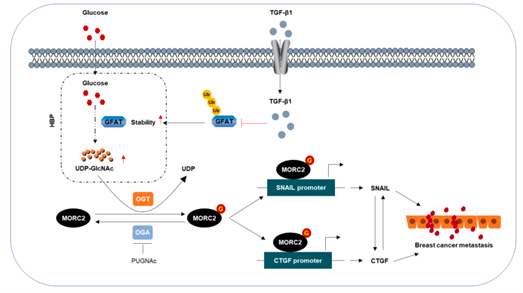
原文链接:https://www.nature.com/articles/s41418-021-00901-0
07
Molecular Psychiatry (IF 13.437) Pub Date: 2022-06
主要发现及分子机制:微管相关蛋白 tau 的过度磷酸化与多种神经退行性疾病有关,包括阿尔茨海默病 (Alzheimer’s Disease, AD),统称为tau蛋白病。然而,tau 与突触功能障碍和记忆障碍的联系尚不清楚。为了解决这个问题,作者构建了大脑SIRT1特异性敲除的小鼠模型(SIRT1 flox/Cre+ )。作者发现SIRT1 flox/Cre+小鼠脑中O-GlcNA酶(OGA) 减少和O-GlcNAc 转移酶(OGT)蛋白水平升高,从而触发tau的O-GlcNA增强,促进tau位点特异性磷酸化的增加。另外,小鼠大脑中SIRT1缺失改变了位点特异性磷酸化tau在突触体中的分布,造成树突棘缺陷和突触功能障碍,引起学习和记忆缺陷。本文为SIRT1作为临床tau蛋白病的潜在治疗靶点提供了理论依据。
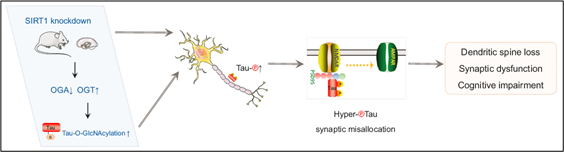
原文链接:https://doi.org/10.1038/s41380-022-01689-2
08
Bone Research (IF 13.362) Pub Date: 2022-06
主要发现及分子机制:作者证明破骨细胞生成需要糖基化修饰(O-GlcNAcylation)的动态变化。增加的O-GlcNAcylation在早期阶段促进破骨细胞分化,而其下调是破骨细胞成熟所必需的。在分子水平上,O-GlcNAcylation影响多种细胞信号通路,包括氧化磷酸化和细胞-细胞融合。TNFα通过促进O-GlcNAcylation的动态调控促进炎症性关节炎中的破骨细胞生成。药物或者基因靶向O-GlcNAc转移酶(OGT)或O-GlcNAcase (OGA)分别在分化早期和成熟后期阻止破骨细胞分化,并改善实验性关节炎的骨丢失。敲低O-GlcNAcylation的靶基因NUP153,具有与抑制OGT相似的作用,都可以抑制破骨细胞生成。这些发现凸显O-GlcNAcylation在破骨细胞生成中的重要作用,并可能为靶向干预病理性骨吸收提供潜在的治疗方法。

09
Nature Chemical Biology (IF 16.174) Pub Date: 2021-12
主要发现及分子机制:作者发现eIF3a响应营养缺乏而经历动态糖基化修饰 (O-GlcNAcylation)。应激诱导的去O-GlcNAcylation修饰促进 eIF3 保留在伸长的核糖体上并促进激活转录因子4 ( activating transcription factor 4, ATF4) 重新启动。即使在营养丰富的条件下,通过 CRISPR 基因组编辑从eIF3a中突变修饰位点也会诱导 ATF4 重新启动。本研究结果阐述了一种平衡核糖体循环和再启动的机制,从而将营养应激反应和翻译重编程联系起来。
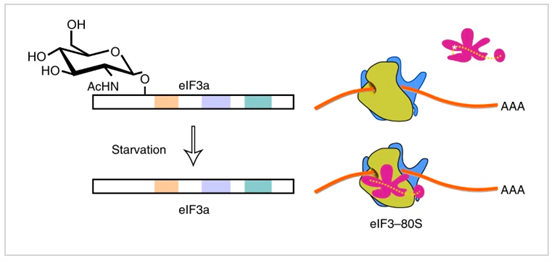
原文链接:https://www.nature.com/articles/s41589-021-00913-4
10
PNAS (IF 12.779) Pub Date: 2022-03
主要发现及分子机制:作者发现证明 糖基化修饰(O-GlcNAcylation)是 EGFR 细胞内运输和降解的重要调节因子。机制上,肝细胞生长因子调节的酪氨酸激酶底物 (HGS)是 EGFR 腔内分选途径中的关键蛋白,O-GlcNAcylation抑制HGS与信号转导衔接分子 (STAM) 的相互作用,从而破坏转运所需的内体分选复合物(ESCRT-0)的形成。此外,O-GlcNAcylation增加HGS糖基化并降低其蛋白稳定性。因此,HGS的O-GlcNAcylation抑制EGFR腔内分选和溶酶体降解,导致EGFR积累和细胞中延长的EGFR信号传导。此外,HGS 糖基化被证明可促进肿瘤生长和肝癌细胞的化疗耐受性。因此,本研究揭示了 O-GlcNAcylation在调节受体酪氨酸激酶内吞运输和信号传导中的作用。

2022年度国自然医学部国自然40大科研热点的中标数统计如下:
2022热点 | 2022中标数 | 2022热点 | 2022中标数 |
免疫调控 | 907 | 中性粒细胞 | 112 |
巨噬细胞 | 591 | 反馈回路 | 104 |
线粒体 | 491 | 乳酸化 | 104 |
血管功能 | 487 | 可变剪接 | 71 |
外泌体 | 470 | AI机器学习 | 67 |
自噬 | 404 | 类器官 | 67 |
铁死亡 | 337 | 炎症小体 | 62 |
干细胞 | 329 | 染色质重塑 | 58 |
代谢重编程 | 325 | 单细胞测序 | 54 |
m6A/m5C/m7G | 320 | 糖基化 | 50 |
泛素化 | 225 | 低氧缺氧 | 50 |
circRNA | 221 | 相分离 | 50 |
lncRNA | 204 | 泛凋亡PANoptosis | 42 |
细胞焦亡 | 175 | 细胞衰老 | 37 |
组蛋白 | 171 | 胞葬 | 33 |
肠道菌群 | 133 | CRISPR | 33 |
乙酰化 | 125 | 增强子 | 29 |
内质网 | 125 | 精氨酸甲基化 | 25 |
转录调控 | 112 | 迁移体 | 8 |
糖酵解 | 112 | 血管拟态 | 8 |
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)