2022-10-31 来源 : 闲谈 Immunology ,作者三花
IFN作为肿瘤免疫监控的重要组成,肿瘤对IFN感知(sensing)的丢失能够使大多数肿瘤对免疫检查抑制剂(ICB)敏感。IFNγ对肿瘤细胞的免疫激活活性,很大程度上归因于诱导肿瘤细胞MHC I类分子表达。

在对其具体通路的研究中发现:IFN可同时介导经典和非经典MHC I类抑制检查点来促进ICB耐药的免疫逃逸。
IFN介导免疫抑制的两种机制
在体内和体外筛选中,一些IFN敏感和影响抗原呈递的基因在体外产生T细胞杀伤耐药性,但在体内则会引起免疫原性反应。IFN和抗原呈递的缺失导致了对T细胞毒性的耐药性,从而增强了ICB反应。
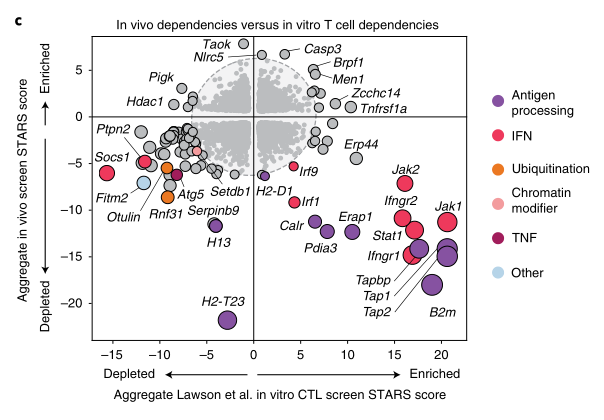
那么IFN是具体如何诱导这种免疫逃逸的呢?
RNA测序表明,H2-T23, B2m, Tap1, Tap2, Tapbp和Erap1等抗原递呈途径的基因在ISGs中富集,具有很强的体内免疫依赖性。IFNγ或IFNβ刺激后,经典MHC(如H-2K和H-2D)、非经典MHC(如Qa-1b)和PD-L1的表达增加。

在癌症基因图谱(TCGA)中筛选出6p21.3位点。该位点编码MHC I类表面表达的基本基因,包括抗原处理转运蛋白基因(TAP1、TAP2和TAPBP)和免疫蛋白酶体基因(PSMB8和PSMB9)。
许多癌症类型显示其6p21.3位点缺失超过10%、
接受抗pd -1治疗的透明细胞肾细胞癌(ccRCC)患者中,高ISG特征与6p21.3二组体肿瘤的低生存率相关
在黑色素瘤中,强烈的IFN信号与ICB反应不良相关。ICB免疫治疗的耐药性与肿瘤进展过程中IFN和IFN调节蛋白水平的升高有关。
▶ IFN介导CD4+ T细胞和NK细胞活性
在IFN缺失的情况下,ICB可以通过激活CD4+ T细胞和NK细胞(而不是CD8+ T细胞),消除IFN感知缺陷的肿瘤。
即使NK细胞延迟消耗,也不改变JAK1缺失肿瘤对ICB的耐药性。

ICB如何影响CD4+ T细胞和NK细胞:
传统NK细胞表达高水平的细胞毒分子、小群固有淋巴样细胞(ILCs)和NKT细胞。ILC和NKT细胞表达PD-1和CTLA-4,可被ICB直接激活。而传统NK细胞本身并不会对ICB产生直接效应。

表达PD-1、CTLA-4等ICB的CD4+ T细胞可能是通过产生共刺激或Th1细胞因子来增强了NK细胞介导的直接细胞毒性。
实际上,通过小鼠模型体内亚基因组筛选,多种IFN和MHC I类途径基因,包括Qa-1b,都依赖于NK细胞。
▶ IFN介导CD8+ T细胞免疫检查点
RNA测序的结果显示:小鼠H2-T23基因编码的非经典MHC I类分子Qa-1b是活性最高的。

Qa-1b/HLA-E:
Qa-1b是小鼠相对人体HLA-E的同源物。是通过结合抑制NKG2A/CD94受体以达到免疫逃逸的作用。
NKG2A在TME中的NK细胞和细胞毒性CD8+ T细胞上高表达。
它可以与CD94蛋白结合形成异源二聚体,配体结合以后激活NKG2A,激活细胞内的抑制性信号通路。
HLA-E是NKG2A/CD94受体的唯一配体,在许多癌症中经常上调。该轴在肿瘤微环境中免疫激活后作为获得性抵抗机制起作用。
有研究表示,NKG2A阻断剂作为独立疗法似乎效果一般,但是在诸如PD-1/PD-L1阻断或其他途径活化的T细胞存在时效果较好。

Clin Cancer Res 1 November 2020; 26 (21): 5549–5556.
不过,虽然NK细胞介导IFN感觉缺失细胞的杀伤,但其他MHC I类分子的表达,包括Qa-1b,可能存在其他的额外抑制效应群体:因为其抑制活性需要B6小鼠中H-2D1蛋白信号序列衍生的tap依赖肽(Qdm)的表达。而Tap1、Tap2或H2-D1等阻碍Qdm的基因丢失可能会造成Qa-1b活性增强。
研究显示:
NK细胞的减少对缺失Qa -1b的肿瘤治疗效果没有影响,但CD8+ T细胞的减少则完全抑制了抗PD-1药物的疗效。
大多数效应、衰竭和增殖的CD8+ T细胞上均表达NKG2A (Klrc1)和CD94 (Klrd1),它们共同表达细胞毒性和衰竭基因。CD8+ 效应T细胞中NKG2A的表达高于NK细胞。
无论在体外还是体内,过表达Qa -1b细胞都能在高表达NKG2A/CD94的CD8+ T细胞中相对富集。
因此:肿瘤IFN感应是通过Qa-1b(HLA-E)通路抑制细胞毒性CD8+ T细胞,来达到免疫逃逸结果。

Nat Immunol 23, 1495–1506 (2022).
但是,IFN介导非经典MHC I类的抑制作用可能会被经典MHC I类下调导致的T细胞毒性抵抗所掩盖。
当分离T细胞抗原识别与MHC I类上调的关系时显示:CD8+ T细胞优先杀死具有IFN敏感性的肿瘤细胞,但上调Qa-1b会抑制这种杀伤。实际上,IFN介导PD-1上调后并不直接抑制T细胞毒性。
小结
IFN介导MHC I类分子的通路是肿瘤免疫的重要组成(双面IFN-γ:抗癌又促癌)。虽然对于肿瘤ICB耐药的最后治疗效果而言,主导的免疫反应群体可能因肿瘤类别的不同而不同(例如肾细胞癌中免疫反应可能由NK细胞或其他效应群体主导,而不是肿瘤抗原特异性T细胞,因此MHC I类的上调可能具有免疫保护作用),但是区别经典和非经典MHC I类的双重作用对于识别肿瘤耐药的具体反应机制至关重要。
IFN介导的经典MHC I类上调会抑制NK细胞活化。
IFN诱导表达的活性最高免疫逃避机制为非经典MHC I类Qa-1b(HLA-E)通过NKG2A/ CD94受体抑制CD8+ T细胞,这是由ICB诱导的。
相关药物:
HLA-E/NKG2A通路目前竞争者较少,以单抗药物为主,包括:
阿斯利康/Innate Pharma的monalizumab:

该药物在2022年4月的AACR上公布其3期临床试验INTERLINK-1数据,与PD-1联用。2022年3月17日获得了CDE的临床试验默示许可。

但是2022年8月,INTERLINK-1第3阶段研究的计划徒劳中期分析未达到预定义的疗效阈值。阿斯利康已停止该试验。
BMS的BMS-986315:目前正在展开一项单独使用并联合尼武单抗或西妥昔单抗治疗晚期实体瘤患者的试验,处于招募阶段。(NCT04349267)
Servier的S095029:目前展开一项作为单一疗法并与Sym021联合用于晚期实体瘤恶性肿瘤患者的临床试验。
怀越生物的HY-0102:称其具有相对于海外竞品Monalizumab更高的亲和力,及优于Monalizumab的体外活性。2022年5月3日在美国的1期临床试验完成首例入组。
最快的探索者目前暂时搁浅,NKG2A看起来靶点虽好,但是显然还具有一定的成药难题。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)