2022-11-29 来源 : 学术查
研究背景
铁死亡(Ferroptosis)是Dixon等人在2012年提出的一个术语,指的是一种铁依赖的细胞死亡形式,由细胞膜上过量的过氧化脂质驱动。它在形态和机制上不同于细胞凋亡和其他类型的调节性细胞死亡。例如,在形态上,发生铁死亡的细胞不表现出典型的凋亡特征(如染色质凝集和凋亡体形成),其特征是线粒体缩小和线粒体嵴数目减少。近年对于铁死亡的研究热度不断提升,今年共有337个国自然中标项目。
2022年3月25日,Boyi Gan等人在Nature Reviews CanCer(IF:69.8)上发表了题为Targeting ferroptosis as a vulnerability in cancer的文章,该综述系统总结了目前对铁死亡的诱导和防御机制,并揭示了其在癌症治疗中的巨大潜力。

原文链接: https://www.nature.com/articles/s41568-022-00459-0

研究背景
铁死亡是一种铁依赖的细胞死亡形式,由细胞膜上积聚的脂质过氧化引发。近年来,铁死亡引起了癌症研究界的极大兴趣,因为它在机制和形态上不同于细胞凋亡等其他形式的细胞死亡,具有巨大的癌症治疗潜力。在这篇综述中,作者总结了铁死亡诱导和防御机制的研究现状,剖析了铁死亡在肿瘤抑制和肿瘤免疫中的作用和机制,概念化癌细胞对铁死亡的易感性并探索了针对肿瘤铁死亡的治疗策略。
研究内容
1、铁死亡的先决条件
PUFA- PL的合成和过氧化、铁代谢和线粒体代谢是驱动铁死亡的先决条件。 ACSL4和LPCAT3是PUFA-PL合成的关键调节因子,ACC是合成某些PUFA所必需的,因此ACSL4、LPCAT3或ACC的失活会抑制铁死亡。由于PUFA中存在双烯丙基所以易发生过氧化,其由非酶自氧化反应催化,由以铁为催化剂的芬顿反应驱动。POR或ALOX介导的酶促反应也可以促进脂质过氧化。单不饱和脂肪酸通过取代细胞膜上的多不饱和脂肪酸来抑制脂质过氧化和铁死亡,参与MUFA- PL合成的酶,如SCD1和ACSL3,使癌细胞对铁死亡敏感。同时,细胞会通过调节铁的摄取、利用、储存和输出来维持细胞内活性铁库的相对稳定,这些铁代谢过程的不平衡调节可以促进或抑制铁死亡。线粒体中的几个代谢过程在引发铁死亡中也具有重要作用,通过促进ROS、ATP或PUFA-PL的生成来驱动铁死亡。
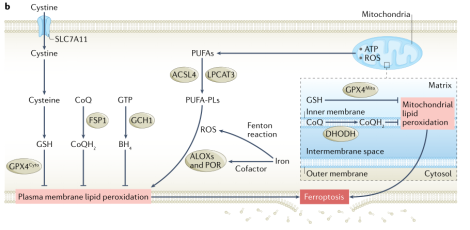
图1 铁死亡的先决条件和防御机制
2、铁死亡的防御机制
铁死亡的防御机制在过于两年中一直是研究的热点。研究显示,至少有如下四个具有独特亚细胞定位的铁死亡防御系统。GPX4-GSH系统:GPX4是唯一能够将磷脂氢过氧化物转化为磷脂醇的GPX蛋白家族成员,GPX4的遗传消融或药物抑制会导致不受控的脂质过氧化并触发强力的铁死亡。GPX4由三种亚细胞定位的亚型组成,即胞质型、线粒体型和核型。GSH是GPX4的辅助因子,半胱氨酸是其限速前体。癌细胞通过xc系统获得胞内半胱氨酸,SLC7A11是xc系统的转运子单位。从培养液中去除半胱氨酸或阻断SLC7A11介导的半胱氨酸转运,可在许多癌细胞系中诱导有效的铁死亡。SLC7A11-GSH-GPX4构成了防御铁死亡的主要细胞系统。FSP1-CoQH2系统:FSP1定位于质膜,能够依赖NAD(P)H将 CoQ还原为CoQH2,还能捕获脂质过氧化自由基,从而抑制脂质过氧化和铁死亡。因此有人提出,FSP1通过产生非线粒体CoQH2作为自由基捕获剂来发挥其强大的抗铁死亡活性。DHODH-CoQH2系统:DHODH定位于线粒体,是一种参与嘧啶合成,可将线粒体内膜中的CoQ还原为CoQH2的酶。当GPX4失活时,通过DHODH的通量增加来中和脂质过氧化并防止线粒体铁死亡。GCH1-BH4系统:BH4是另一种捕获自由基的抗氧化剂,而GCH1介导BH4合成过程中的限速反应。通过生成BH4作为抗氧化剂以及GCH1介导的产生CoQH2和含两个PUFA尾的PLs来抑制铁死亡。该系统的亚细胞定位还有待确定。
3、铁死亡逃逸会加剧肿瘤
4、铁死亡的脆弱性
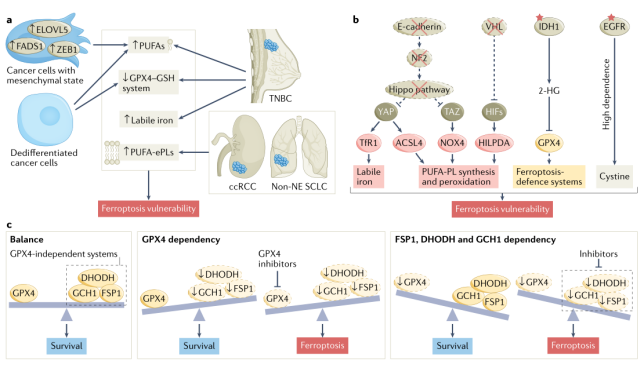
图2 铁死亡的脆弱性
5、肿瘤微环境中的铁死亡
肿瘤微环境(TME)决定了肿瘤细胞是否会发生铁死亡。CD8+细胞毒性T细胞是TME中抗肿瘤免疫的主要执行者,可分泌IFN-γ,I其可在癌症和非癌症环境中调节SLC7A11的表达或活性。免疫检查点抑制剂(ICIs)和半胱氨酸酶可协同促进肿瘤铁死亡,共同增强T细胞介导的抗肿瘤免疫反应,这表明与ICIs联合阻断SLC7A11介导的胱氨酸摄取是一种潜在的癌症治疗策略。
在某些免疫抑制细胞中诱导铁死亡也能增强抗肿瘤免疫。Treg细胞是CD4+细胞的一个免疫抑制亚群,可阻碍对肿瘤的保护性免疫监视。GPX4的Treg细胞特异性缺失会触发Treg细胞的铁死亡,从而促进抗肿瘤免疫。具有免疫抑制功能的骨髓源性抑制细胞(MDSCs)对铁死亡具有抗性,因此,靶向ASAH2诱导MDSCs中的铁死亡可增加肿瘤浸润性细胞毒性CD8+细胞的活性并促进肿瘤抑制。肿瘤相关巨噬细胞(TAMs)主要表现为M2样表型。与促进抗肿瘤免疫的M1类相比,免疫抑制型的M2类TAMs更容易受到GPX4抑制所诱导的铁死亡的影响。因此,在不影响M1样TAMs的情况下诱导M2样TAMs发生铁死亡是克服免疫抑制性TME和增强癌症免疫治疗作用的潜在策略。
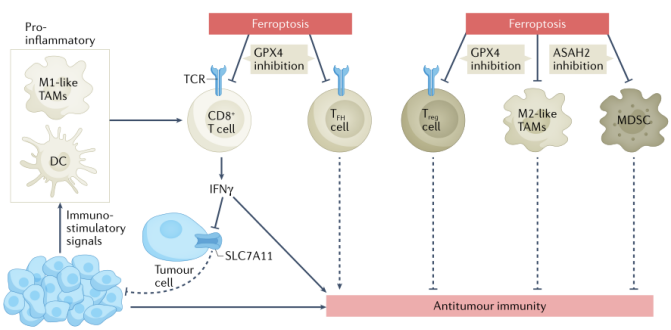
图3 铁死亡在抗肿瘤免疫中的作用
近年来,FINs因其巨大的治疗潜力在癌症研究引起了极大的兴趣,已经开发了多种纳米材料来局部诱导铁死亡或提高FINs的活性。越来越多的证据表明,铁死亡至少部分地介导了几种常规癌症疗法的肿瘤抑制作用,包括放疗、化疗、靶向治疗和免疫疗法,本节主要从利用铁死亡的脆弱性、使耐药肿瘤对铁死亡重新敏感和将FIN与传统癌症治疗相结合来阐述癌症治疗。
在某些癌症中,癌细胞比上皮细胞对铁死亡更敏感,这允许在保留正常组织的同时,在肿瘤中选择性地诱导铁死亡。不同的铁死亡逃逸机制赋予癌细胞对铁死亡的抵抗力,破坏促使铁死亡逃逸的机制可以使抗铁死亡的癌细胞或肿瘤再次对铁死亡敏感。通过抑制基因本身的蛋白质产物的表达或活性,可以克服由某些具有致癌活性的基因介导的抗铁死亡性。原癌基因诱导的铁死亡抗性也可以通过下游效应器介导,这些效应器可以作为逆转铁死亡抗性的靶点。总的来说,靶向赋予铁死亡抗性的关键致癌途径是癌症治疗的一个重要策略。
多种形式的常规癌症治疗可以引发铁死亡,增强这些疗法(例如,使用FINs)诱发的铁死亡可以进一步增强其治疗效果。对于某些具有内在或获得性治疗抗性的癌症类型,使用FINs诱导铁死亡可以恢复它们对常规治疗的敏感性。某些癌症的化疗耐药性可以通过FINs来克服。目前正在进行多项临床试验,以测试单独或与常规治疗结合使用具有铁死亡诱导活性的FINs或抗癌药物对癌症患者的疗效和安全性,例如NCT04205357、NCT04092647、NCT02559778、NCT03247088。
研究总结及展望
● ● ● ● ● ● ●
2022年度国自然医学部国自然40大科研热点的中标数统计如下:
2022热点 | 2022中标数 | 2022热点 | 2022中标数 |
免疫调控 | 907 | 中性粒细胞 | 112 |
巨噬细胞 | 591 | 反馈回路 | 104 |
线粒体 | 491 | 乳酸化 | 104 |
血管功能 | 487 | 可变剪接 | 71 |
外泌体 | 470 | AI机器学习 | 67 |
自噬 | 404 | 类器官 | 67 |
铁死亡 | 337 | 炎症小体 | 62 |
干细胞 | 329 | 染色质重塑 | 58 |
代谢重编程 | 325 | 单细胞测序 | 54 |
m6A/m5C/m7G | 320 | 糖基化 | 50 |
泛素化 | 225 | 低氧缺氧 | 50 |
circRNA | 221 | 相分离 | 50 |
lncRNA | 204 | 泛凋亡PANoptosis | 42 |
细胞焦亡 | 175 | 细胞衰老 | 37 |
组蛋白 | 171 | 胞葬 | 33 |
肠道菌群 | 133 | CRISPR | 33 |
乙酰化 | 125 | 增强子 | 29 |
内质网 | 125 | 精氨酸甲基化 | 25 |
转录调控 | 112 | 迁移体 | 8 |
糖酵解 | 112 | 血管拟态 | 8 |
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)