2023-07-04

FDA和CDE均有抗肿瘤药首次人体试验扩展队列研究技术指导原则;旨在指出抗肿瘤药FIH扩展队列研究需考虑进行风险管理,同时为此类研究的设计和实施提供总体建议等。

FDA强烈建议:找到RP2D之后再进入队列扩展。

为了避免将病人暴露在不必要的风险中,在对于不同的人群,多个疾病进行队列扩展时,必须提供样本量计算的细节。

应对每一个接受治疗的人群,提供科学合理的依据;另外,对于样本量计算和Stopping rules须严格定义,FIH首次用于人体的早期探索研究,实体瘤一般不超过40个病人,血液肿瘤一般不超过20个病人。

CDE的指导原则中,FIH扩展队列研究适用场景分为九类:
(一)安全性数据的进一步收集
(二)有效性的初步评估
(三)影响PK和PD的内因、外因探索
(四)后续给药方案的探索
(五)生物标志物的探索和研发
(六)制剂变更的初步评价
(七)联合用药的探索
(八)药物在儿科人群中PK、耐受性和疗效的初步评价
(九)种族敏感性的探索
推 荐 学 习 案 例
DS-8201a的I期研究是一个两阶段,多中心,非随机,开放标签,多剂量的首次人体试验。两个阶段分别是剂量爬坡阶段和剂量扩展阶段。主要研究的肿瘤类型包括乳腺癌、胃腺癌、胃食管连接部腺癌;
在剂量爬坡阶段和剂量扩展阶段的设计方法和研究目标,详见下图:

推荐理由:该研究剂量扩展阶段,采用“多队列剂量扩展”,从Part 2a到Part 2e共5个臂,符合指导原则中提到的多个适用场景。

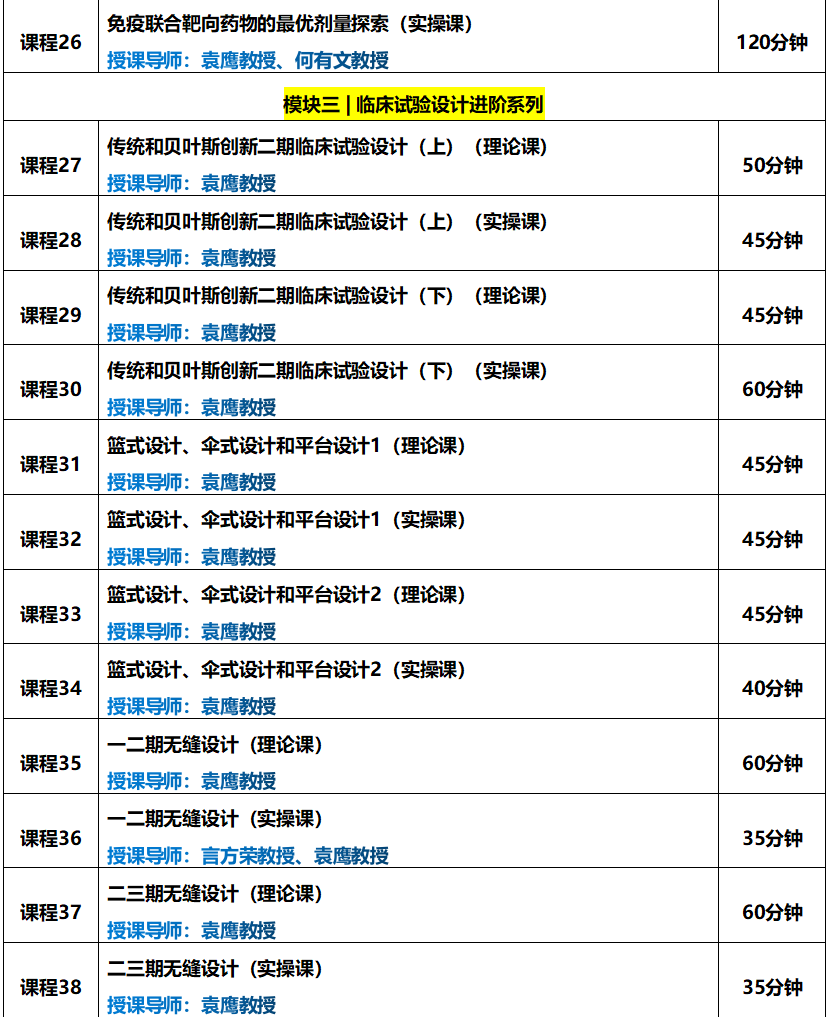
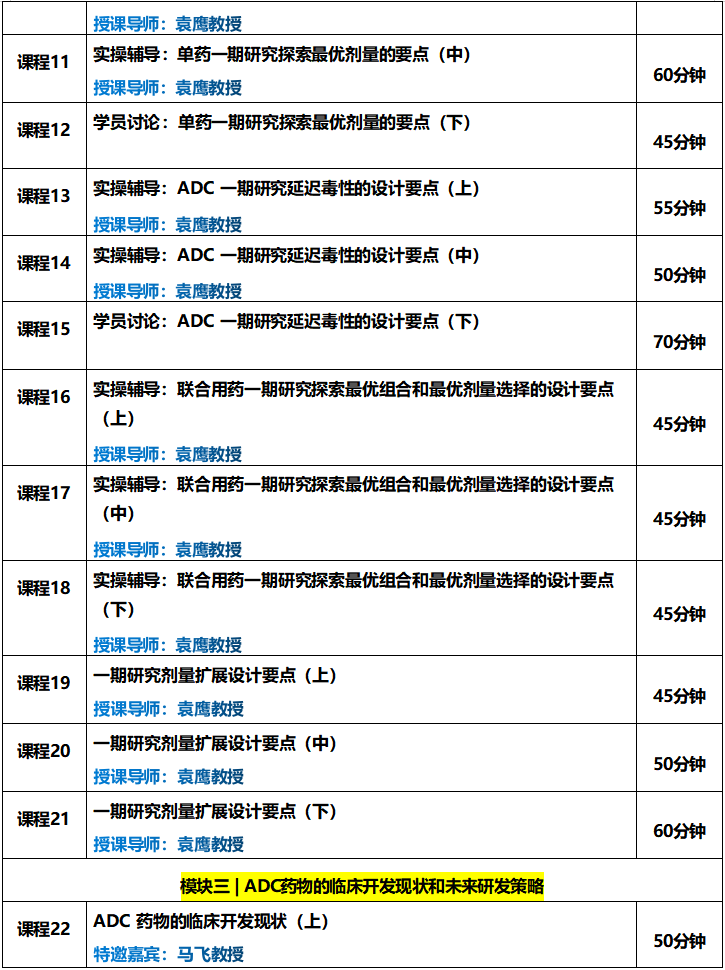
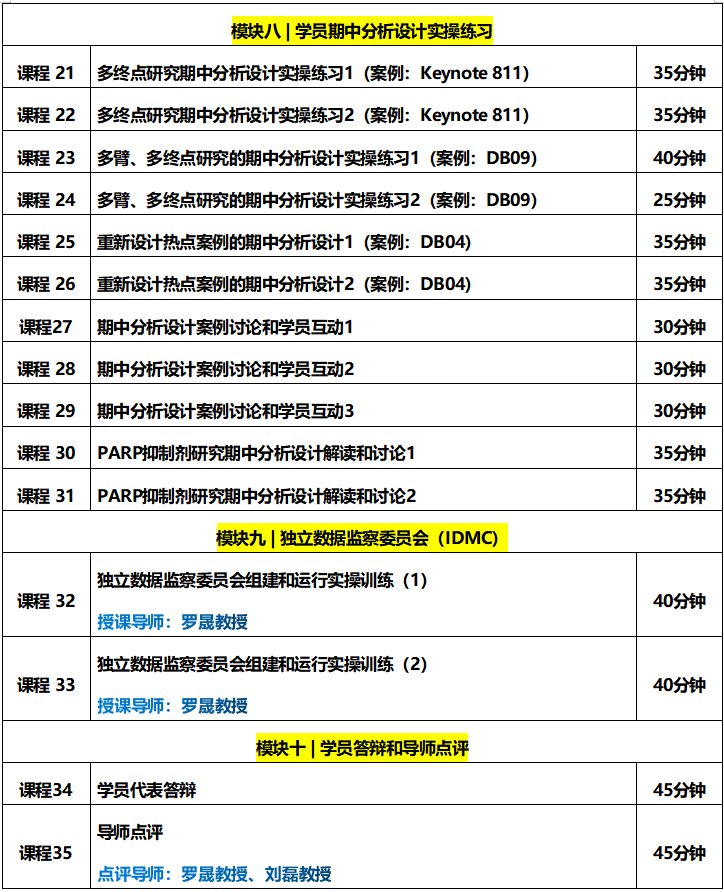
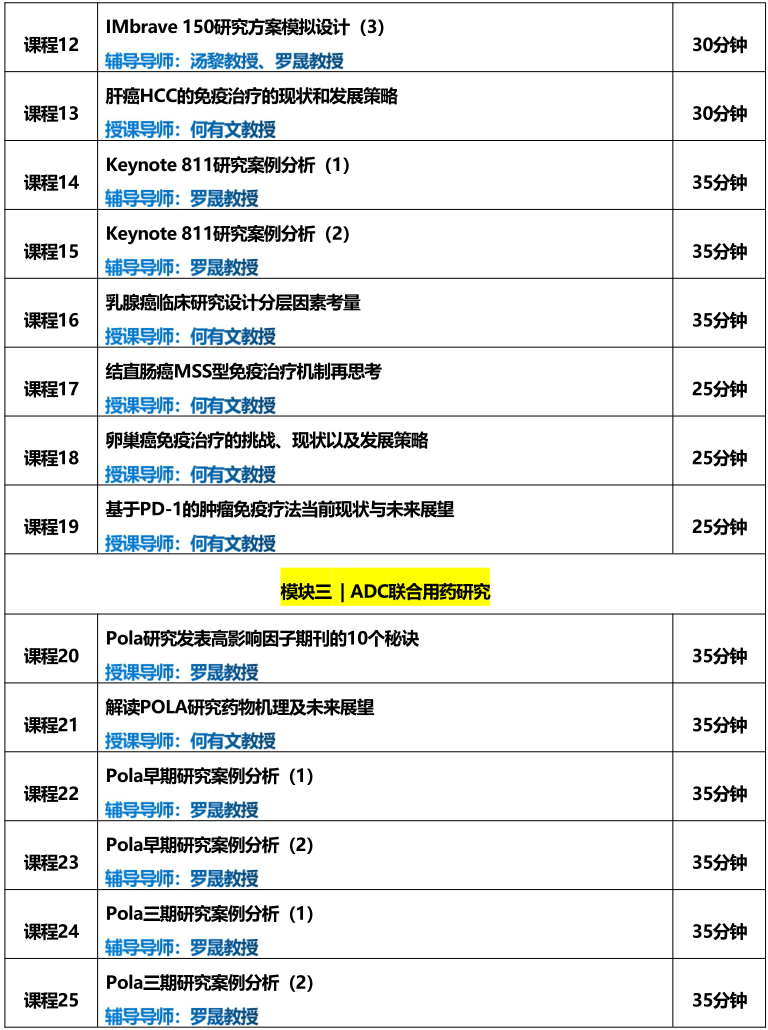
一期研究如何进行剂量扩展?应提供哪些依据?剂量应如何选择?样本量如何计算?不同的队列如何分配病人......;授课导师袁鹰教授都在课程中进行了详细的讲解。
本课程内容摘自《ADC一期研究设计实操训练营》模块一。
辅导导师:袁鹰教授(美国安德森癌症中心)
课程时长:90分钟


























训练营课程持续更新中......
添加小编微信

百度浏览 来源 : 国际临研
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)