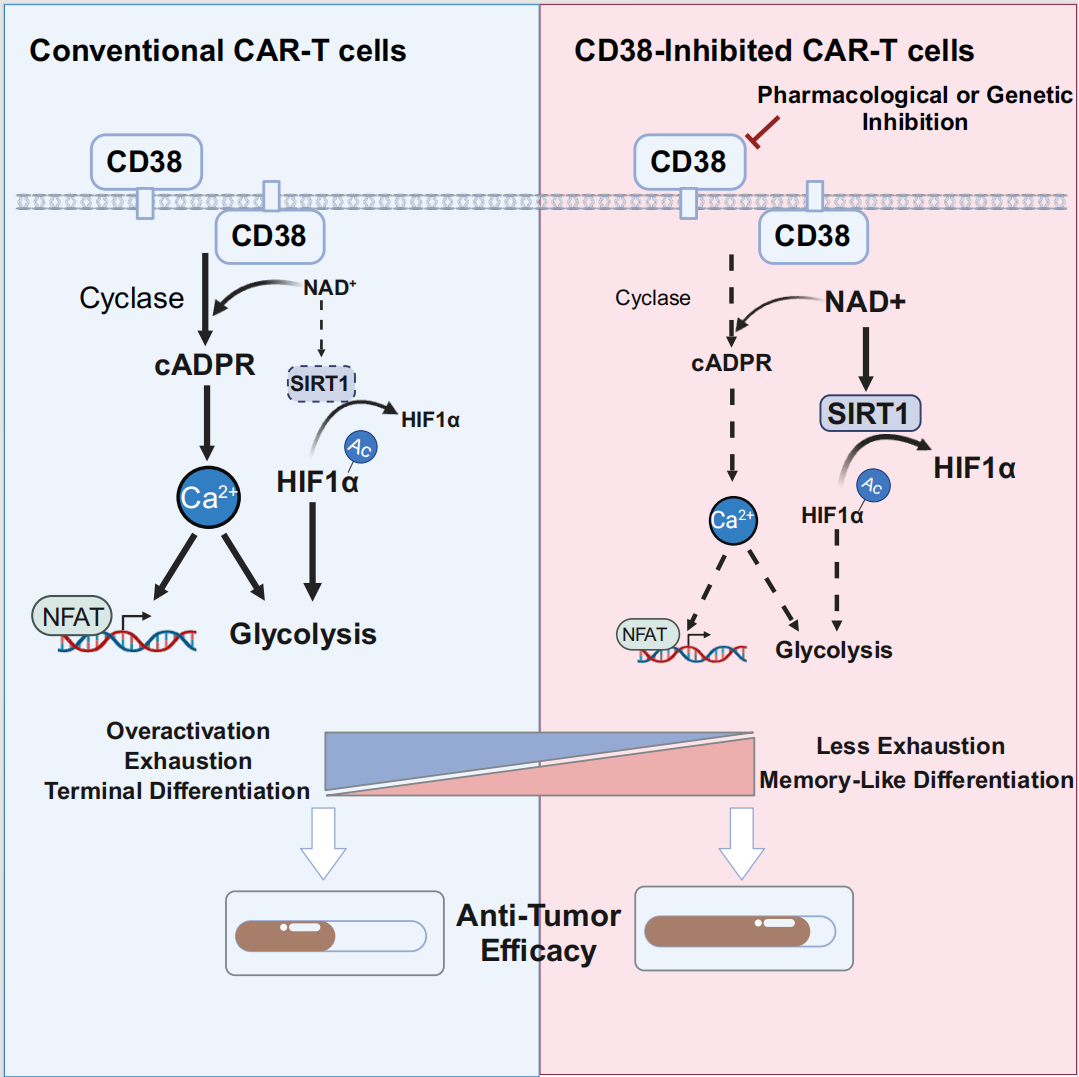
近年来,CAR-T细胞疗法成为了血液系统恶性肿瘤及自身免疫疾病最具前景的治疗手段之一。CAR-T细胞在体内面对的免疫抑制环境、T细胞功能障碍是造成CAR-T细胞治疗不理想的主要因素;其中,CAR-T细胞的耗竭主要源于肿瘤抗原的反复刺激以及CAR结构聚集导致的持续自。因此,挽救CAR-T细胞耗竭,促进CAR-T细胞的持续性自我更新,是增加细胞免疫治疗疗效的关键因素。目前,通过对耗竭T细胞模型的多组学分析以及CRISPR-Cas9基因筛选,揭示了一系列CAR-T功能调控因子,例如MED12、EZH1、BATF等。2024年2月2日,浙江大学医学院附属第一医院黄河教授与浙江大学基础医学院钱鹏旭研究员及浙江大学医学院附属第一医院胡永仙主任医师团队合作,在 Cell Reports Medicine 期刊发表了题为:Inhibition of CD38 enzymatic activity enhances CAR-T cell immune-therapeutic efficacy by repressing glycolytic metabolism 的研究论文。该研究通过对患者来源的CAR-T细胞进行单细胞多组学数据分析和体外模型验证,确定了CD38是CAR-T细胞耗竭的潜在标记分子。CD38的药理或遗传学抑制可以逆转由持续活化或肿瘤抗原刺激诱导的细胞耗竭,促进记忆样分化,从而提高CAR-T细胞的细胞毒性和抗肿瘤效果,证实了CD38在CAR-T细胞中的重要功能调控作用。CD38是一种单链跨膜糖蛋白,最初被定义为T细胞激活标志分子,具有ADP-核糖环化酶和水解酶活性,并通过NAD+酶活性协调细胞内外NAD+水平。CD38在自身免疫性疾病、肿瘤发展和传染性疾病中的T细胞功能调控中均具有重要作用,然而,它在抗肿瘤免疫疗法,特别是CAR-T细胞免疫调控中的作用尚不完全清楚。研究人员针对近期发表的两组单细胞组学数据进行重分析,scATAC-seq与scRNA-seq测序数据均提示CD38在耗竭CD8+T细胞中高表达,CD38与细胞耗竭指数成显著正相关,提示了CD38在CAR-T细胞耗竭过程中可能扮演着分子标记物的角色。靶向CD38酶活性的小分子抑制剂或CD38基因敲降均能够增强CAR-T细胞在体内外的抗肿瘤能力和持久性,促进记忆样分化并抑制耗竭,这可能与降低的糖酵解代谢活性有关。此前已有较多研究报道,抑制糖酵解活性或其关键的代谢调节因子能够降低T或CAR-T细胞在抗肿瘤环境下耗竭特征,从而提高了对肿瘤的清除效果。进一步探究潜在机制,在反应产物角度,针对CD38的药理或遗传学抑制降低了胞内第二信使cADPR的含量,抑制下游钙信号水平,减少NFAT转录因子入核从而抑制糖酵解相关基因转录表达;另一方面,在反应底物角度,CD38的抑制导致胞内NAD+含量以及NAD+/NADH比例增加,升高的NAD+水平导致SIRT1表达及去乙酰化酶活性增加,减少下游HIF1A乙酰化水平。CD38-NAD+-SIRT1通路激活后造成HIF1A稳定性降低,HIF1A作为糖酵解相关基因表达的重要调控因子,与CAR-T细胞下调的糖酵解代谢活性存在直接联系。浙江大学医学院博士研究生黄玥、邵谧、滕心怡以及浙江大学医学院附属第一医院博士后司晓慧为该论文的共同第一作者。黄河教授,钱鹏旭研究员与胡永仙主任医师为该论文共同通讯作者。该研究受到浙江大学基础医学院、良渚实验室多个公共技术平台的大力支持。www.cell.com/cell-reports-medicine/fulltext/S2666-3791(24)00009-0
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。







发表评论
注册或登后即可发表评论
登录注册
全部评论(0)