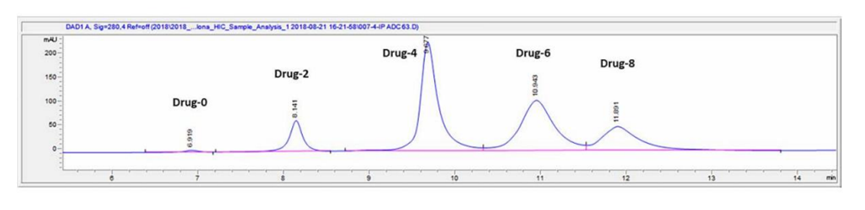
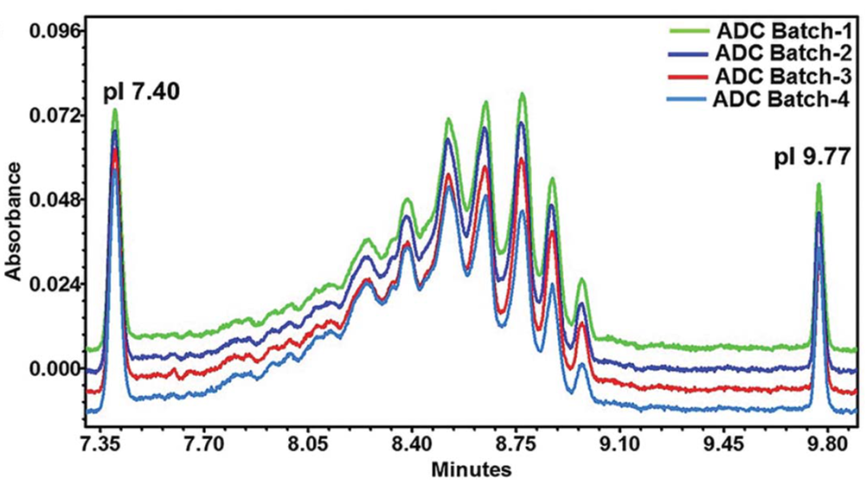
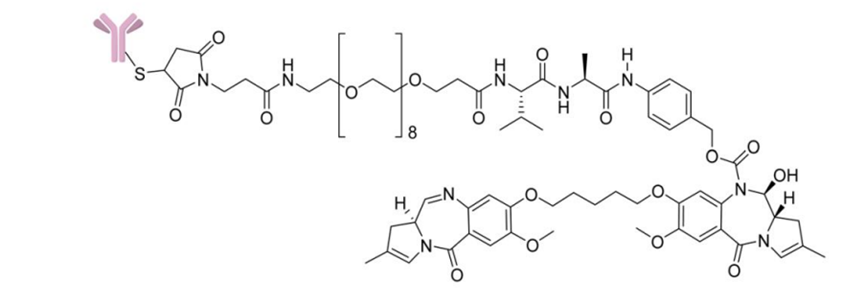
DAR是ADC重要的质量属性之一,直接影响其安全性和有效性。它表示每个抗体分子上偶联的小分子药物的平均数量。根据连接子、小分子药物的化学性质以及偶联方式(氨基偶联、巯基偶联、定点偶联等)选择分析手段,常用方法有:紫外-可见分光光度法、疏水色谱法、反相色谱法和质谱法(MS)。⾼效液相⾊谱 (HPLC) ⽅法对半胱氨酸偶联 ADC 特别有⽤。但对于赖氨酸缀合的抗体偶联物分辨率有限。鉴于Payload和抗体具有不同的最⼤吸光度(λmax)值,最简单的 ADC 表征⽅法是紫外/可⻅光 (UV/VIS) 光谱分析。使⽤整个 ADC、mAb 和有效负载 的各个消光系数及其独特的λmax值(前者通常在 280 nm 处),可以通过两种溶液确定 mAb 和有效负载的各个浓度建立回归方程,从⽽提供摩尔⽐(即每摩尔抗体的有效负载摩尔数)。这种⽅法已被⼴泛使⽤,即使对于mAb 和有效负载之间的λmax差异相对较⼩的 ADC 也是如此。已使⽤此⽅法的Payload⽰例包括美登素(例如DM1)、甲氨蝶呤、CC-1065 类似物、阿霉素、加利⻋霉素和⼆肽连接的 auristatins (如vc-MMAE)。根据测量到的吸光率和消光系数,可以根据Beer–Lambert原理计算出蛋白质和药物的浓度,依此计算平均DAR,公式如下:随机缀合的 ADC 通常是⾼度异质的,不同的缀合位点具有不同数量的有效负载分⼦。因此,能够表征和监测 ADC Payload分布的分析技术尤为重要,因为不同DAR值的混合物可能具有不同的药代动力学、⽣物学和毒理学特性,可能影响ADC药物的安全性和有效性。如果 mAb 超过四个Payload通常表现出聚集倾向,这可能导致毒性增加。ADC 的有效负载成分通常是偶联在 mAb 暴露区域的疏⽔性⼩分⼦。因此,含有⼤量Payload分⼦的 ADC 物种具有更多的疏⽔区域,使得疏⽔相互作⽤⾊谱 (HIC) 分析特别适⽤于监测 ADC Payload分布。早期使⽤ HIC研究载荷的⼯作是由西雅图遗传学公司的研究⼈员进行的。⼀种典型的⽅法涉及使⽤具有线性梯度的Ether-5PW⾊谱柱(Tosoh Bioscience)等HIC ⽅法可能很复杂,需要优化许多参数,包括⾊谱柱(即疏⽔配体和⽀持基质)、流动相、盐的类型和浓度、温度和pH 值。质谱是另外一种常用的分析DAR的方法。目前使用包括电喷雾电离质谱(ESI)、飞行时间质谱(TOF)或Orbitrap,以区分ADC的异质分子种类。根据质谱测定的分子量及相应峰面积等,计算平均DAR。药物分布表示偶联有不同数量小分子药物的ADC分子分别占总的药物分子的比例。常用的分析方法包括:疏水高效液相色谱(HIC-HPLC)、反相高效液相色谱(RP-HPLC)、毛细管电泳(CE)或质谱法(MS)等,鉴定不同载药量组分的分布。分子量大小变异(聚合物、颗粒、碎片)可以直接影响蛋白质治疗方法的有效性或安全性。当两个或两个以上的单体聚集,形成大小在数十纳米到数百微米之间的聚集体。聚集是蛋白质物理降解的最常见的途径。ADCs比母本抗体更容易聚集,这主要是由于药物/连接子的存在,它们在偶联位点的周围具有更多的疏水性。常用的方法包括:分子排阻色谱法(SEC-HPLC)、非还原型和还原型十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、十二烷基磺酸钠-聚丙烯酰胺毛细管凝胶电泳(CE-SDS)和分析型超速离心(AUC)等多种方法对ADC的分子大小变异体(即聚合物和片段)进行适当鉴定。需要特别关注聚合物,因为许多与抗体偶联的小分子药物具有疏水性,可能会增加生产和贮藏期间聚合物的形成。蛋白质治疗的电荷变异是重要的质量特性,对稳定性和生物活性的潜在影响。对于单克隆抗体,通常采用毛细管区带电泳(CZE)、离子交换高效液相色谱(IEX-HPLC)、毛细管等电聚焦电泳(CIEF)或成像毛细管等电聚焦电泳(iCIEF)等适当方法测定电荷变异体。这些方法对ADC分析的适用性取决于药物-连接体的特性(尤其是电荷)以及结合位点的选择(如赖氨酸、链间巯基、碳水化合物等)。虽然IEX-HPLC法是测定抗体电荷变异体的常用方法,但由于细胞毒性药物与色谱柱固定相之间潜在的占主导性的非特异性相互作用,该方法可能不适用于ADC电荷变异体的分析。在某些情况下,通过赖氨酸残基偶联ADC的电荷异质性分析可能不可行或无意义。例如,通过赖氨酸残基连接不带电荷的药物-连接体后,每连接一个药物-连接体会导致ADC的净正电荷减少一个。在这种情况下,基于电荷的分离方法只能分析赖氨酸偶联的ADC的载药图谱,而采用其它表征方法(如肽图谱)来评估偶联对抗体中间体本身电荷异质性的影响可能更有意义。疏⽔性在 ADC 的开发中起着重要作⽤。尽管进行了⼴泛的研究,但其分⼦机制仍然存在争议,并且仍然没有可靠的预测模型来证明其在药物发现中的作⽤。⼀些最有效的 ADC Payload(如PBD⼆聚体和多卡霉素)也是最疏⽔的,这可能会导致偶联和量产的困难。此外,⼈们认识到降低均相 ADC 的疏⽔性可以提⾼它们的药代动力学和治疗指数 (TI)。在新的 ADC 的发现和开发阶段,Payload分⼦和相关Linker的分⼦量应尽可能低。在结构和链中包含尽可能多的亲⽔官能团作为取代基(例如, -NH2、 -OH、-COOH)也有助于优化亲⽔性。因此,⼄⼆醇链[例如,聚⼄⼆醇col (PEG)] 也被用于ADC药物中,下图 PBD ⼆聚体有效负载通过PEG 单元连接到抗体上。1.Chen Y. Drug-to-antibody ratio
(DAR) by UV/Vis spectroscopy. Methods Mol Biol. 2013;1045:267–73.2.Adem YT, et al,Antibody Drug Conjugate
Physical Instability and the Role of Drug Payload. Bioconjugate Chemistry.
2014;25:656–64.3.Anil Wagh et al,Challenges and new frontiers
in analytical characterization of antibody-drug conjugates,MABS 2018, VOL. 10, NO. 2, 222–2434.Jinsha Liu et al, Therapeutic
Advances in Oncology, Int. J. Mol. Sci. 2021, 22, 2008.6.Cytotoxic payloads for antibody-drug conjugates 版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。
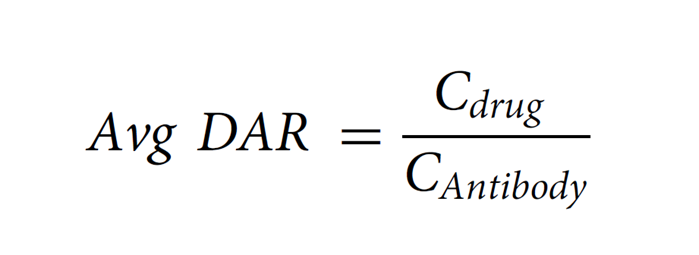
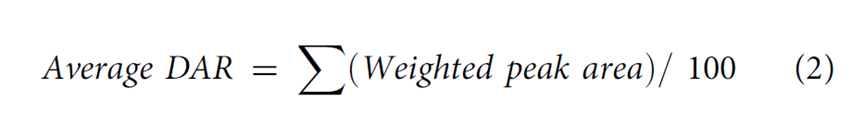





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)