2022-07-04

NMPA 最新批件显示,信达生物 PD-1 信迪利单抗新适应症获批上市,联合化疗(奥沙利铂+卡培他滨)一线治疗不可切除的局部晚期、复发性或转移性胃或胃食管交界处腺癌。这是信迪利单抗获批上市的第 6 项适应症。
值得一提的是,信迪利单抗本次成功在 6 月 30 日前获批新适应症,意味着这项适应症有望在今年下半年参与医保谈判。


来自:NMPA 官网
截止当前,信迪利单抗获批适应症情况如下:
信达生物信迪利单抗获批适应症
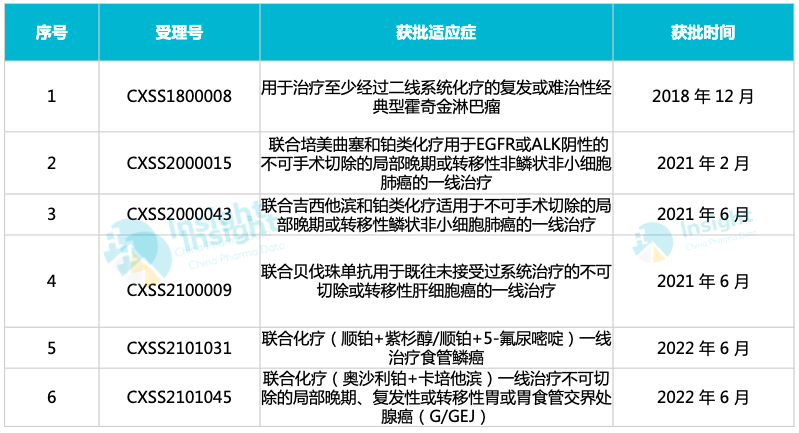
来自:Insight 整理
信迪利单抗此项适应症是基于 3 期临床 ORIENT-16 研究的结果,这是一项随机、双盲、多中心、III 期研究(NCT03745170),主要研究终点为总体人群和 PD-L1 阳性人群(CPS>5)的总生存期(OS)。
截止期中分析截止日,ORIENT-16 研究共入组 650 例受试者,受试者按 1:1 比例随机进入试验组或对照组,接受信迪利单抗或安慰剂,联合化疗(奥沙利铂+卡培他滨)治疗,直至发生疾病进展、不可耐受的毒性、撤销知情同意、死亡或方案规定的其他应停止治疗的情况,以先发生者为准。
结果在 ESMO2021 大会上进行报告。期中分析显示,信迪利单抗联合化疗显著降低 CPS≥5 人群(HR 0.660,95%CI 0.505-0.864,p=0.0023)和总体人群(HR 0.766,95%CI 0.626-0.936,p=0.0090)的死亡风险,达到预设的优效性标准;
中位总生存期(mOS)在 CPS≥5 人群延长 5.5 个月(mOS 18.4 月 vs. 12.9 月),总体人群延长 2.9 个月(mOS 15.2 月 vs. 12.3 月)。总生存期在预设的所有亚组分析中获益趋势一致。安全性特征与既往报道的信迪利单抗相关临床研究结果一致,无新的安全性信号。
详见下图:
ORIENT-16 临床试验结果(Insight)

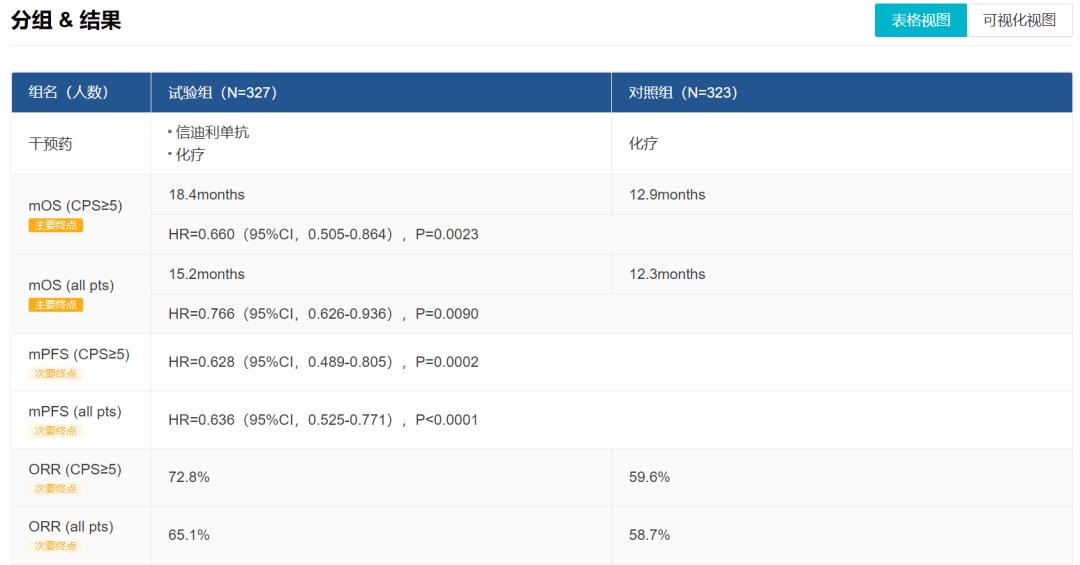

来自:Insight 数据库
* Insight 数据库即将在 6 月底上线「临床试验结果」模块,提供丰富的筛选检索项、表格+可视化两种数据展示形式,并与数据库全球新药模块打通,轻松掌握新药全生命周期数据,敬请期待~
胃癌属于亚洲高发癌种,然而,在国内 PD-1 单抗当中,仅进口的 K 药和 O 药有胃癌适应症获批上市。信迪利单抗是唯一已经针对胃癌报批上市的国产 PD-1 单抗,在信达之后,百济神州同样开发了一线胃癌适应症,今年 1 月份注册临床 RATIONALE-305 达到终点,刚于近日申报上市(受理号:CXSS2200060)。
替雷利珠单抗胃癌适应症国内研发进度

来自:Insight 数据库
本次信迪利单抗获批一线治疗胃癌,国内胃癌患者终于迎来首款国产 PD-1 药物;同时有成功卡进医保谈判截止期、有望今年进入医保支付范围,患者在迎来新疗法之时,经济负担也将减轻。
百度浏览 来源 : Insight数据库
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)