2022-08-11

CACA肝癌指南PDF版获取方法:点击上方【医微客】名片,后台回复关键词【CACA肝癌】即可获取下载链接
指南引用与下载
引用本文:
中国抗癌协会肝癌专业委员会. 中国肿瘤整合诊治指南(CACA)-肝癌部分[J]. 肿瘤综合治疗电子杂志, 2022, 8(3): 31-63.
中国肿瘤整合诊治指南(CACA)-肝癌部分
中国抗癌协会肝癌专业委员会
通信作者:
陈敏山
E-mail :chenmsh@sysucc.org.cn
据世界卫生组织估算,2020年全球肝癌新发病例约905 677例,中国约占45.3%。在我国肝癌列第5位常见恶性肿瘤及第2位肿瘤致死病因。肝癌,亦指“原发性肝癌”主要包括肝细胞癌和肝胆管细胞等多个不同病理类型。目前,国内外的规范指南均是针对“肝细胞癌”,同样本指南中的肝癌亦是指“肝细胞癌”。我国肝癌患者多以乙肝病毒感染/肝硬化为背景,就诊时大多数为中晚期(70%),表现为肝内肿瘤负荷大,合并门脉癌栓概率大,肝功能较差等,就诊时就失去根治性治疗手术切除机会,与欧美等发达国家肝癌人群具有较大差异。现有的美国癌症联合委员会(AJCC)/国际抗癌联盟(UICC)、美国国家综合癌症网络(NCCN)、欧洲肿瘤内科学会(ESMO)/巴塞罗那临床肝癌(BCLC)、日本肝癌诊疗等分期和指南在临床实践中无法兼顾我国肝癌的疾病背景,诊疗资源的地区差异,肿瘤治疗的社会价值等方面,且难以实现个体化决策。由中国抗癌协会理事长樊代明院士倡导,中国抗癌协会组织全国肿瘤医学领域专家,共同参与编写《中国肿瘤整合诊治指南(CACA)》的背景下,经中国抗癌协会肝癌专业委员会组织业内专家,以国家卫生健康委员会《原发性肝癌诊疗指南(2022年版)》为蓝本,按照“防-筛-诊-治-康”的结构完成了本指南的编写,内容涉及肝癌的流行病学、筛查、影像学检查、病理学评估,以及外科治疗、介入治疗、系统性药物治疗、放疗和中医药治疗等多学科整合治疗手段,兼顾全程康复管理。全文贯彻“整合医学理念”,以“立足中国国情,体现中国特色”为指导思想,注意收纳中国的临床研究成果和经验,制订出适合中国人群,密切结合中国的具体国情和临床实践,符合中国肝癌特色的临床诊疗指南,将为进一步提高我国肝癌诊疗水平发挥重要作用。
1、流行病学概述
肝癌的发生有明显的地区性分布,以东亚、东南亚、非洲南部及西部的发病率较高,南欧的意大利、希腊、西班牙和东欧南部为中发区,欧美、大洋洲等的发病率则较低。
流行趋势:包括美国在内的一些发达国家和地区,原发性肝癌的发病率均在逐年上升,并且增加的趋势可能还会延续几十年。日本大阪肝癌发病率1968—1987年迅速增加,男性和女性分别增长41.5/10万和9.7/10万。瑞士男女性发病率也呈持续上升趋势,中国香港特别行政区、法国的Bas RhinB也有同样的趋势。这种上升可能是由于诊断水平的提高或对危险因素的暴露增加所致。但在一些发展中国家的某些地区,原发性肝癌的年龄标化发病率已有所下降。1972—1999年,我国上海肝癌发病人数虽然明显增加,但年龄标化发病率是下降的,男性与女性分别下降了26%和28%。1978—2002年江苏启东肝癌的总体发病率呈现上下波动的趋势,而15~34岁年龄组人群的发病率则表现为明显的逐渐下降趋势。新加坡则明显下降,男性由34.2/10万降至26.8/10万,女性也由8.0/10万降至7.0/10万,这种下降可能是人群对危险因素的暴露减少所致。
2、防——肝癌的病因与预防
2.1 肝癌的病因
目前认为肝癌的发生是一个多阶段、多因素协同作用,经过启动、促癌和演进等多步骤过程,以及多个癌基因和相关基因参与、多个基因发生突变的结果。根据现有资料,肝炎病毒、黄曲霉毒素和饮用水污染是肝癌发生的三大相关因素。
2.1.7 各因素间相互协同作用 现有的研究表明,在肝癌的发生及发展过程中,各危险因素之间除单独作用之外,还存在着协同作用,从而显著地增加肝癌的发病风险。一些应用病例对照和危险度分析方法的研究表明,HCV和HBV均是肝癌的独立危险因素,HCV的作用似更强,HCV和HBV可能具有协同致癌效应。慢性HBV和HCV携带者暴露于其他危险因素(包括进食黄曲霉毒素污染的粮食、患酒精性肝硬化和糖尿病),具有协同致癌作用,其发病危险显著升高。HBV和黄曲霉毒素在致肝癌方面具有明显的协同作用;动物实验也显示相似的结果,HBV和黄曲霉毒素的存在与转化DNA表达有关,HBV是始动因子,而黄曲霉毒素是促进因子,但二者的直接协同作用报道较少。HBV和/或HCV感染和饮酒或糖尿病,或HCV感染和脂肪肝等多病因同时存在,可增加肝癌发病的相对危险度;丙型病毒性肝癌患者中饮酒者发生肝癌的风险是非饮酒者的2倍,且病情比非饮酒者进展更快,发病年龄更趋年轻化。有研究进一步表明,吸烟、饮酒与肝癌的发病危险有明显的剂量反应关系:HBsAg阳性并且酗酒和吸烟者的HCC危险度显著高于吸烟和酗酒但HBsAg阴性者。慢性肝炎病毒感染可能导致机体对外源化学毒物的解毒能力下降,如代谢酶的改变、DNA修复的抑制等,从而增加了机体对外源化学毒物的易感性。
2.2 肝癌的预防
目前肝癌的预防较前已经有了长足的进步,无论是在一级预防、二级预防、三级预防,还是四级预防等方面都具有更多更加实质有效的内容。
3、筛——筛查及遗传学
3.1 肝癌的筛查
对肝癌高危人群的筛查与监测,有助于肝癌的早期发现、早期诊断和早期治疗,是提高肝癌疗效的关键。一项随机对照研究证明肝癌高危患者的主动筛查有助于肝癌的早期发现,并能改善肝癌患者的生存。肝癌高危人群的快速便捷识别是实施大范围肝癌筛查的前提,对人群肝癌风险的分层评估是制定不同肝癌筛查策略的基础。
复旦大学附属中山医院/复旦大学肝癌研究所根据多年肝癌筛选的经验,提出以35岁以上HBsAg(+)或慢性肝炎患者为肝癌高危人群。这些人群肝癌检出率为自然人群的34倍。筛检工具为AFP加B超检测。国外报道慢性肝炎、肝硬化患者中每年肝癌检出率为0.8%~4.1%。复旦大学附属中山医院/复旦大学肝癌研究所1992—1994年在高危人群中进行定期筛检的评价研究,筛检组每6个月定期行AFP和B超检测,对照组不作任何检查,中位随访期为1.2年,结果筛选组发现肝癌38例,早期肝癌占76.3%,手术切除率为70.6%,1年、2年生存率分别为88.1%和77.5%;对照组发生肝癌18例,无早期肝癌,手术切除率为0,无一例患者生存期超过1年,两组有显著差异。研究表明,因筛检早期发现而带来的病程延长的平均时间为0.45年。可见肝癌的早期诊断对提高肝癌的生存率非常重要。
3.2 肝癌的遗传相关因素
流行病学研究表明,肿瘤家族史不仅是家族聚集性也是遗传易感性的一种表现。虽然共同生活的环境下,大多数病毒性肝炎患者并未患肝癌,但在遗传易感性的作用下,对肝癌发病的家族聚集性起着重要作用。中国台湾地区对1791个肝癌核心家庭配对调查发现,一级亲属累积患病率为5.37%,二级亲属为2.61%,而对照无肝癌家庭为0.70%,差异有显著性。随着亲缘关系的递减,肝癌的发病危险递减,但仍高于一般人群的发病危险,说明遗传因素在肝癌的发病中起着一定的作用。研究表明,接触同样数量致癌物的个体中,某些生物标志物的水平有高度差异,其中包括遗传易感性生物标志物。
总之,分子流行病学是近年来崛起的一门新学科,应用3种生物标志物对肝癌进行了危险度评估,为预防和筛查肝癌提供了一项客观的指标。
4、诊——肝癌的诊断
4.1 临床表现
肝癌起病隐匿,早期肝癌常没有明显的症状,而中晚期肝癌临床表现常缺乏特异性,例如仅表现为腹胀、消化不良等消化系统症状,容易被忽略或者误诊,对于肝癌高危人群要警惕肝癌的可能。
复旦大学附属中山医院/复旦大学肝癌研究所收集的近30年全国十个省市3250例肝癌临床资料的分析总结表明,患者症状发生率依次为:肝区疼痛64.5%,腹胀15.3%,消瘦6.9%,纳差6.7%,乏力6.2%,上腹部肿块4.7%,发热1.7%,黄疸1.7%,腹泻0.9%,急腹症0.6%;因筛查、体格检查或其他疾病诊治过程中被发现,无症状或无明确肝癌症状者占29.9%。
4.2 疾病史和家族史
肝癌的发病与病毒性肝炎(乙肝/丙肝等)、肝硬化等疾病密切相关,应详细询问患者相关病史。肝癌常有家族聚集现象,应详细询问患者相关家族病史,如肝炎、肝硬化等情况。
4.3 体格检查
一般状况评价、全身浅表淋巴结特别是腹股沟及锁骨上淋巴结的情况。腹部视诊和触诊,检查有无肠型、肠蠕动波,腹部是否可触及肿块;腹部叩诊及听诊检查了解有无移动性浊音及肠鸣音异常。
另外,还可出现肝掌、蜘蛛痣、腹壁静脉曲张等肝硬化表现,少数尚有左锁骨上淋巴结肿大,肝区叩痛等,但多为晚期表现。
4.4 实验室检查
(1)血常规:了解有无贫血、肝癌破裂出血等可能;白细胞、血小板等,早期无明显变化。晚期患者或合并严重肝硬化时,可出现白细胞、血小板减少,增加出血、感染等机会及严重程度。
(7)HBV-DNA:检测HBV复制情况,抗病毒治疗应该覆盖全疗程。
4.5 肿瘤标志物
AFP是胚胎期蛋白,自1964年Tatarinov发现从HCC患者血液中可检出AFP以来,临床和人群筛检已经证明其价值,使肝癌的诊断水平发生了飞跃,现在已经被广泛用于肝癌的临床诊断中。正常情况下,AFP由胚胎期肝脏和卵黄囊合成,存在于胎儿血清中,在胚胎发生阶段大量出现,但是出生后迅速下降,5周后下降至正常水平,以后维持在10 μg/L或以下的成人正常水平。肝细胞恶变后,恶变的细胞又可重新获得该功能,在患者癌组织提取液、血清和腹水中,均可检出AFP,可借此诊断肝癌。据报道28%~87%的原发性肝癌患者血清中AFP明显升高。AFP是目前肝癌诊断和复发监测中最有效且最简便常用的血清肿瘤标志物。在HCC的诊断上,血清AFP的诊断特异性仅次于病理检查,是目前最好的早期诊断指标,并且能够反映病情变化和治疗效果。但大量肝细胞坏死后的肝细胞再生,AFP也会升高。另外,各种急慢性肝炎、肝硬化等,AFP也可有一过性升高,但一般都不会显著升高;孕妇、新生儿及睾丸或卵巢的生殖腺胚胎癌亦可出现AFP的升高,故AFP对HCC仅有相对特异的诊断价值。
其他标志物:目前尚缺乏敏感性和特异性优于AFP的其他肿瘤标志物,联合应用对AFP阴性肝癌的诊断有一定的参考价值,应用比较普遍的有:异常凝血酶原(DCP)、α-L-岩藻糖苷酶(AFU)、γ-谷氨酰转肽酶同工酶(γ-GGT)、铁蛋白(Ferritin)、癌胚抗原(CEA)、糖类抗原19-9(CA19-9)等。
4.6 影像学检查
肝病灶穿刺活检通常在超声或CT引导下进行,可以采用18G或16G肝穿刺空芯针活检获得病灶组织。其主要风险是可能引起出血和肿瘤针道种植转移。因此,术前应检查血小板和出凝血功能,对于有严重出血倾向的患者,应避免肝病灶穿刺活检。穿刺路径应尽可能经过正常肝组织,避免直接穿刺肝脏表面结节。穿刺部位应选择影像检查显示肿瘤活跃的肿瘤内和肿瘤旁,取材后肉眼观察取材的完整性以提高诊断准确性。另外,受病灶大小、部位深浅等多种因素影响,肝病灶穿刺病理学诊断也存在一定的假阴性率,特别是对于直径≤2 cm的病灶,假阴性率较高。因此,肝病灶穿刺活检阴性结果并不能完全排除肝癌的可能,仍需观察和定期随访。对于活检组织取样过少、病理结果阴性但临床上高度怀疑肝癌的患者,可以重复进行肝病灶穿刺活检或者密切随访。
4.7 肝癌的病理学诊断
4.7.1 肝癌病理诊断术语 原发性肝癌统指起源于肝细胞和肝内胆管上皮细胞的恶性肿瘤,主要包括HCC、肝胆管细胞癌(ICC)和肝混合细胞癌(cHCC-CCA)。
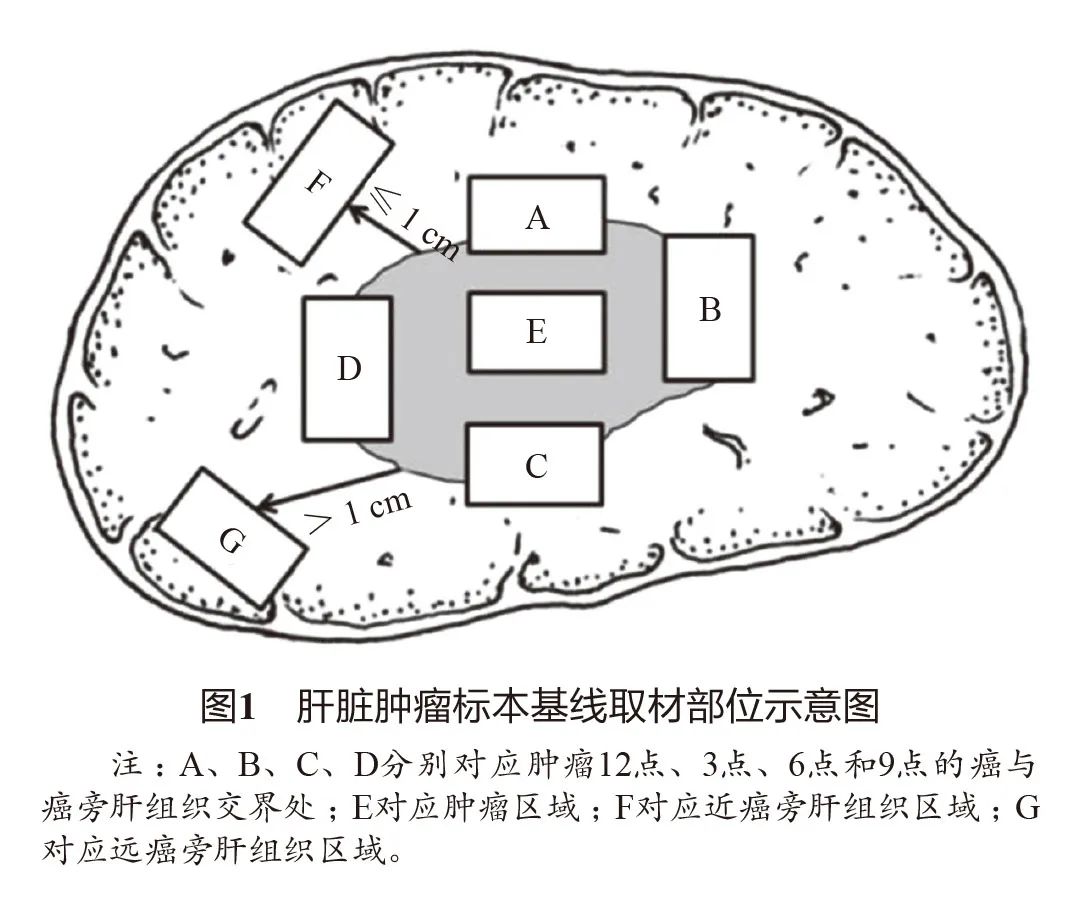
4.7.6 肝癌病理诊断报告 主要由大体标本描述、显微镜下描述、免疫组织化学检查和病理诊断名称等部分组成,必要时还可以向临床提出说明和建议。此外,还可以附有与肝癌克隆起源检测、药物靶点检测、生物学行为评估以及预后判断等相关的分子病理学检查结果,提供临床参考。
4.8 肝癌的临床诊断标准及路线图
结合肝癌发生的高危因素、影像学特征以及血清学分子标志物,依据路线图的步骤对肝癌做出临床诊断(图2)。
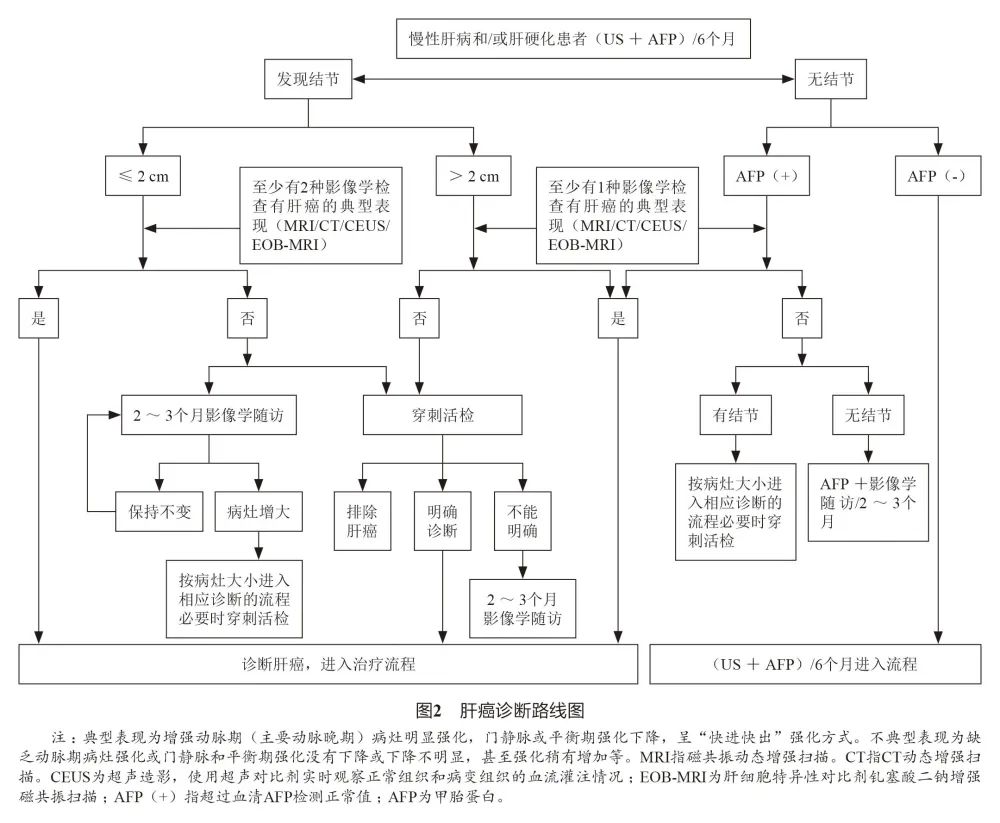
有HBV或HCV感染,或有任何原因引起肝硬化者,如血清AFP升高,特别是持续升高,应进行影像学检查以明确肝癌诊断;若上述4种影像学检查中只要有1项检查有典型的肝癌特征,即可以临床诊断为肝癌;如未发现肝内结节,在排除妊娠、慢性或活动性肝病、生殖腺胚胎源性肿瘤以及消化道肿瘤的前提下,应密切随访血清AFP水平以及每隔2~3个月进行1次影像学复查。
4.9 分期
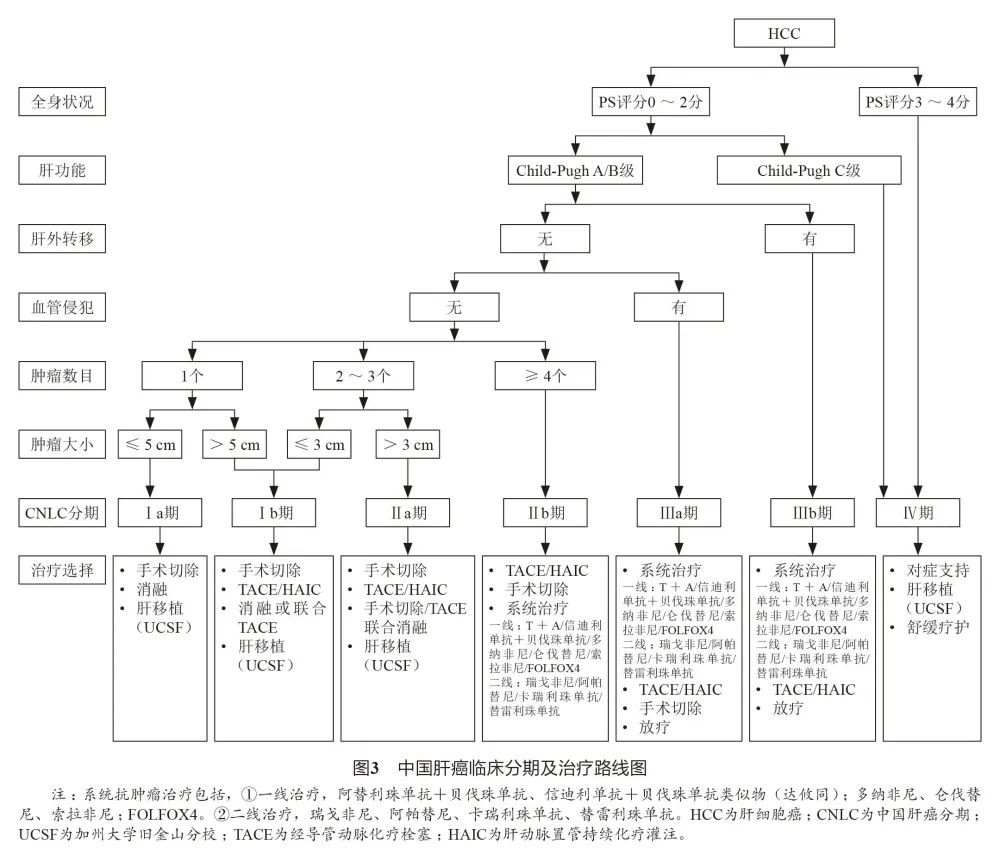
5、治——肝癌的治疗
肝癌治疗领域的特点是多学科参与、多种治疗方法共存,常见治疗方法包括肝切除术、肝移植术、消融治疗、TACE、放射治疗、系统抗肿瘤治疗等多种手段,针对不同分期的肝癌患者选择合理的治疗方法可以使疗效最大化。合理治疗方法的选择需要有高级别循证医学证据的支持。目前,有序组合的规范化综合疗法治疗肝癌的长期疗效最佳,但是基于不同治疗手段的现行分科诊疗体制与实现规范化综合疗法之间存在一定矛盾。因此,肝癌诊疗须重视多学科诊疗团队(MDT)的诊疗模式,特别是对疑难复杂病例的诊治,从而避免单科治疗的局限性,促进学科交流、提高整体疗效。建议肝癌MDT管理应围绕国家卫生健康委员会肝癌诊疗质控核心指标开展工作,但也需要同时考虑地区经济水平以及各医院医疗能力和条件的差异。
5.1 肝癌的外科治疗
肝癌的外科治疗是肝癌患者获得长期生存最重要的手段,主要包括肝切除术和肝移植术。
5.1.6.3 术后辅助治疗 肝癌切除术后5年肿瘤复发转移率高达40%~70%,这与术前可能已经存在微小播散灶或多中心发生有关,故所有患者术后需要接受密切随访。对于具有高危复发风险的患者,两项随机对照研究证实术后TACE治疗具有减少复发、延长生存的效果。另一项随机对照研究结果显示,肝切除术后接受槐耳颗粒治疗可以减少复发并延长患者生存时间。对于HBV感染的肝癌患者,核苷类似物抗病毒治疗不仅能够控制基础肝病,还有助于降低术后肿瘤复发率。对于HCV感染的肝癌患者,直接作用抗病毒药物(DAAs)可以获得持续的病毒学应答,目前没有确凿的数据表明DAAs治疗与肝癌术后肿瘤复发风险增加或降低、复发的时间差异或复发肝癌的侵袭性相关。此外,对于伴有门静脉癌栓患者术后经门静脉置管化疗联合TACE,也可以延长患者生存。尽管有临床随机研究提示,α-干扰素可以减少复发、延长生存时间,但仍存争议。有报道发现,肝癌miR-26a表达与α-干扰素治疗的疗效相关,该结果也有待于进一步多中心随机对照试验证实。术后利用靶向药物和/或免疫治疗的策略正在积极探索中,但目前没有指南和高级别循证医学证据情况下,不建议常规应用上述药物的辅助治疗。一旦发现肿瘤复发,根据复发肿瘤的特征,可以选择再次手术切除、消融治疗、介入治疗、放射治疗或系统抗肿瘤治疗等,延长患者生存。
5.2 肝移植术
5.2.1 肝癌肝移植适应证 肝移植是肝癌根治性治疗手段之一,尤其适用于肝功能失代偿、不适合手术切除及消融治疗的小肝癌患者。合适的肝癌肝移植适应证是提高肝癌肝移植疗效、保证宝贵的供肝资源得到公平合理应用、平衡有/无肿瘤患者预后差异的关键。
肝癌肝移植术后一旦肿瘤复发转移(75%的病例发生在肝移植术后2年内),病情进展迅速,复发转移后患者中位生存时间为7~16个月。在多学科诊疗的基础上,采取包括变更免疫抑制方案、再次手术切除、TACE、消融治疗、放射治疗、系统抗肿瘤治疗等综合治疗手段,可能延长患者生存。免疫检查点抑制剂用于肝癌肝移植术前及术后的治疗仍需慎重。
5.3 局部消融治疗
尽管外科手术被认为是肝癌根治性治疗的首选治疗方式,但由于大多数患者合并不同程度的肝硬化,部分患者不能耐受手术治疗。目前已经广泛应用的消融治疗,具有对肝功能影响少、创伤小、疗效确切的特点,在一些早期肝癌患者中可以获得与手术切除相似的疗效。
5.3.5 肝癌消融与系统治疗的联合 消融联合系统治疗尚处于临床探索阶段。相关研究显示,消融治疗提高肿瘤相关抗原和新抗原释放;增强肝癌相关抗原特异性T细胞应答;激活或者增强机体抗肿瘤的免疫应答反应。消融治疗联合免疫治疗可以产生协同抗肿瘤作用。目前多项相关临床研究正在开展之中。
5.4 TACE
TACE是肝癌常用的非手术治疗方法。
5.5 HAIC
HAIC是一种动脉内灌注化疗的介入治疗方式,我国学者按照EACH研究方案,提出了以奥沙利铂为主的HAIC方案,改进了灌注治疗的方式。初步研究表明,相对于传统的TACE,mFOLF-OX为基础的HAIC治疗可获得较高的肿瘤缓解率和转化切除的机会,对肝癌伴门静脉癌栓患者(CNLCⅢa期)采用HAIC联合索拉非尼治疗疗效明显优于单纯索拉非尼治疗。
5.6 放射治疗
放射治疗分为外放射治疗和内放射治疗。外放射治疗是利用放疗设备产生的射线(光子或粒子)从体外对肿瘤照射。内放射治疗是利用放射性核素,经机体管道或通过针道植入肿瘤内。
5.6.2 质子束放射疗法与内放射治疗 质子束放射疗法对于术后复发或残留肝癌病灶(大小<3 cm,数目≤2个)的疗效与RFA相似。内放射治疗是局部治疗肝癌的一种方法,包括90Y微球疗法、131I单抗、放射性碘化油、125I粒子植入等。RFA治疗肝癌后序贯使用131I-美妥昔单抗治疗,可以降低RFA治疗后局部复发率,改善患者生存。粒子植入技术包括组织间植入、门静脉植入、下腔静脉植入和胆道内植入,分别治疗肝内病灶、门静脉癌栓、下腔静脉癌栓和胆管内癌或癌栓。氯化锶(89Sr)发射出β射线,可以用于靶向治疗肝癌骨转移病灶。
5.7 系统治疗
系统治疗或称之为全身性治疗,主要指抗肿瘤治疗,包括分子靶向药物治疗、免疫治疗、化学治疗和中医中药治疗等;另外还包括了针对肝癌基础疾病的治疗,如抗病毒治疗、保肝利胆和支持对症治疗等。
6、康——全程康复管理
6.1 随访
作为一种常见的恶性肿瘤,肝癌具有易于复发转移的生物学特性,常常需要反复治疗。即使是早期肝癌接受了肝移植、手术切除等根治性治疗之后,仍然有相当比例的患者会出现复发转移。国内资料显示,肝癌行根治性手术后1年、3年和5年复发率为17.1%、32.5%和61.5%,即肝癌切除术后的5年内,有超过一半的肝癌患者出现复发。因此治疗后定期复查和随访是肝癌患者管理中非常重要的组成部分,贯穿肝癌治疗的始终。
对于行姑息性治疗的中晚期肝癌患者,由于患者病情的个体差异较大,主诊医生应结合病情的具体治疗情况妥善安排患者的复查和随访。对于体内仍存在肿瘤病灶的肝癌患者,复查的影像学多需要行增强CT/MRI检查以准确评估病情发展,但过多的此类检查不仅给患者身体带来不利影响,费用也较高。一般建议治疗阶段每4~6周复查,治疗稳定阶段每2~3个月复查增强CT/MRI,扫描部位应包含已知存在病灶的部位。行影像学检查的同时,还应同时对血液学指标、患者出现的治疗相关不良反应进行监测,对异常者及时做出处理,必要时可建议患者转肝病专科医院行护肝、对症支持,以最大限度地延长患者生存时间,提高患者生活质量。
6.2 全程康复管理
6.2.1 肝癌患者的维持治疗
7、附录
附录一 证据等级(GRADE系统)(表1)

附录二 肝癌的新型标志物与分子分型介绍

附录三 原发性肝癌及相关病变的诊断名词
参照2019版WHO分类标准(表2~表4)。



附录四 原发性肝细胞癌诊断报告模板(表5)

附录五 门静脉癌栓分型
程氏分型:
VP4,门静脉癌栓侵犯门静脉主干或对侧一级分支。
附录六 经导管动脉化疗栓塞治疗进展
HAIC作为一种动脉内灌注化疗的介入治疗方式,目前尚未形成统一治疗技术标准,疗效差异较大。日本多中心、RCTⅡ期临床试验研究(SCOOP-2试验)对比顺铂HAIC序贯索拉非尼与标准索拉非尼单药治疗晚期HCC患者,结果显示HAIC联合治疗组的中位生存期为10个月,对比索拉非尼单药治疗组的15.2个月,疗效不理想。HAIC联合治疗组中有23%的患者由于一般状况恶化而无法在HAIC后接受任何进一步的治疗。多中心随机Ⅲ期试验(SILIUS试验)除证实了该前瞻性随机Ⅱ期试验的阴性结果外,还测试了不同的HAIC方案(低剂量顺铂-氟尿嘧啶)联合索拉非尼对比索拉非尼单药治疗日本晚期HCC患者,同样为阴性结果。因此,多数日本专家讨论意见:单独化疗或联合靶向药均无可证实的疗效,HAIC不宜作为晚期肝癌的治疗方式。近年来我国学者采用mFOLFOX为基础的灌注方案使HAIC疗效得以提高。有研究表明,HAIC治疗对于多次TACE治疗产生抵抗、肝癌伴门静脉癌栓、外科术后存在高危复发、肝外转移的肝癌患者,疗效优于索拉非尼治疗;对肝癌伴门静脉癌栓患者(CNLCⅡ-Ⅰa期)采用HAIC联合索拉非尼治疗疗效明显优于单纯索拉非尼治疗。与TACE类似,mFOLFOX-HAIC对部分肿瘤最大径>7 cm,初始不适合外科手术切除的肝癌患者,有助于转化,但一般建议连续完成4次或以上的HAIC治疗才能达到转化治疗的机会。
TACE预后的术前预测模型:①“six-and-twelve”模型:即肿瘤大小+数量之和≤6,>6且≤12,>12。该模型对接受TACE治疗的肝癌患者进行个体化预后评估和危险分层,患者的风险分层不同,其中位生存时间差异显著。因此,使用“six-and-twelve”模型,能为肝癌患者TACE术前提供术后预期生存的参考值,辅助患者选择不同的治疗方式。②TACE的预后列线图模型:包含门静脉侵犯、肿瘤数目、肿瘤包膜、血清AFP、AST、ICG 15 min滞留率等因素。该模型经868例肝癌患者验证,其预测生存相关的C-指数达0.755。因此,使用上述两种模型能为肝癌患者TACE术前提供术后预期生存的参考值,辅助患者选择不同的治疗方式。③“TACE-predict”模型:是针对肝癌TACE人群,可在术前应用并在术后再次校准的个体化预后评估和危险分层模型。研究发现,肿瘤数目与直径、AFP、白蛋白、胆红素、血管侵犯、病因是TACE术前患者的预后因素;肿瘤数目与直径、AFP、胆红素、血管侵犯及影像学应答是TACE术后患者的预后因素。据此建立了Pre-TACE-Predict模型和Post-TACE-Predict模型,该模型可分别在TACE术前和术后计算患者生存概率。Pre-TACE-Predict模型和Post-TACE-Predict模型的预测能力优于HAP和mHAPⅢ评分。Post-TACE-Predict模型能够在术后对患者进行进一步预后评估和危险分层,并有助于辅助TACE后续的治疗决策,对指导临床实践具有重大意义。
TACE/HAIC联合分子靶向、免疫治疗:TACTICSⅡ期临床研究表明,TACE联合索拉非尼对比单纯TACE,联合组的PFS时间明显改善(22.8个月∶13.5个月;P=0.02),但最终OS未达到统计学差异(36.2个月∶30.8个月;P=0.40)。TACE/HAIC等可能影响肿瘤微环境,联合分子靶向药物或免疫治疗等已经显示出良好的治疗前景,但目前多为小样本,循证医学级别不高的研究,尚需要多中心、大样本、高质量的临床研究进一步明确。
附录七 肝癌外放射治疗正常组织具体耐受剂量参考
立体定向放疗:①肝功能Child-Pugh A级,放疗分次数3~5次,正常肝体积[肝脏体积-大体肿瘤体积(GTV)]>700 ml或>800 ml,liver-GTV平均剂量分别<15 Gy或<18 Gy;放疗分次数6次,Liver-GTV体积>800 ml,平均剂量<20 Gy;每次肿瘤分割剂量4~8 Gy,liver-GTV平均剂量<23 Gy为安全剂量。②亚洲肝癌患者常伴有肝硬化和脾功能亢进,导致胃肠道瘀血和凝血功能差,胃肠道的放射耐受剂量低于RTOG推荐的剂量;目前文献及专家共识认为,放疗分次数3~5次,胃和小肠最大剂量均应<22.2~35 Gy,最佳<30 Gy。③放疗分次数3~5次,双肾平均剂量最佳<10 Gy,脊髓最大剂量<21.9~30 Gy,最佳<18~23 Gy。
常规分割剂量放疗:①肝功能Child-PughA级,liver-GTV平均剂量<28~30 Gy;肝功能Child-Pugh B级者,肝脏对射线的耐受量明显下降,最佳<6 Gy,避免肝功能Child-Pugh C级患者行肝区放疗。②胃和小肠最大剂量均应<54 Gy,胃V45<45%,小肠V50≤5%。③双肾平均剂量≤15 Gy,如一侧肾脏平均剂量大于19 Gy,则另一侧肾脏尽量避开;脊髓最大剂量<45 Gy。
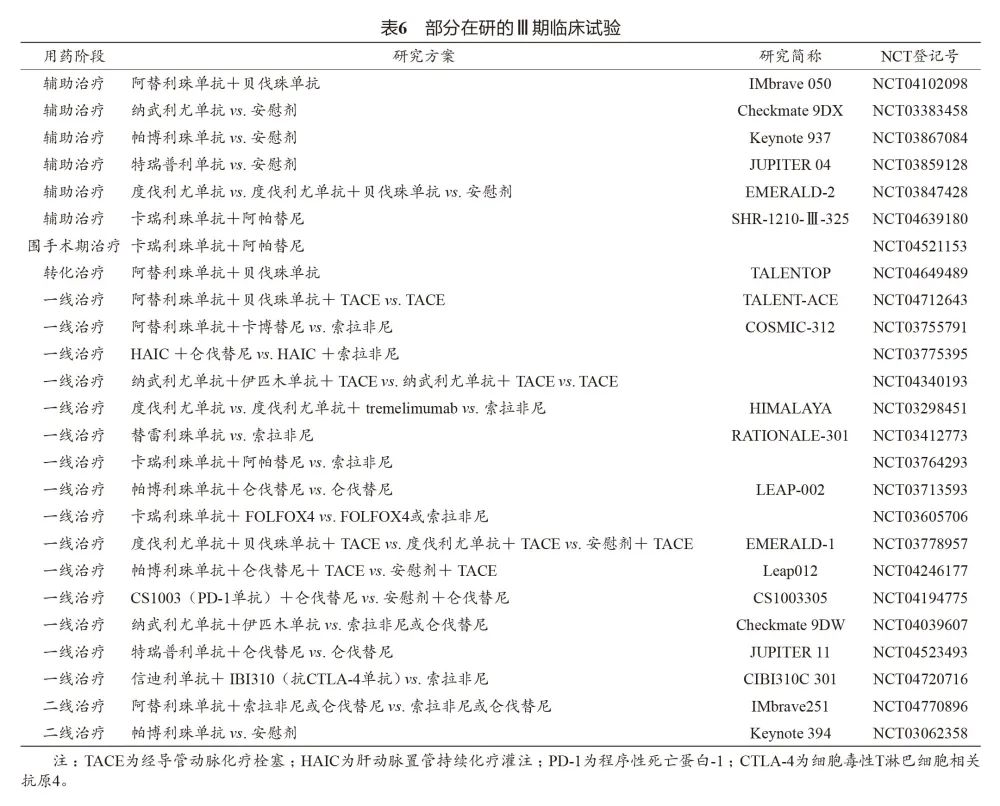
附录八 正在进行与免疫检查点抑制剂有关的研究(部分)
1、已经完成的研究(部分)
参考文献(略)
《中国肿瘤整合诊治指南(CACA)-肝癌部分》
编撰小组成员
主 编
陈敏山
名誉主任委员
汤钊猷 刘允怡 陈孝平 王学浩 孙 燕
郑树森 董家鸿 滕皋军 窦科峰
主任委员
樊 嘉
副主任委员
秦叔逵 蔡秀军 周 俭 沈 锋 王伟林
蔡建强 李 强 陈敏山 孙惠川
委员(以姓氏笔画为序)
王 征 王 葵 王 鲁 王文平 王文涛
王志明 王茂强 王建华 王晓颖 云径平
毛一雷 文天夫 尹震宇 石 明 石洪成
卢实春 叶胜龙 史颖弘 代 智 白雪莉
丛文铭 匡 铭 邢宝才 成文武 吕国悦
朱继业 朱康顺 任正刚 任伟新 向邦德
刘 嵘 刘天舒 刘连新 刘秀峰 刘瑞宝
纪 元 花宝金 严福华 李 汛 李 秋
李 涛 李亚明 李晔雄 杨 春 杨云柯
杨业发 杨甲梅 杨建勇 肖永胜 吴志峰
别 平 宋天强 张 岚 张 倜 张水军
张必翔 张艳桥 张博恒 张雷达 张耀军
陆骊工 陈 敏 陈卫霞 陈拥军 周乐杜
周伟平 郑红刚 孟志强 赵 明 赵永福
荚卫东 侯金林 施国明 徐 立 徐建明
郭文治 郭亚兵 陶开山 黄晓武 梁 军
梁 萍 梁长虹 彭 涛 韩国宏 程树群
曾 勇 曾昭冲 曾蒙苏 蔡定芳 颜志平
戴朝六
百度浏览 来源 :
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)