2022-09-01 来源 : VIP说

8月30日晚,君实生物(688180.SH/1877.HK)披露了2022年度中期业绩报告。上半年,公司实现收入总额约9.46亿元。其中,核心产品PD-1特瑞普利单抗销售收入约为2.98亿元,较2021年下半年环比增长约195.93%。
国内疫情反复,但特瑞普利单抗在今年前两个季度的表现仍然稳中有升,销售环比逐季改善。这是疫情之下,中国生物医药企业中很不容易的进步。
君实生物这份中报看似平淡,实则蕴藏了不少逆风翻盘的关键信息。无论是公司商业化团队调整后的国内表现、“出海”国际化的进展,还是拟A股增发的募资重点肿瘤研发管线的布局都颇具看点。
顺境时的意气风发人人看好,但在逆境中能有韧性和自我调整能力,谋求未来长远的布局和投入,这是公司对未来发展高度和价值的自信体现。

PD-1收入其实有显著增长
君实生物的PD-1特瑞普利单抗在国内的销售已经释放出一些积极的信号。
今年上半年,君实已完成对商业化团队的调整,对核心市场人员进行了补充。截止6月,公司商业化团队超过1100人。
从配置来看,李聪作为公司联席首席执行官,全面负责商业化工作。商业化部门下设的各个职能团队人员都具备丰富的创新药和肿瘤领域药品推广和商业化经验。国内各区域销售总监均有跨国药企的任职经历,拥有十多年的抗肿瘤创新药物推广经验,带领过的产品有吉非替尼、索拉非尼、贝伐珠单抗、利妥昔单抗等,无一不是应用广泛的抗肿瘤药物。
君实商业化团队的重整颇受外界关注,可以看到,新的销售团队给特瑞普利单抗的商业化带来了明显的起色。

分季度来看,一季度君实生物营收约6.3亿元,其中PD-1的收入为1.1亿元,环比增长211.69%;二季度上海、吉林等多地销售推广活动和物流受到较大影响,但PD-1仍然保持了进一步增长,实现销售收入1.88亿元,环比增长70.91%。而且6月份的销量比4、5月有明显提升,显示出君实PD-1国内销售已逐步恢复并进入正向循环。
顶住了疫情的影响之后,特瑞普利单抗最大的机会,来自于大适应症逐步进入收获期。
PD-1是公认的广谱抗肿瘤产品,君实在该产品的适应症拓展上采取的是“小适应症+大适应症”、“从末线适应症切入,快速推进到一线和围手术期治疗”的策略。
今年5月,特瑞普利单抗联合紫杉醇和顺铂用于不可切除局部晚期/复发或远处转移性食管鳞癌患者的一线治疗的新适应症获批。这是继黑色素瘤、鼻咽癌、尿路上皮癌之后,特瑞普利单抗在中国获批的第五个适应症,也是首个大适应症。
同时,特瑞普利单抗一线治疗非小细胞肺癌的适应症也正处于审评阶段,另外,还多个适应症处于III期临床阶段,包括发病率较高的肺癌、肝癌、乳腺癌等。
2022—2023年,君实生物有望迎来特瑞普利单抗大适应症的收获期。此外,特瑞普利单抗还前瞻性地布局了非小细胞肺癌、肝癌、胃癌及食管癌的围手术期/术后辅助治疗,进度国内领先。
与此同时,君实生物也有着强大的产能后盾。今年5月,君实上海临港生产基地获得批准,特瑞普利单抗新增30000升商业化产能。这使得君实能够以更具竞争力的成本优势冲击市场,也为管线上其他在研产品做好了充分的产能储备。
数据来源:君实生物2022中报业绩
商业化团队逐步稳定、国内疫情情况缓解、特瑞普利单抗大适应症陆续进入商业化获批阶段,尤其是食管鳞癌、肺癌等,这些都有利于特瑞普利单抗在国内的销售进一步改善。
在产品上,2022年3月君实新添了一项重磅商业化产品:“药王”阿达木单抗用于治疗类风湿关节炎、强直性脊柱炎及银屑病的3个适应症获得NMPA批准。8月,阿达木单抗用于治疗克罗恩病、葡萄膜炎、多关节型幼年特发性关节炎等5项适应症的补充申请也获得了NMPA受理。
此外,君实管线上还有多个品种临近商业化,如PARP抑制剂、昂戈瑞西单抗、贝伐珠单抗处以及VV116均处于III期临床试验阶段。这些产品有望为君实带来新的收入增长点。

“出海”仍存增量机会
君实是国内最早启动国际化战略的创新药企之一,海外商业化也有望带来持续的市场增量。
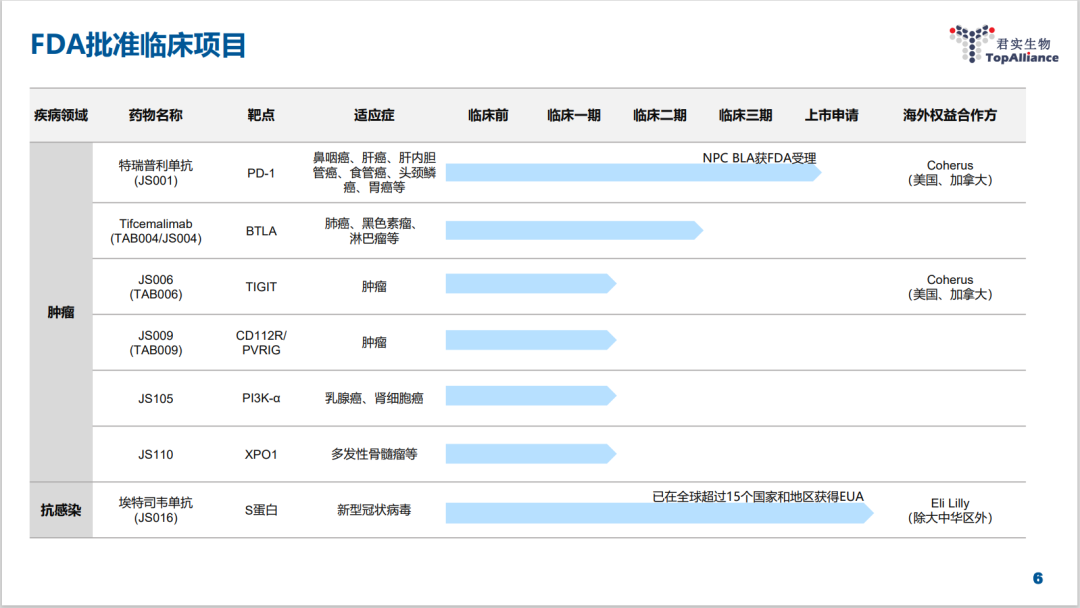
特瑞普利单抗是中国首个向FDA提交上市申请的国产PD-1。目前特瑞普利单抗联合吉西他滨/顺铂作为晚期复发性或转移性鼻咽癌的一线治疗和单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗两项BLA(生物制品许可申请)正在FDA的审评中。
按照FDA的规定,上述适应症的最终审评日期是2022年12月23日。届时,如果特瑞普利单抗能获批在美国上市,君实将与北美商业化合作伙伴Coherus在2023年第一季度就组织美国市场推广,届时,特瑞普利单抗将成为美国首个且唯一用于鼻咽癌治疗的肿瘤免疫药物。
数据来源:君实生物2022中报业绩
值得一提的是,今年4月,特瑞普利单抗用于治疗小细胞肺癌获得FDA颁发孤儿药资格认定。随后在7月,特瑞普利单抗用于治疗鼻咽癌又获得欧盟委员会授予的孤儿药资格认定。
到今年上半年,特瑞普利单抗累计获得欧盟和美国药品监管机构授予6项孤儿药资格认定、2项突破性疗法认定、1项快速通道认定,这将进一步加速君实生物这款PD-1的“出海”进程。
早在PD-1之前,君实其实在海外商业化方面已有成功经验,收获到了中国创新药“出海”的果实。君实生物参与研发的新冠中和抗体埃特司韦单抗(JS016)与礼来的巴尼韦单抗组成双抗体疗法,已经在全球超过15个国家和地区获得紧急使用授权,君实与礼来的许可协议中约定的所有里程碑事件也都达成。
2021年,君实收到来自礼来制药的技术许可及特许权使用费达23.66亿元。
君实选择跨国药企Coherus作为PD-1北美市场的商业化合作伙伴,已经获得了1.5亿美元首付款,里程碑款累计不超过3.8亿美元。预计在特瑞普利单抗获FDA批准上市后,君实可获得销售净额20%的分成,增量空间巨大。

全世界范围看,肿瘤患者数量庞大,且发病率呈上升趋势,目前仍存在巨大未满足的临床需求。
作为“兵家必争”的热门疾病领域,国内肿瘤市场的竞争将是长期、综合的较量,而不是一年两年的短兵相接。自主研发能力是立身之本,企业需要有新产品、新技术持续迭代的能力及差异化的研发管线。在此之上,还需要积极探索药物联用,实现产品间的高效协同,方能应对激烈的市场竞争。
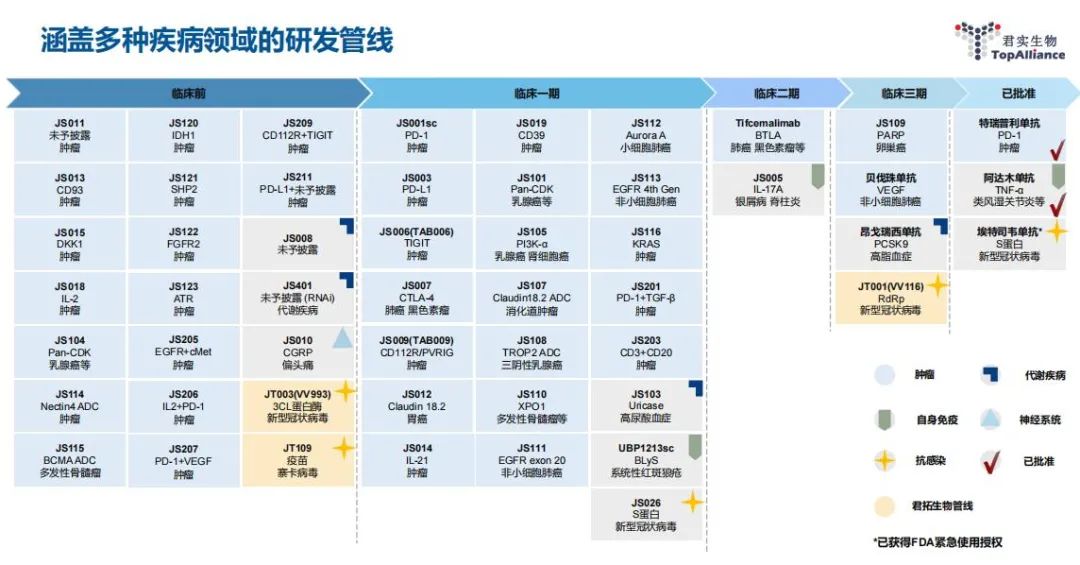
君实的研发管线中有超过50项候选药物,其中约80%为抗肿瘤产品。今年上半年,君实生物公布的定向增发预案,拟募资近40亿元,主要投向抗肿瘤创新药的研发项目,包括多个处在早期研究的新靶点肿瘤药,计划继续扩大肿瘤免疫疗法的可受益人群和治疗疗效。
其中,君实计划投入8.6亿元用于特瑞普利单抗的后续境内外研发,包括胃或胃食管结合部腺癌、晚期肝内胆管癌等适应症。另外投入8.65亿元用于抗BTLA单抗tifcemalimab,投入5.05亿元用于抗TIGIT单抗JS006的境内外研发,还有特瑞普利单抗和其他新药的联用项目。
君实生物不仅在管线宽度上做好布局,更在厚度上做了充分的考虑。PD-1是肿瘤免疫治疗的基石类药物,君实的抗肿瘤研发管线注重通过协同互补,解决肿瘤免疫现有的原发性耐药和获得性耐药问题。
君实生物正在积极探索免疫检查点抑制剂之间“IO+IO”的联用,以及IO药物与多种技术类型产品的联合,包括小分子、ADC药物等,以期多维度打击肿瘤。
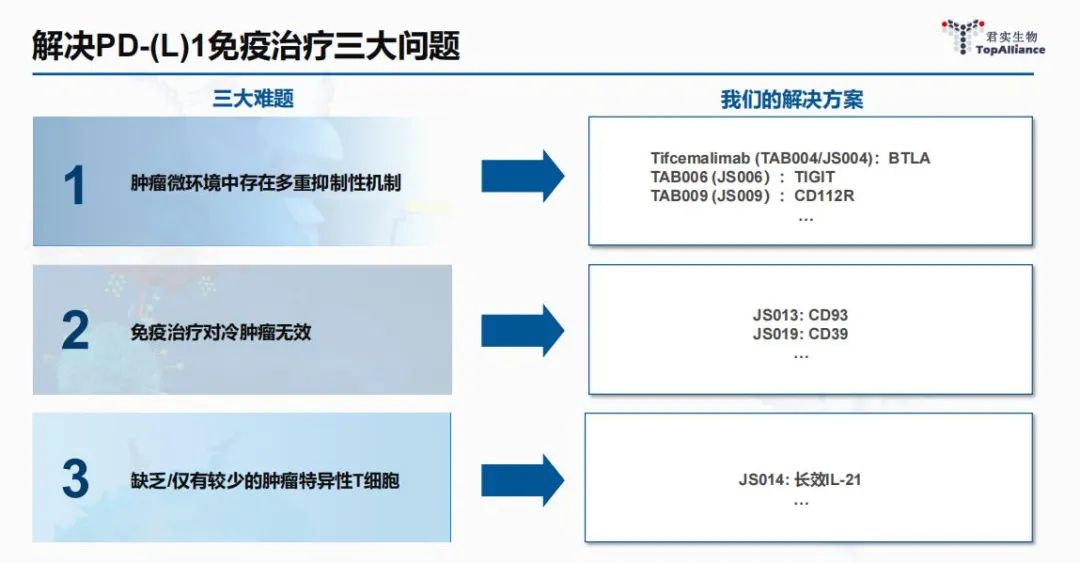
比如,为解决PD-1治疗后耐药问题,君实积极探索根据患者免疫微环境特点设计合理的联合治疗策略,布局了抗BTLA单抗、抗TIGIT单抗、抗CD112R单抗等与特瑞普利单抗联合的治疗方案。
数据来源:君实生物2022中报业绩
再比如,为解决肿瘤免疫治疗中冷肿瘤的问题,君实针对免疫微环境微循环血管正常化开发了靶向微环境微血管高表达的抗CD93单抗、抗CD39单抗等多个项目。
为解决很多病人缺乏或只有很少的肿瘤特异性T细胞,无法对免疫治疗产生应答的问题,君实在管线中布局了长效IL-21等产品,可从源头激活T细胞,与特瑞普利单抗具有良好的协同效应。
君实布局的抗肿瘤药物研发矩阵中,不乏潜在first-in-class或者best-in-class药物。
Tifcemalimab就是君实首款first-in-class产品,内部编号为JS004,君实正组织中美两地进行Ib/II期试验,目前全球尚无同靶点抗肿瘤产品进入临床试验。今年6月初,tifcemalimab在美国临床肿瘤学会上首次公布了淋巴瘤与实体瘤治疗数据,安全性良好,疗效初显。
君实募投项目中布局的部分小分子抗肿瘤药物,如JS110、JS111、JS112等,都是很有潜力的品种。
探索创新药物组合,多维度打造的抗肿瘤药物矩阵,解决患者更多未满足临床需求的同时,不断增强君实在肿瘤免疫领域的核心竞争力。这是君实未来持续为投资者创造惊喜的基本盘。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)