2022-09-19 来源 : 芒果师兄聊生信 ,作者阿拉丁神灯Mango
前沿文献是锻炼科研思维的最好方式,而综述则是了解前沿进展的最好途径。

Adaptive immune resistance at the tumour site: mechanisms and therapeutic opportunities. Nat Rev Drug Discov. 2022 Jul;21(7):529-540. doi: 10.1038/s41573-022-00493-5. Epub 2022 Jun 14. PMID: 35701637.
肿瘤部位的适应性免疫抵抗:机制和治疗机遇。肿瘤采用各种策略来适应并抵抗免疫攻击。这些机制统称为适应性免疫抵抗(AIR, Adaptive immune resistance)。
第一个定义和验证的AIR机制是干扰素-γ在肿瘤中选择性诱导表达的程序性细胞死亡1配体1(PD-L1)。抗体阻断PD-L1与其受体PD-1的结合(抗PD治疗)已使部分晚期癌症患者,尤其是实体瘤患者的病情缓解。然而,许多将抗PD治疗与其他抗肿瘤药物相结合的临床试验在没有强有力的机制原理的情况下进行,未能确定协同或相加效应。在这篇前瞻性文章中,我们讨论了为什么定义肿瘤部位的适应性免疫抵抗机制是指导未来药物开发的关键,以及改进当前癌症治疗的实用方法。
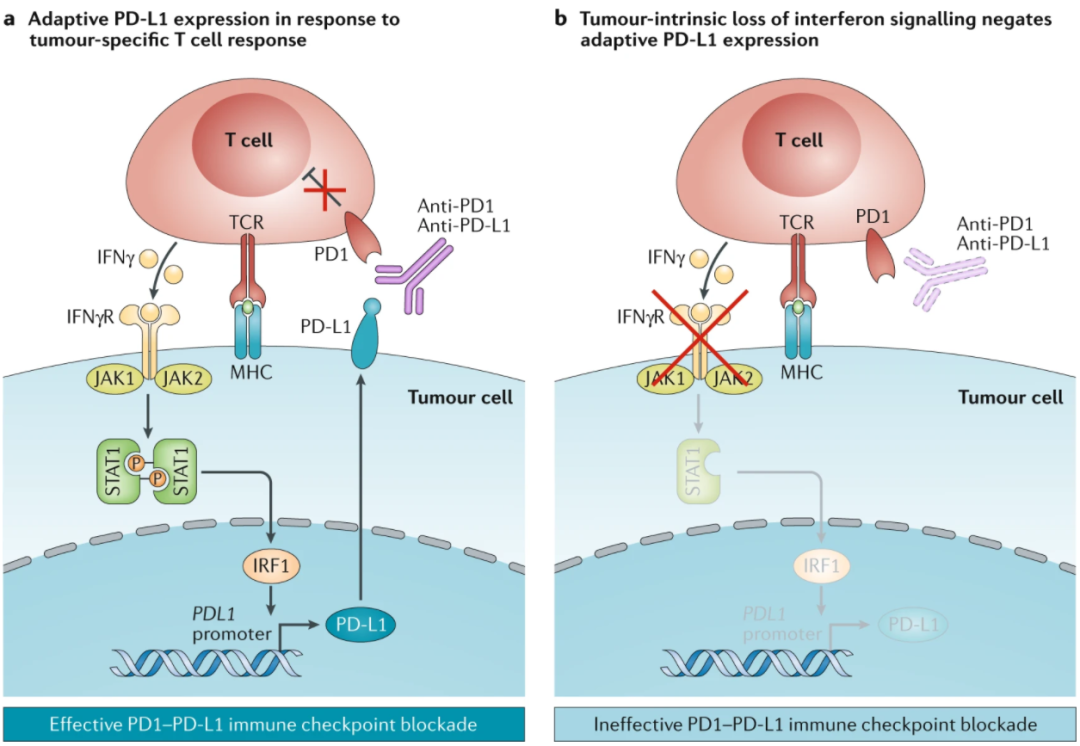
引言
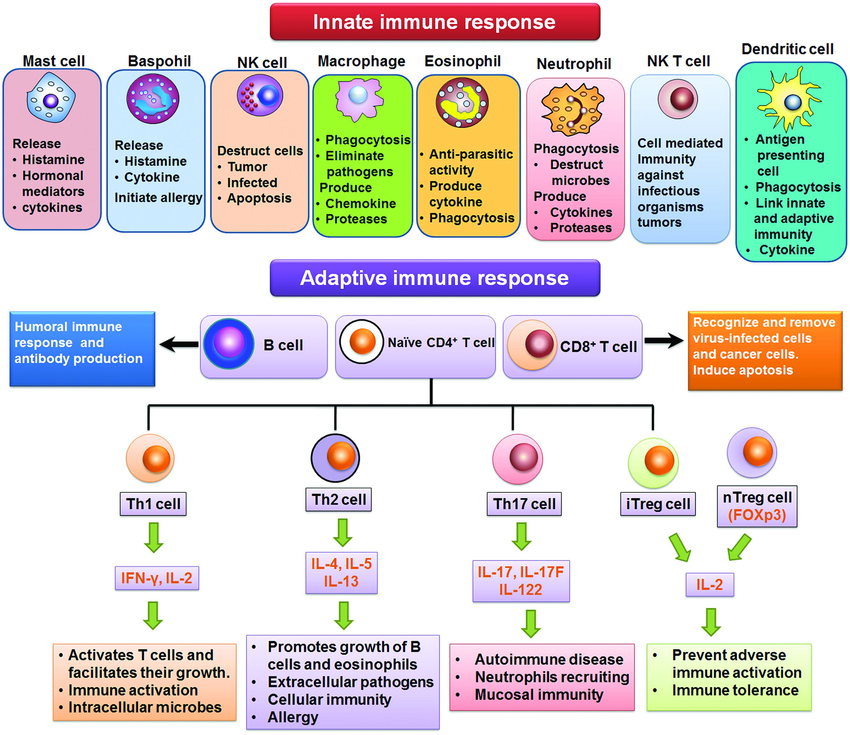
免疫反应可以识别、应答和消除肿瘤细胞。然而,在肿瘤进展过程中,各种细胞和分子演变,特别是在肿瘤部位,以适应免疫环境的变化,并最终克服免疫攻击,使肿瘤细胞持续地生长。这些机制被统称为“适应性免疫抵抗”(AIR),是肿瘤细胞长时间适应并能够多样化的结果,导致不同甚至相同病理类型的人类癌症具有显著的异质性。

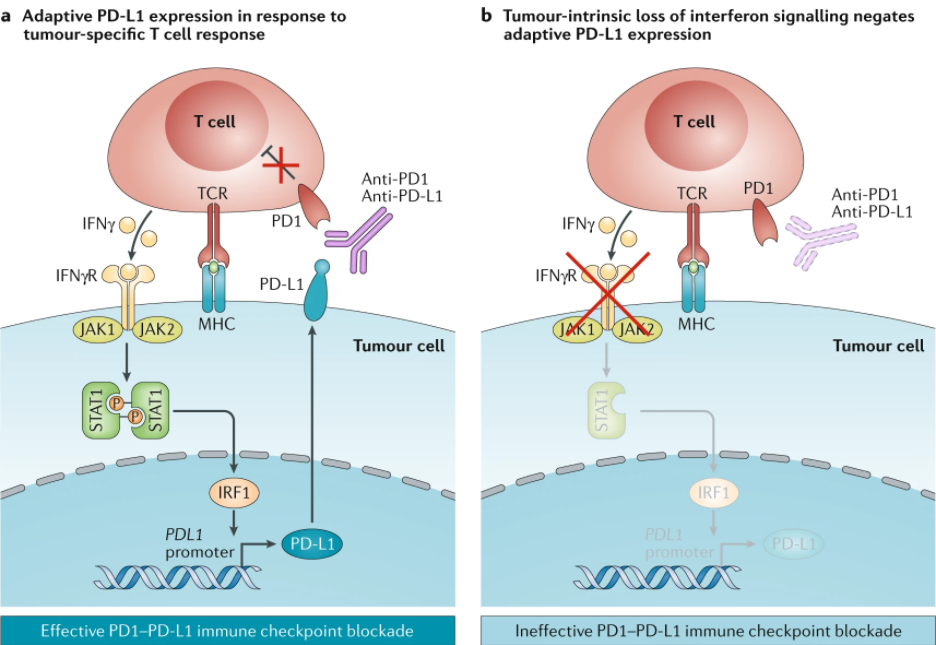
第一个明确定义并经治疗验证的AIR是选择性诱导程序性细胞死亡1配体1(PDL1),该配体于1999年克隆并在功能上表征为B7同源物1,B7-H1(参考文献1)。一年后,B7-H1被鉴定为PD1的配体,并被命名为PDL1(参考文献2)。随后的研究阐明PD1/PDL1通路在逃避肿瘤免疫中作为主要机制的作用。首先,PDL1在肿瘤组织中主要由γ干扰素(IFNγ)诱导 3。由于IFNγ主要由完全分化的效应T细胞产生,这一发现表明PDL1的表达可能是抗肿瘤免疫的结果。其次,Cd274(编码PDL1)的基因敲除不会在小鼠4中引起重大生理异常或自身免疫性疾病,这表明这种负反馈机制在生理上不是必需的,但在很大程度上是由肿瘤生长和随后的肿瘤免疫诱导的。免疫反应的这种矛盾作用揭示了AIR机制的复杂性,了解共同抑制分子在免疫逃避中的作用导致了单克隆抗体(mAbs)阻断PD1和PDL1的临床应用,本文称之为抗PD治疗。
关于免疫反应不能消除肿瘤的传统观点是,假设针对肿瘤抗原的T细胞介导免疫反应不足 5。在这种假设下,提高免疫反应超过一定阈值的各种方法成为中心目标。这些努力包括细胞因子治疗(例如使用干扰素或IL-2)、肿瘤疫苗、过继细胞治疗和免疫检查点阻断(例如细胞毒性T淋巴细胞相关蛋白4(CTLA4)抗体)。这一传统观点受到了几项临床前和临床观察的挑战,这些观察表明,通过这些方法简单地增强免疫反应并不总是与临床反应相关。换句话说,通过检测肿瘤患者血液中的免疫细胞和分子证明,增强的免疫反应与现有肿瘤的消除不成比例相关 6,7,8,9。
目前,有充分证据表明,对肿瘤抗原的免疫反应可以在肿瘤部位以外的远端淋巴器官中产生,而肿瘤微环境(TME)中这种免疫的执行和重新刺激通常在肿瘤中受损,从而限制有效的抗肿瘤免疫。基于对抗原的T细胞介导免疫反应的普遍增强的免疫治疗方法(统称为“免疫增强剂”)面临着与其他传统肿瘤治疗方法(如化疗)类似的问题,如有效性有限 10和毒性高 11,12,还有一个问题是免疫增强剂的适应症通常相对狭窄 11,13。
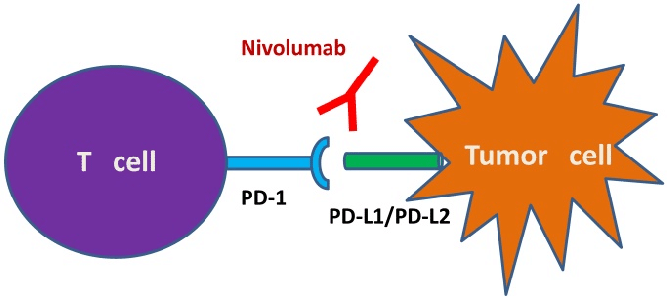
PDL1在肿瘤细胞上选择性表达的发现、TME中PDL1上调的机制以及PD1–PDL1通路在TME 14,15中对免疫逃避的贡献已成功转化为临床应用 1,3,16,17,18,19,20,21。阻断该途径的单克隆抗体主要改善TME中的免疫反应,与其他免疫治疗方法相比,可以诱导持久、更有效和TME选择性的抗肿瘤反应,且免疫相关不良事件更少。2014年,FDA批准PD1单抗彭布罗利珠和nivolumab治疗晚期黑色素瘤,并于2015年将其作为非小细胞肺癌(NSCLC)的二线治疗。自那时起,到2020年,FDA22已批准pembrolizumab 和nivolumab以及PDL1单抗atezolizumab 和durvalumab治疗实体瘤或血液恶性肿瘤的20多个适应症。
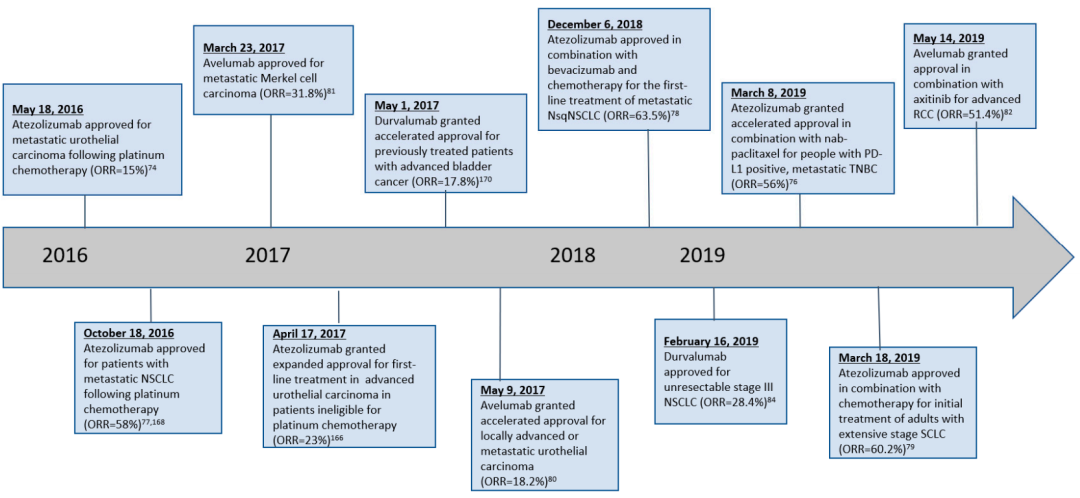
基于抗PD治疗的肿瘤免疫治疗已成为治疗晚期人类癌症,特别是难治性实体瘤的中心阶段。有明确临床证据表明,抗PD治疗在一部分患者中是有效的,甚至是治愈的。尽管制药行业、临床医生和研究人员一直致力于改进这种疗法,主要是通过与现有疗法相结合。但目前为止,这些重大努力只取得了微小的进展。
在这篇前瞻性文章中,我们希望传达这样一个信息,即承认在肿瘤患者亚群中存在AIR机制,而不是仅仅依靠联合临床试验,将指导未来更有效的肿瘤免疫治疗。
----果友Naughty boy----
通过研究人类在正常和肿瘤状态下的PDL1,我们可以了解到适应性免疫抵抗几个重要特征。
第一,虽然PD1在血液和TME中活化T细胞上广泛表达,但在T细胞到达并由抗原识别激活前,TME中没有发现PDL1。该特征使得PDL1在TME中选择性表达。作为例外,某些肿瘤表达PDL1却没有明显T细胞浸润(称为IV型肿瘤,见下文)。
第二,在没有全身免疫抑制情况下,PDL1的表达可能会损害TME的免疫功能。肿瘤细胞上PDL1通过使激活的T细胞死亡 3或功能障碍 23,或通过使肿瘤细胞对T细胞杀伤更具抵抗力而使其对T细胞介导的破坏产生抵抗力 24。
第三,尽管已经有各种免疫抑制机制被阐述,并且这些机制可以在TME中共存,但PD1-PDL1通路似乎是某部分晚期肿瘤患者的主要适应性免疫抵抗机制,单用抗PD治疗可以在这一部分患者中发挥治疗作用。

适应性免疫抵抗机制不同于一般的免疫抑制机制,通常被称为免疫检查点,如CTLA4受体介导的机制,因为CTLA4是抑制健康个体内在自身反应所必需的,这一机制主要是通过控制调节性T细胞来实现的。另一个例子是转化生长因子-β(TGF-β),它除了在正常的动态平衡机制中发挥广泛作用外,还抑制不必要的炎症和自身免疫,包括伤口愈合、血管生成和细胞生长。
除了PD1-PDL1通路外,TME中还存在其他适应性免疫抵抗机制,因为并不是所有表达PDL1的肿瘤都可以通过抗PD治疗来消除 25,并且许多肿瘤是在缺乏PDL1表达的情况下由功能失调的肿瘤浸润性淋巴细胞 (TIL)浸润的 26。最近一个例子是Siglec-15,它主要是在PDL1-TME中髓系细胞和肿瘤细胞上表达上调 27。
此外,超过一半的人类肿瘤是所谓的‘冷肿瘤’,在病理分析上没有明显的炎症和免疫反应;这些肿瘤也可能有独特的适应性免疫抵抗机制,以排除TME中的免疫渗透 28。因此,晚期人类肿瘤似乎可以同时或按顺序通过多种适应性免疫抵抗的机制来逃避免疫系统的攻击,而我们对人类肿瘤适应性免疫抵抗的理解仍处于初级阶段。
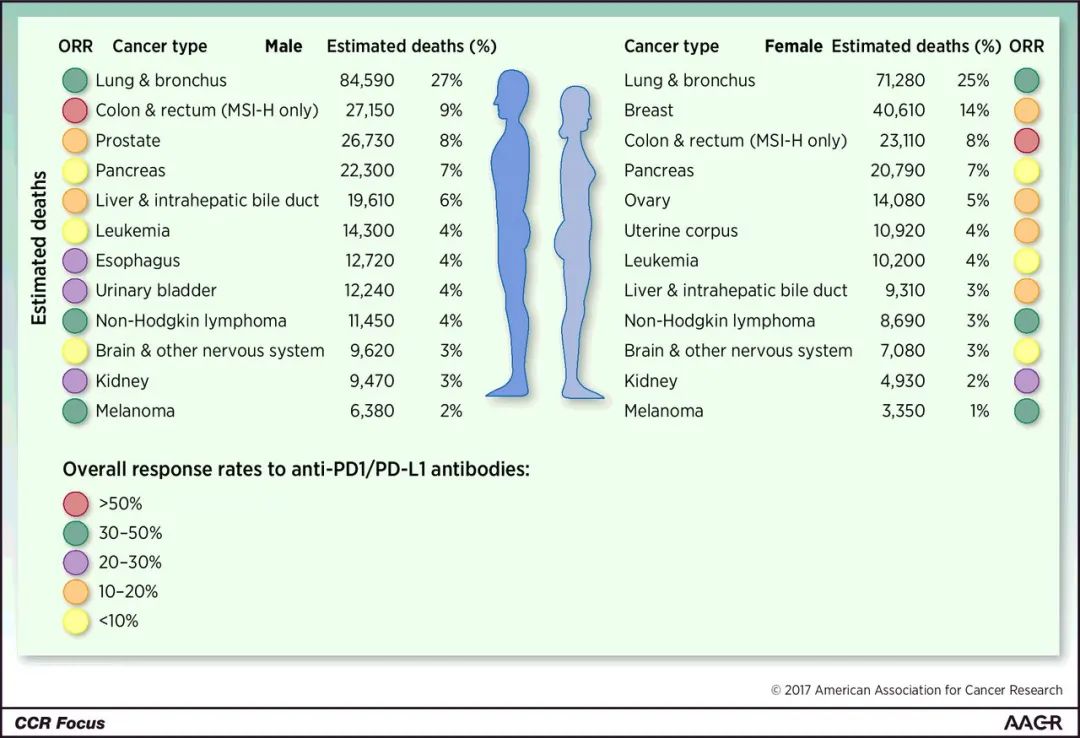
适应性免疫抵抗的分类
据估计,平均有25%的实体瘤患者和40%-60%的某些淋巴瘤患者对当前的抗PD治疗有反应 29-42。然而,客观反应率(ORR)在不同类型的肿瘤中是不同的 43,44。例如,帕博利珠单抗(pembrolizumab)在皮肤Merkel 细胞癌中的客观缓解率为56% 45,在晚期黑色素瘤患者中为45%,但在晚期非小细胞肺癌中约为20%,在胃-食道交界癌中仅为16% 36。对黑色素瘤、肾透明细胞癌和肺癌的长期生存研究表明,5年生存率与良好的ORR直接相关 46。在进行治疗前,准确识别哪些患者会有反应,哪些患者不会有反应,是很重要的。仅检测肿瘤中肿瘤细胞或免疫细胞上PDL1的表达,高估了被认为对抗PD治疗有反应的患者数量,并且该检测方法已被FDA批准为抗PD治疗试验的纳入标准,如用抗PDL1抗体SP142(VENTANA检测)或22C3(DAKO检测)做免疫组化检测 31,47-50。根据适应性免疫抵抗的机制,猜测只有在TME中表达PDL1并且肿瘤被PD1+T细胞,特别是CD8+ T细胞渗透的患者 3,26,抗PD治疗才有效。这种基于机制的预测,尽管还没有得到广泛的验证,但已得了临床研究的支持 26,51。

基于肿瘤免疫微环境(TIME),陈列平团队提出了四种不同的肿瘤类型来更好的定义肿瘤的免疫状态,进而预测肿瘤对抗PD治疗是有反应,无反应还是抵抗(图1)。这个TIME分类是基于他们早期对人类黑色素瘤的研究,该研究以独特的PDL1表达和TIL模式为特征,并进一步扩展到其他人类肿瘤 26,52-54。
TIME主要适用于实体瘤,但不适用于造血系统肿瘤,对于这些肿瘤,TME可能不存在或没有重大影响。根据这一分类,基于PDL1表达和TILs(主要基于CD8阳性T细胞),肿瘤可以被分为4类:PDL1‾/TIL‾(I类);PDL1+/TIL+ (II类);PDL1‾/TIL+ (III类);PDL1+/TIL‾ (IV类) 26,53-56。肿瘤微环境分类应被视为正在进行的工作,而这只是一个开始。随着导致AIR的新的分子途径的发现和对TME中免疫反应的了解,有望在当前四种主要类型的基础上进一步建立亚型,来准确预测患者对免疫治疗的反应。
----果友布洛芬就是力量----
原发性耐药
抗PD治疗的原发性耐药定义为II型肿瘤对初始抗PD治疗无反应,这种肿瘤同时存在PDL1表达和T细胞浸润(图1)。因此,这类肿瘤可能会对抗PD治疗产生反应。在黑色素瘤、肺癌以及膀胱癌中,PDL1阳性的肿瘤对抗PD治疗的反应率比PDL1阴性的高37,49,57-61。 不幸的是,TILs特别是CD8+T细胞还没有被作为筛选病人的生物学标志物。PD-L1阳性的肿瘤包括TIME II型和IV型两组。由于IV型肿瘤没有T细胞的浸润,因而不会对抗PD治疗产生反应,所以不能仅根据PD-L1是否阳性来确定对抗PD治疗的原发耐药性,如果是这样的话,就不准确了37,49,57,60。
我们开始对抗PD疗法原发性耐药的机制有所了解,但目前还不知道TME中表达多少PDL1才能发挥抗PD治疗的作用。通过针刺活检对肿瘤组织进行取样可能会丢失PD-L1阳性的区域,从而造成结果假阴性 62。这也许能够接受为什么某些名义上为PD-L1阴性的肿瘤中存在抗PD治疗的临床反应 25,63,64。这一限制可以通过在同一肿瘤中进行多次活检来规避。放射性同位素标记的PD-1变体或用于体内成像的抗PD-L1 mAbs可能代表了一种更好的方法,以评估PD-L1在肿瘤内更大范围的表达,并且已经在动物模型中进行可行性研究 65,66。
此外,如果可能,切除的活检可能提供更好的样本,以准确评估PD-L1的表达。另一个干扰因素是,目前公认的检测PD-L1表达的技术是免疫组化,其中组织处理(冷冻、福尔马林固定)可改变表位 67,所使用的抗体类型也可能会影响PD-L1染色的质量 68。
最后,PDL1的表达可能是动态的,因为它在很大程度上是诱导表达的,这表明从取活检到开始抗PD治疗的时间内,表达可能存在不同。例如,TILs可能在数量和质量上发生变化,导致IFNγ分泌的上升或下降。此外,我们应该对哪些细胞亚群(肿瘤细胞与免疫细胞)表达PD-L1展开评估,以及对哪种检测方法(如DAKO与VENTANA)更可靠仍不甚了解。
如上所述,所有这些参数都可能导致数据的混乱。除了PD-L1的表达外,评估其他共同抑制分子和共同刺激分子的表达也很重要,以充分利用有效的免疫反应。这可能对抗PD治疗的原发耐药性至关重要。
----果友Jiajia----
虽然TILs的存在似乎至关重要,但是具体是TILs上哪些主要的细胞组成和分子组成调控原发性耐药尚不明确。CD8+ 和T helper细胞常与良好预后相关,他们有可能是预防原发性耐药的主要细胞组成 69,70,71,72 。但是,其他包括CD4+T细胞,NK,NKT,B细胞,Tregs,γδ T 细胞,以及其他天然淋巴细胞,在TME中的作用相比之下就不太明确了。除此之外,Tregs和MDSC可能主动调控原发性耐药。对于TIME type II 的全面的细胞和分子分析应该能帮助我们识别哪些病人对于anti-PD疗法有更高的耐药风险。

继发性耐药大约四分之一到三分之一的转移性黑色素瘤患者初期对anti-PD疗法应答,但随着时间的转移而复发 73。类似的复发也在肺部肿瘤患者中出现 74。因此,这些患者代表着对anti-PD1疗法继发性耐药的现象。目前,没有确切的生物标志物或者临床指标能够预测复发,也没有研究足量样本以显示anti-PD疗法的抵抗机制。这是临床上一个迫切需要解决的挑战。
临床观察提供了一些继发性耐药机制的潜在线索。有获得性抵抗的患者仍可能有PDL1和PD1的表达(这是激活的T细胞浸润的特征)。有趣的是,复发患者有些情况下在停止免疫治疗后或者化疗的一段时间仍然可能对治疗产生应答 75,76。在这些案例里,继发性耐药不能由变异或丧失肿瘤抗原所产生的肿瘤变体所解释。但是,肿瘤细胞可能产生了内部变化,从而躲过了免疫攻击。肿瘤内部变化在anti-PD疗法的功能已在最近一篇综述里总结77,故此不再赘述。
在小部分复发的患者中,功能丧失型突变和获得性抵抗密切相关,例如JAK1和JAK2 的功能丧失型突变,B2M基因的截短突变 73。这些变异与对anti-PD疗法的无应答相关,因为在干扰素调控下的肿瘤细胞死亡需要JAK通路的激活,但是B2M的变异会降低MHC class I的表达。由anti-PD1或者CTLA4 疗法引发的干扰素信号延长可引发STAT1相关的表观变化,从而导致对干扰素的无应答 78。干扰素信号延长也能增强干扰素刺激基因,数个T细胞控制受体的配体,并上调NOS2 79。总的来说,尽管这些关于免疫分子功能丧失型突变的报告提供了看上去合理的获得性免疫甚至是免疫机制的例子,这些事件发生概率低并且未必存在因果关系。其他控制受体的上调也被报告或与继发性耐药有关。比如上调的HAVCR3,一个T细胞的抑制受体,就在小鼠肿瘤模型和两个临床肺癌患者案例中被发现 80。
---果冻---
靶点缺失性耐药
抗PD治疗通过阻断PD1和PDL1的结合而起作用。理论上来说,肿瘤微环境中一个或两个蛋白的表达缺乏会影响疗效,所以PD1或PDL1表达减少的肿瘤被归为“靶点缺失”型。因此,抗PD治疗在I, III, IV型肿瘤免疫微环境(TIME)的患者中反应差。靶点缺失性耐药在60–85%的实体肿瘤中出现(表1)。这也是为什么只有一小部分患者对抗PD治疗有反应的一个主要原因。
Table 1| 不同类型癌症的肿瘤免疫微环境类型综述

FFPE,福尔马林固定石蜡包埋;n,分析样本数量;NA,不可用;NSCLC,非小细胞肺癌;PDL1,程序性细胞死亡配体1。
I型和IV型TIME的共有特征是肿瘤浸润淋巴细胞(TILs)的缺乏,有别于I型TIME,IV型TIME在没有T细胞浸润的情况下仍有PDL1的组成型表达,因此,PDL1的表达不太可能是由TILs诱导。已知的是PDL1的组成型表达与染色体9p24.1的基因扩增引起PDL1, PDL2, JAK2(PDJ扩增子)的过表达有关 44,81,82。其他机制包括免疫浸润缺失诱导的PTEN失活或PI3K和/或AKT突变 83,84,EGFR突变 85, MYC 过表达 86,CKD5破坏 87,以及通过截断基因的3′UTR来稳定PDL1转录本的增加 88。这些发现至少部分地解释了为什么一些PDL1阳性的患者对抗PD治疗没有反应。因此,在抗PD治疗上,同时检测肿瘤组织中PDL1以及PD1(或T细胞图谱)的表达以排除IV型TIME患者是很重要的。
关于这些肿瘤细胞是否不表达肿瘤抗原,或者这些抗原不能很好地被提呈,一直存在争议。由于肿瘤细胞存在频繁的基因上调和突变,会导致肿瘤相关或肿瘤特异性新抗原,肿瘤细胞不表达任何抗原是不太可能的 89,90,91。然而,也可能是肿瘤细胞未能表达足够量的肿瘤抗原,在一小部分患者中存在高突变负担和微卫星不稳定,产生大量新抗原,与更好的抗PD治疗反应有关 30,92,93,而肿瘤抗原表现的特异性缺陷可能导致对抗pd治疗的耐药。这些缺陷包括HLA表达下调,与抗原加工相关的转运提(TAP)的缺失, β2m的删失导致的I型HLA形成减少或HLA的表观遗传沉默 94,95,96。目前,这些缺陷只在少部分病例中发现。
T细胞被主动或被动地排出到TME外,可能是I型和IV型TIME出现AIR的主要机制。目前只是刚开始探索冷肿瘤AIR的分子及细胞机制,最近的研究通过寻找正常组织以及肿瘤组织间差异表达的基因和蛋白,提示肿瘤血管系统的改变是部分冷肿瘤T细胞外排的主要机制。CD93及其配体IGFBP7的过表达导致T细胞在肿瘤组织中的渗透性缺乏,可能与之相关,在传统的冷肿瘤模型B16黑色素瘤小鼠模型中阻断CD93以及IGFBP7可以使肿瘤血管正常化,引起浸润性T细胞的增加,导致已成瘤病灶的消退 97。
III型TIME有T细胞浸润,可募集T细胞,但并未完全分化成为成熟T细胞。但与 I, IV型TIME不同,III型TIME存在PDL1表达缺乏,意味着T细胞分化过程存在缺陷,如IFNγ的缺乏,这提示在T细胞抑制中存在非PD1-PDL1的AIR机制。通过体外对T细胞抑制分子的全基因组筛选,Siglec-15被确定为一种肿瘤诱导的免疫抑制因子,在III型TIME肿瘤中高度上调,其表达与PDL1的表达呈负相关 (ref.27)。一项I期临床试验对抗PD治疗以及其他标准治疗耐药的患者使用anti-Siglec-15 (NC318),结果显示这种疗法是安全的,无重大不良事件,在部分晚期肺癌患者,乳腺癌和头颈部癌症中显示治疗有反应 98。
---多喝烫水---
目前的联合疗法
在晚期黑色素瘤患者中,抗 PD治疗已被证明优于抗 CTLA4治疗,这是因为提高了总存活率(OS)同时降低了药物毒性,从而证明了在探索与其他药物联合免疫治疗的临床试验中,使用抗PD治疗作为最常见的方法是合理的 99,100。数以千计的临床试验正在研究与抗帕金森病疗法可能的联合作用。2017年9月,共有1502项临床试验评估抗帕金森病治疗组合;4年后,确定4897项研究抗帕金森病治疗的试验 101,102,其中80%以上涉及联合治疗。在受调查的各种组合中,化疗、抗CTLA4和使用小分子靶向治疗是最常见的三种组合。随着临床试验的增加,其中许多在组合药物和患者群体方面有很大的重叠,跟踪所有测试的组合、中期分析的结果和最终公布的数据是十分困难的。在Table2中,作者介绍了联合免疫疗法已发表的第三阶段试验的优选案例,重点是将抗 PD治疗与抗 CTLA4治疗、化疗或靶向治疗相结合的试验。
Table 2 |代表性的抗PD联合治疗试验
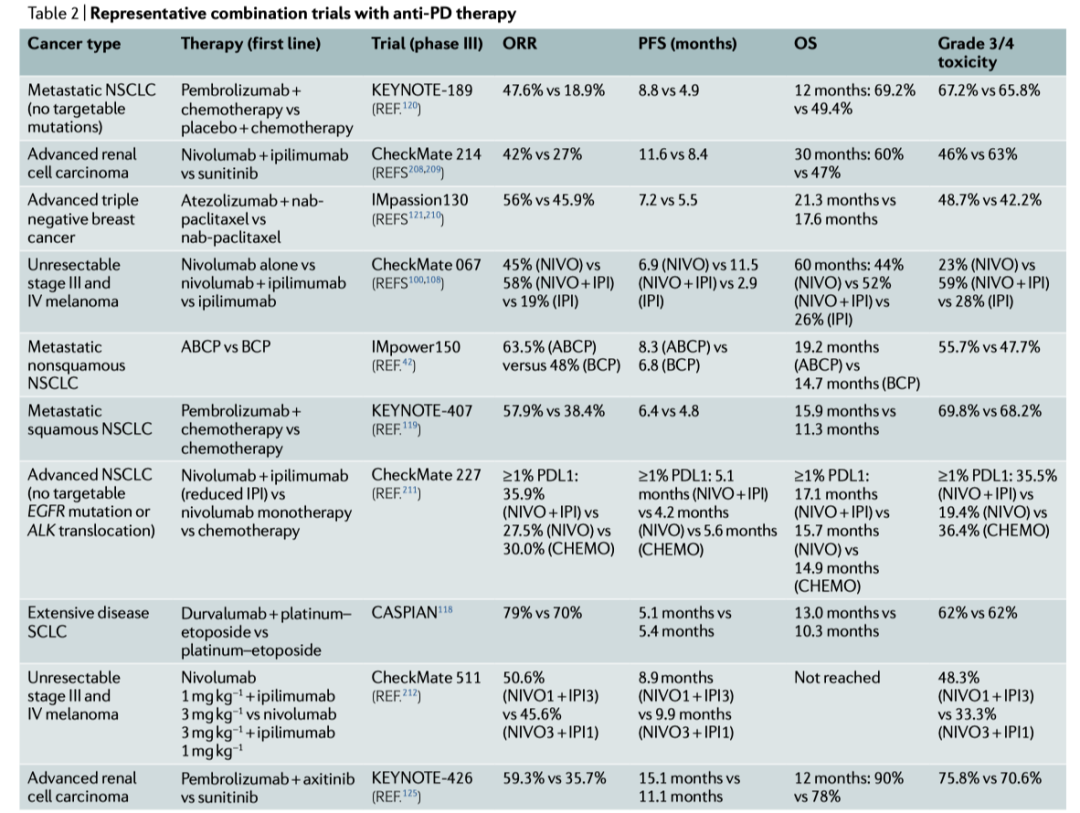
ABCP,阿替利珠单抗加贝伐单抗加卡铂加紫杉醇;BCP,贝伐单抗加卡铂加紫杉醇;CHEMO,化疗;IPI,ipilimumab, 易普利姆玛;NVO,nivolumab, 纳武利尤单抗;NSCLC,非小细胞肺癌;ORR,客观缓解率;OS,总生存;PDL1,程序性细胞死亡配体1;PFS,无进展生存;SCLC,小细胞肺癌。
与抗CTLA4抗体联合
联合抗 CTLA4治疗在很大程度上受到抗 CTLA4治疗在转移性黑色素瘤患者中的单体药物活性的激励 103。从机制上讲,抗CTLA4单抗与抗 PD治疗在小鼠模型中观察到的协同效应被解释为非重叠机制的结果:CTLA4抑制剂抑制 Treg细胞和新生 T细胞反应,而抗PD治疗主要通过改善 TME中的效应 T细胞功能来发挥作用 104,105,106,107。然而,临床结果与在小鼠肿瘤模型中观察到的结果大不相同。在几项试验中,这种组合充其量似乎在临床反应中具有协同效应,而各种副作用,包括自身免疫相关不良事件的严重程度显著增加(Box 1)。在对不能切除或转移性黑色素瘤患者进行的 III期试验中 100,108,抗 PD加抗 CTLA-4的联合用药使5年存活率分别为 52%、44%和 26%,毒性显著增加,59%的患者在联合用药组中经历了与治疗相关的3级或4级不良事件,而单用抗 PD组的患者的这一比例为23%。联合用药组OS的这种边际增加可能是治疗相关毒性作用增加的结果。因此,同基因小鼠肿瘤模型似乎并不能说明这些治疗药物的作用机制或疗效。此外,在这种联合用药的疗效和毒性显著增加的边际增加的情况下,可以考虑在抗 PD治疗之后再使用抗 CTLA4而不是联合治疗。这种循序渐进的方法可能有助于在保持疗效的同时降低显著的毒性。事实上,对抗 PD治疗有抵抗力的患者仍然可以以类似的应答情况对抗 CTLA4治疗做出反应 109,110。

如上所述,免疫检查点阻断会导致不可避免的毒性作用,被称为免疫相关不良反应 (IRAEs)。与CTLA4单克隆抗体易普利姆玛相关最常见的免疫相关不良反应是结肠炎,而抗PD治疗更常引起内分泌病(主要是甲状腺炎)和肺炎 60。除了上述关于CheckMate试验的数据(3级以上免疫相关不良反应分别发生在 27.3%、16.3% 和 55% 接受易普利姆玛、纳武单抗和易普利姆玛、纳武单抗联合治疗的患者中)之外,一篇包括36个临床试验的系统回顾还表明,抗PD治疗的免疫相关不良反应发生率明显低于易普利姆玛(纳武单抗治疗的患者为14.1%,派姆单抗治疗的患者为 19.8%,易普利姆玛治疗的患者为28.6%)213。免疫相关不良反应的不同毒性特征和严重程度进一步区分了这两种方法,分别靶向调节正常稳态的途径(CD80/CD86-CD28 途径)与病理过程(PDL1-PD1途径))。
我们的早期研究表明,Cd274(编码小鼠PDL1)基因敲除小鼠发育正常,造血和免疫系统没有明显异常 4。除了使用抗体治疗的实验动物普遍安全外,由于PDL1 在肿瘤微环境 (TME) 中的集中诱导,对PDL1-PD1通路的操作预计不会对癌症患者产生显著毒性。然而,目前的临床研究记录了各种免疫相关不良反应,尤其是甲状腺炎、肺炎、关节炎以及糖尿病。尽管水平较低,但细胞表面PDL1也存在于正常组织和器官中。PDL1 的生理功能是保护正常器官和组织免受小的、有时是亚临床感染和/或炎症 14, 214 , 215 , 216。然而,PDL1 的表达可以上调干扰素-γ(IFNγ),其不仅由肿瘤特异性肿瘤浸润淋巴细胞 (TIL) 产生,而且还可以通过其他炎症和内在诱导 (IV 型) 过程产生。I 型干扰素也可以上调 PDL1(参考文献217)。在这方面,PDL1在非肿瘤组织上的表达可能可以通过干扰素的存在来解释,可能是由于感染和/或炎症触发了干扰素的产生。自然杀伤 (NK) 细胞、NKT 细胞、树突状细胞、巨噬细胞和中性粒细胞等先天免疫细胞产生的干扰素对器官和组织损伤作出反应,也可能导致类似“自身免疫”的组织损伤。在抗PD治疗期或之后,先前存在的亚临床炎症可能因此被放大到病理水平。例如,化疗引起的肺部炎症、既往放疗、近期感染、既往肺部疾病和吸烟是可能加剧与抗PD治疗相关的间质性肺炎的危险因素。
“亚临床炎症”假设的含义是,如果有这种亚临床炎症的迹象,特别是在那些重要器官中,那么在抗PD治疗之前可能不需要注意预防甚至治疗这种炎症。如果可能的话,将优先考虑局部治疗而不是全身治疗。尽管存在不可避免的免疫相关不良反应,但抗PD治疗的效果被证明收益大于风险。为了最大限度地提高益处,同时最大限度地减少危害,临床医生需要识别风险因素,关注临床表现并确定使用免疫抑制剂的时机。(图注由瓜瓜和杜鹃两位果友共同完成)
----wcsApricus----
联合化疗
众所周知,标准化疗对增殖性强的细胞有广泛的细胞毒性,尤其是造血细胞和免疫细胞。因此系统化疗常被认为是免疫治疗的天敌。但一些研究显示,恰当地运用部分化疗药或能通过消除Treg细胞来促进T细胞的免疫活性 112,113,114,同时还能通过刺激T细胞介导的免疫功能来增加肿瘤细胞死亡后释放的抗原 115,116。例如,抗叶酸制剂培美曲塞就能增强线粒体功能和T细胞活化 117。目前已启动了多项临床试验,而最近有结果表明,在抗PD治疗的基础上联合化疗可能获得额外但有限的抗肿瘤疗效 118,119,120。
一项III期临床试验将帕博利珠单抗联合化疗(培美曲塞加一种铂基药物)与单纯化疗在转移性非小细胞肺癌的疗效进行了比较。联合治疗组的12个月OS (69.2%)较单纯化疗组(49.4%)有所改善。无论PD-L1表达情况如何,所有组均观察到OS增加。类似的结果也可见于其他疾病的III期临床试验中,如小细胞肺癌 118和三阴性乳腺癌 121。尽管这些联合治疗显示出一定的生存优势,一个关键的问题仍然没有解决,即化疗是否会因对免疫细胞的细胞毒性而削弱抗PD治疗的疗效。为解决这一问题,需要将联合治疗与单纯抗PD治疗进行比较,而过去对于抗PD治疗疗效的比较可能会产生误导。这主要是由于PD-L1表达的变化,以及纳入试验的患者数量需要满足统计要求。这一联合治疗的另一个问题是化疗对抗PD治疗的长期影响。例如,效应T细胞可分化为长期保护性免疫所必需的记忆T细胞。目前,尚不清楚化疗是否会阻碍长期记忆免疫细胞的产生,而搞清楚化疗对免疫系统的影响对于未来的临床试验是至关重要的。
联合靶向治疗
利用小分子药物靶向与细胞生长和存活有关的胞内信号通路,可有效快速地缩小肿瘤体积。但许多这样的药物的疗效都不持久,主要是由于存在其他补偿性通路 122,123,124。这种特点似乎能与抗PD治疗互补,后者拥有长期疗效但需要花上数月的时间扩增T细胞并在肿瘤微环境中发挥它们的功能。因此,既可阻碍肿瘤生长又不会损害免疫系统的靶向治疗或能成为联合抗PD治疗的潜在候选药物。KEYNOTE-426试验发现帕博利珠单抗联合阿昔替尼(小分子酪氨酸激酶抑制剂)的疗效优于舒尼替尼单药治疗 125,随后FDA批准了这一联合疗法用于晚期RCC。其中,联合组的ORR为59.3%,而单药组为35.7%。联合组12个月和中位PFS的总生存率分别为90%和15.1个月,而单药组分别为78%(未达中位OS)和11.1个月。就OS和PFS而言,联合治疗在PD-L1表达低于或超过1%的亚组中均有获益。接受联合治疗的患者中有75.8%出现了3级或更高级毒副反应,而这一比例在单药组患者中为70.6%。这些发现是令人鼓舞的,因为毒性反应似乎是可控的且不会额外增加毒性。目前,许多临床试验正在探究多种靶向治疗联合抗PD治疗,包括BRAF、MEK、EGFR、ALK和ROS1的抑制剂等。
概括地说,目前数千个联合治疗的临床结果仍无法提供一种提高疗效的方法,这种治疗有理想的协同作用,或至少有完全的叠加效应,且无更多不良反应。与其继续进行各种现有疗法与免疫治疗的组合,不如在肿瘤微环境的背景下更好地理解基础肿瘤免疫学和肿瘤生物学,这可能是解决问题的关键,下面将继续讨论。
------果友Reve------
未来的联合治疗
我们对于各种人类肿瘤中,免疫微环境的适应性免疫抵抗机制的理解仍是初步的。在新技术例如单细胞分析术126,实时成像127,体外128,129以及体内130,131高通量全基因组功能筛选的帮助下,我们可以快速确认造成适应性免疫抵抗机制发生的分子靶点,探索潜在的适应性免疫抵抗机制。有充分的证据表明,肿瘤微环境是使适应性免疫抵抗发生的一个关键场所,这鼓励了我们在不了解适应性免疫抵抗确切机制的情况下,对治疗方案进一步探索。这些探索可以分为三个方向:第一,局部的改变肿瘤微环境;第二,阻断常规免疫抑制机制;第三,增强T细胞介导的免疫。值得注意的是,这些尝试大多是高度探索性的,且通常需要与抗PD治疗联合使用。下面将简要总结这些探索。
改变局部的肿瘤微环境
先天免疫细胞的模式识别受体,包括吞噬细胞以及专业的抗原呈递细胞,可以从感染源中识别各种分子实体。模式识别受体对配体的识别导致了各种信号通路的激活以及抗原呈递细胞的成熟,从而激活和启动抗原特异性T细胞。抗原呈递细胞活力的增强可通过给予患者I型干扰素,Toll样受体配体或者干扰素基因激动剂刺激因子来实现,给药方式通常为局部注射。这些联合治疗在临床前模型中展现出希望132,133,134,135,136。一项治疗晚期黑色素瘤的Ib期临床试验结果显示,TLR9激动剂与抗PD联合使用时展现出边际效益137。一项针对实体肿瘤或淋巴瘤患者的早期试验结果表明,STING激动剂在单药治疗中效果最弱,但它们和抗PD治疗联合使用的重要程度仍不确定138。
为在临床中获得成效,这些药物必须激活先天免疫,诱导炎症发生,从而吸引免疫系统的适应性臂,如T细胞,并最终诱导激活的T细胞分布到身体的其他部位,以抑制继发性肿瘤或转移。目前,这些药物是否能触发先天免疫尚不清楚,但即使这些药物成功刺激了先天免疫,也无法保证适应性免疫会自发产生,就像在许多冷肿瘤的肿瘤微环境中,仍然存在中性粒细胞甚至巨噬细胞。
局部放疗
放疗可以对组织和细胞产生深远的影响。除了破坏细胞外,它还会触发先天免疫,随后在某些情况下会促进免疫细胞浸润到肿瘤中139,140,141,142,143,144。肿瘤的局部放疗也可能导致同一患者未暴露于辐射的其他肿瘤的系统性消退,这种现象称为远端效应,归因于受辐射肿瘤诱导的系统性免疫。然而,这种效果非常罕见(<1%的患者)。放疗还可以诱导肿瘤中PD-L1的表达140,142,这可能是一种防止放疗诱导的炎症伤害的机制。在小鼠模型中观察到了放疗与抗PD治疗联合的协同抗肿瘤作用140,142,144,145。放疗产生的远端效应可以协同抗PD治疗142,提示某一部位的局部辐射触发了免疫浸润并增强其他部位的抗PD治疗的效果。在与抗PD治疗联合应用时,放疗的剂量、位置、时间、时间表以及可以增强放疗免疫效应(例如抗原捕获纳米颗粒)的其他新工具146 正在被积极地研究。理论上,放疗应该适用于 I型和IV型肿瘤免疫微环境患者,以产生de novo炎症。在II型和III型肿瘤免疫微环境的患者中,不应考虑或应谨慎应用放疗,因为辐射可能会损害现有的肿瘤浸润淋巴细胞。
---宋丹丹---
溶瘤病毒的局部给药
使用溶瘤病毒治疗癌症的最初原因是,一些病毒只在癌细胞中复制,而在正常细胞中不复制147。除了病毒固有的溶瘤细胞特性外,一些被修饰后的产品已被应用于调节免疫反应,如插入细胞因子、重组抗体、T细胞结合配体和肿瘤抗原。例如,肿瘤病毒(T-VEC:Imlygic)是单纯疱疹病毒1型的一种改良版,在肿瘤内选择性复制并产生粒细胞-巨噬细胞集落刺激因子(GM-CSF)148。T-VEC触发树突状细胞分化,增强抗原呈递,促进T细胞的活化和/或浸润。FDA批准T-VEC用于首次手术后复发性黑色素瘤不可切除病变的局部治疗。因此,使用这些药物,特别是局部给药,将“靶点缺失”类型(I、III和IV型)转化为II型,使它们对抗pd治疗易感是一个有吸引力的策略。
免疫抑制阻滞剂
许多一般的免疫抑制机制在体内起作用来控制自身反应性免疫反应和/或过度反应性炎症反应。与AIR机制(适应性免疫抵抗)相反,这些机制不一定是由癌症甚至炎症诱导或促进的,而是维持正常内稳态所必需的。TGFβ家族蛋白介导的免疫抑制就是一个例子。从伤口愈合到细胞分化,TGFβ家族分子具有广泛的正常生理功能149。另一个例子是Treg细胞介导的免疫抑制,包括不必要的炎症和自身反应150。Treg细胞可以通过C-C基序趋化因子2(CCL2)和C-C趋化因子受体2型(CCR4)信号通路进入肿瘤微环境16,151。莫格利珠单抗,一种抗CCR4单抗,可以耗尽循环Treg细胞,正在研究与抗pd联合治疗晚期实体肿瘤(NCT02301130)。CD39、CD73、腺苷和腺苷A2a受体可能都是耗尽Treg细胞的潜在靶点152,153。Treg细胞消耗的一个主要问题是其抗CTLA4(参考文献154)和抗CD25单抗155联用时增加的细胞毒性。我们希望选择性地消耗肿瘤微环境中的Treg细胞,以避免增加的不良事件。
MDSCs(骨髓来源的抑制性细胞),包括已改变的巨噬细胞或中性粒细胞的一个子集,能有效抑制免疫反应,包括抗肿瘤免疫156,157,158。针对MDSCs治疗的研究主要是消耗或使用低剂量化疗调节他们的活性159,PI3Kγ抑制剂160,组蛋白去乙酰化酶抑制剂161,IL-4受体-α(IL-4Rα)162或TRAIL受体的特异性抑制剂工程配体RNA163,或肽对S100A9对MDSCs的生成、增长和功能至关重要。已经开发出用于靶向肿瘤相关巨噬细胞(TAMs)的抗体,包括抗CCL2抗体、巨噬细胞集落刺激因子1受体(CSF-1R)抗体和抗CCR2抗体。在TAMs上的PD1表达抑制了吞噬作用165,这表明抗PD治疗也可能通过靶向TAMs发挥抗肿瘤作用。目前,这些药物正在进行临床试验。
阻断广泛免疫抑制机制的主要问题在于高频率的副反应事件。如前所述,这些机制通常是调节或控制内在的自身免疫或炎症所需。一些免疫检查点分子,如CTLA4和TGFβ,就属于这一类。一些“免疫检查点蛋白”,如淋巴细胞激活基因3蛋白(LAG3),TIM3,氨酰胺2,3双加氧酶1(IDO1)和 诱导性T细胞共刺激因子(ICOS)166、167、168,从敲除小鼠模型或功能丧失基因缺陷或蛋白突变的患者表型观察来看169,170,171,172,似乎对正常的生理功能没有很大的贡献,这些蛋白的临床前肿瘤模型研究通常为特定抑制剂提供合理的有效数据。然而,当使用单一治疗进行测试的临床试验中,控制这些分子通路是无效的173,174,175。在晚期人类肿瘤中高度多样化的TMEs的背景下,一种可能的解释是,这些通路在TME中不是占主导地位的,或者只发生在一小部分病人中。
增强T-细胞介导的免疫
抗PD治疗的一个主要作用是改善TME中已存在的免疫,但其在全身免疫的产生中作用相对较小。因此,我们希望进一步增强系统免疫,以使肿瘤部位持续供应效应T细胞,特别是对于晚期癌症的治疗。因此,外周淋巴器官的效应T细胞的健康激活程序是可取的。联合抗PD治疗与传统免疫增强方法是合理的,包括癌症疫苗、细胞因子治疗,过继T细胞治疗和共刺激,以及最近的参与者如DNA损伤剂,PARP抑制剂和表观遗传修饰剂,这种治疗也被认为通过不同的机制修正系统免疫功能。我们重点讨论T细胞治疗和共刺激方法,因为它们可能是抗PD治疗的补充,读者也可以参考一些其他方法的优秀综述文章。
---果友璐---
过继性T细胞治疗
对于TIME I型和IV型肿瘤,过继T细胞治疗(包括基因工程嵌合抗原受体(CAR)-T细胞和体外扩增的抗原特异性T细胞或TILs)是一种有希望的方法,以增加T细胞在肿瘤部位的渗透。转移T细胞通常是完全激活的,因此表达PD1。TIL识别肿瘤抗原可以导致干扰素γ和其他细胞因子诱导TME中PDL1的表达。从理论上讲,这可以将TIME I型和IV型转换为II型,因此将抗PD治疗与过继T细胞治疗相结合是有意义的。除了分离的TIL,经过抗体和T细胞受体(TCR)改造的T细胞也可能作为作为抗PD治疗实体肿瘤的有益组合。抗PD治疗与CAR-T细胞的结合,以及使用CRISPR-Cas9删除CAR-T细胞中包括PD1在内的共同抑制分子,正在测试中176。然而,使用这种方法还有几个阻碍。首先,转移T细胞应该在体外工程和通常活跃的生长和激活过程后仍然保持向肿瘤组织迁移的能力。其次,输注的T细胞在TME中可能遭遇未知的AIR机制,而不是PD途径。这在目前是很难预测的,可能是导致几个使用T细胞治疗实体肿瘤的临床试验失败的主要原因177,178,179,180。人们希望有选择地培养或设计出对各种AIR机制具有抵抗力的T细胞。
T细胞共刺激
与T细胞过继治疗类似,共刺激可以极大地促进T细胞的扩增和激活。自上世纪90年代初首次证明共刺激相互作用CD80/CD86-CD28激活肿瘤免疫以来181,已经在不同动物模型中测试了几种靶向共刺激通路的治疗,其中一些正在进行临床试验,有望增强肿瘤患者的免疫力182。例如,TNFRSF9(也称为4-1BB或CD137)是一种TNFR超家族共刺激受体,表达于活化的CD8+T细胞、NK细胞、B细胞和树突状细胞,但在静息细胞中表达极少183。激活型单克隆抗体发出的CD137信号在细胞毒性和细胞因子产生方面提高了T细胞的增殖和效应器功能,刺激记忆性T细胞的形成,并破坏了T细胞的耐受184,185。重要的是,CD137作为一种受体,能通过BCL-xL186传递强大的T细胞生存信号,这一点已经成功地应用于CAR-T的设计和治疗。尽管一项针对特定单抗的早期研究显示这对肝脏有毒性187,但最近的临床试验显示,将抗CD137单抗作为单一药物或联合抗PD治疗晚期实体肿瘤已经取得了有效的成果(NCT02179918,NCT02554812)。TNFRSF4(也称为OX40或CD134)是另一个TNFR超家族成员的共刺激受体,其功能与CD137相似,但它对CD4+T细胞188的共刺激作用似乎更强。OX40和OX40L激动剂单抗目前也在进行临床试验(NCT02219724,NCT02410512,NCT02221960)。
CD40和CD40L之间的相互作用向树突状细胞传递一个强烈的信号,并显著增强了T细胞的启动和随后的激活189,190,191。CD40激动剂(CP-870,893)正在胰腺癌的I期临床试验测试中192。尽管单剂活性有限,但有明显的证据显示T细胞的启动和激活增强了。与雷米诺单抗(抗CTLA4)的联合试验正在对晚期黑色素瘤(NCT01103635)测试中。更多具有不同结合能力和药学特性的抗CD40单抗也在开发中。拮抗抗体HCD122(Lucatumumab)已经在治疗晚期非霍奇金或霍奇金淋巴瘤193的I期临床试验中进行了测试。大多数不良反应都是轻微和中度的。滤泡性淋巴瘤ORR为33.3%,黏膜相关淋巴组织边缘带淋巴瘤ORR为42.9%,弥漫性大B细胞淋巴瘤ORR为11.8%,霍奇金淋巴瘤ORR13.5%。Dacuzumab是一种部分激动剂单抗,已研究用于几种血液系统恶性肿瘤,特别是复发性淋巴瘤194,195,196,197,多发性骨髓瘤(NCT00231166)和实体瘤(NCT02225002)。
结论
通过肿瘤诱导AIR机制的发现,选择性阻断其机理的治疗(抗PD治疗)已被证明对肿瘤患者有效。针对人类TME的解剖、分析和分类方面所做的研究又发现了其他性质复杂,异质性高的AIR机制的存在,而我们很可能也只是观察到冰山一角。尽管如此,我们仍然有能力明确在TME中几种主要或占主导的AIR机制,以便设计出更具体的治疗方案。了解并利用这些新的AIR机制,应该能够在不久的将来更有效更广泛地治疗人类肿瘤
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)