中国科学院广州生物医药与健康研究院刘劲松课题组等发现新冠病毒引物酶nsp8在溶液中和细胞中都可以发生液-液相分离,且nsp8的相分离特性与聚合状态相关。相关工作近日以Multiscale characterization reveals oligomerization dependent phase separation of primer-independent RNA polymerase nsp8 from SARS-CoV-2为题在Nature旗下期刊Communications biology上发表。 新冠病毒nsp8的液-液相分离
由于在病毒复制中发挥关键作用,并且在宿主中没有同源蛋白,RNA 依赖的RNA 聚合酶(RdRp)被认为是抗冠状病毒药物的作用靶点。冠状病毒的基因组编码2种RdRp:引物依赖的RNA聚合酶nsp12和引物合成酶nsp8。科学家们已经揭示了nsp12延伸RNA的分子机制,而nsp8催化引物合成的分子机制尚不明确。越来越多的研究发现,液-液相分离(LLPS)是形成无膜细胞器和提高细胞内生化反应效率的重要机制。LLPS在诸如新冠病毒等RNA病毒的复制和感染过程中起重要作用。通过蛋白序列和结构分析,刘劲松课题组发现新冠病毒nsp8的催化位点D/ExD/E基序所在的N端结构域是内在无序的。由于内在无序区域在驱动相分离形成中具有重要作用,因此课题组推测新冠病毒nsp8蛋白可能可以发生相分离。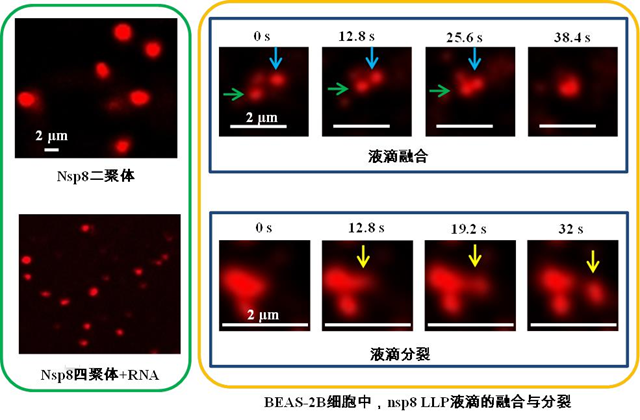
新冠病毒nsp8的液-液相分离
为了研究nsp8的相分离特性,课题组纯化了nsp8的二聚体和四聚体,进一步分析发现,这两种状态的稳定性都随缓冲液中盐浓度的降低而减弱。通过与松山湖实验室合作,利用中国散裂中子源的小角中子散射仪,课题组测定了nsp8的回旋半径和流体动力学半径。通过显微观察以及细胞实验,发现nsp8二聚体可以形成相分离,而nsp8四聚体则在结合RNA后发生相分离。本研究为nsp8催化引物合成的分子机制研究和抗冠状病毒药物研发提供了基础。本项研究的合作单位为松山湖材料实验室和中国散裂中子源。广州健康院徐进新副研究员和松山湖材料实验室姜新副研究员为共同第一作者。广州健康院刘劲松研究员和松山湖材料实验室王浩教授为共同通讯作者。该研究获得了中科院青促会、广州医科大学广州呼吸健康研究院、广州市科技计划和呼吸疾病国家重点实验室等的项目支持。版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。






发表评论
注册或登后即可发表评论
登录注册
全部评论(0)