2022-08-12 来源 : 同写意 ,作者九尾灵狐
G12C抑制剂与免疫检查点抑制剂的联用具有non-overlapping的毒性,而对上游和下游通路的共抑制可能受到毒性的限制[1]。

掀起KRAS/MAPK通路研发高潮
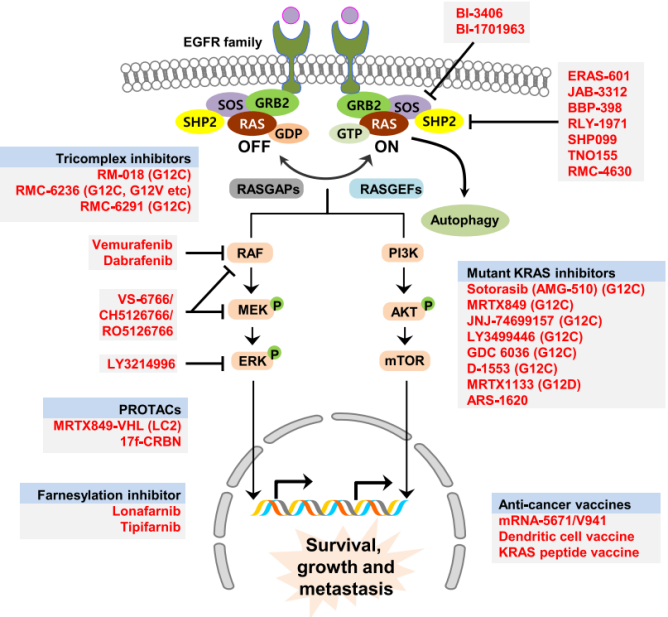
作为细胞通路的主要调节因子,KRAS基因编码KRAS蛋白,它像开关,告诉细胞什么时候分裂,什么时候停止。接收到GRFs的激活信号后(图1),KRAS在活性鸟嘌呤三磷酸(GTP)和非活性鸟嘌呤二磷酸(GDP)之间循环。
KRAS通过磷酸化调控MAPK通路的下游效应物,如RAF、MEK和ERKs(图2)。突变的KRAS保持构成性激活,这导致信号持续传递到下游蛋白,而下游蛋白又保持激活,以不受控制的方式引导几种不同的通路,导致不受控制的细胞生长和肿瘤的产生。

直到最近,RAS家族蛋白仍然是难以捉摸的,并且在很长一段时间里,这些蛋白被认为是不可作为靶标的,尽管早在20世纪70年代就被发现了。这主要是因为KRAS蛋白的无口袋结构(pocketless structure)很难和药物结合。针对上游激活剂如EGFR或下游效应剂RAF、MEK和ERK的策略要么无效,要么毒性太大。
然而,在过去的几年里,在靶向这种主要致癌基因方面取得了重大的新进展(图3)。下文中,主要讨论了KRAS治疗领域的一些最近的发展,并介绍最新的针对KRAS的新药和开发策略。

Kevin Shokat和同事在KRAS G12C蛋白中发现了共价抑制剂药物手柄,这种半胱氨酸只暴露在与GDP结合或不活跃的KRAS G12C蛋白中,并且易于与小分子药物结合。这促进了第一个KRAS的抑制剂Sotorasib/Lumakras™(Amgen R)最终获得美国FDA批准,用于G12C突变晚期转移性肺癌患者且之前至少接受过一次全身治疗。
Adagasib (Mirati Therapeutics)也具有类似的作用机制,有望获得成功FDA的批准。这些药物在含有G12C的肺癌、结肠癌和胰腺癌患者中显示出单药活性。

尽管如此,人们很快意识到靶向突变KRAS并不像最初想象的那样简单。
首先,Sotorasib是KRAS G12C的特异性抑制剂,而G12C只是问题的一部分。另一种常见的突变,如G12D,在大多数胰腺肿瘤中被发现(图4)。还有一些罕见的突变,比如G12V和G12S等。
此外,包括KRAS、HRAS和NRAS的MAPK通路具有不同的overlapping信号和反馈机制,这些机制产生了非常狭窄的药物的耐药性。在临床中,Sotorasib和Adagasib的缓解率均不超过30-40%,无进展生存期(PFS)中位数改善约6个月。对于靶向突变的特异性治疗来说,这不是一个理想的数据,也不如其他靶向药物(如EGFR和ALK抑制剂)观察到的结果。
而8月3日安进公布的2022年H1业绩来看,Sotorasib在美国市场的销售预期低于安进下调后的5500万美元,销售收入仅有5100万美元,上半年全球收入7700万美元。
上述不太理想的反馈推动了研究,即专注于寻找更有效的方法来靶向KRAS通路。主要分为四个方面:
(1)确定一种新的KRAS突变亚型的靶向治疗药物,包括KRAS G12C以外的其他突变,如KRAS G12D,其在较大比例的胰腺癌中发现突变;
(2)通过研究KRAS的上游和下游靶点,确定MAPK通路中额外的可用药途径;
(3)利用此类上下游途径以及其他机制(如检查点抑制剂),开发联合用药策略以增强现有KRAS抑制剂的活性;
(4)提前识别KRAS突变以外的其他共突变的类型,以预测KRAS抑制剂的药效, 使治疗可以针对特定的患者量身定制(强化或弱化)。
毒性问题尤受关注
Mirati公司研发的MRTX1133是一类KRAS G12D抑制剂,已被证明可以与非活化状态的GDP结合,MRTX1133的结构和专利早已公布,文章也已发表多时,但不知为何迟迟未临床开发,笔者猜测可能和临床有效性相关,MRTX1133的结构和MRTX849差异不大,也许也会存在缓解率比不上其他靶向药(EGFR和ALK抑制剂)的问题。
恒瑞开发的fast follow虽率先进入临床,但是以恒瑞11个创新药都是“创新药仿制化”的模式看,很难抱有太大的期待。而当前开发的KRAS G12D抑制剂因较差的口服生物利用度,均需要IP给药。

RAS“on”抑制剂的开发
这是一类特殊的药物,需要一个伴侣蛋白亲环蛋白。这些药物与亲环蛋白形成二元复合物,亲环蛋白又与on-state状态的KRASG结合。
Revolution Medicine开发了FIC的RAS-ON抑制剂,属于三元复合物药物家族,包括RMC6291,G12C on抑制剂;RMC9805,G12D on抑制剂;RMC8839,一种G13C on抑制剂。该系统利用了癌细胞中大量的亲环蛋白和三元复合物阻断了KRAS与其下游信号因子之间的相互作用。因为三元复合物不受KRAS亚型突变的影响,可以成为一种阻断所有KRAS的策略。
RMC6236是一种三元复合物RAS-‘Multi’- on抑制剂,被描述为KRAS G12X抑制剂,其不仅对G12C有预期的活性,还包括其他亚型,如G12D、G12V和G12R。
当前RMC6291、RMC9805和RMC8839均在临床前开发,RMC6236处于一期临床,用于实体瘤。
与SHP2的联用
除了KRAS突变特异性抑制剂,其他主要的疗法还包括与非受体酪氨酸磷酸酶(SHP2)抑制剂联用。SHP2在KRAS非活性形态和活性形态之间循环时能发挥作用。由于G12C抑制剂以不活跃的KRAS(或GDP-KRAS)为靶点,因此,对SHP2的抑制需要保持更多的GDP结合形式的KRAS,以便Sotorasib或Adagasib等药物发挥作用。
RMC4630(SHP2抑制剂)和Sotorasib的联合用药研究(NCT05054725)和诺华类似的研究正在进行[6]。风险仍然存在,诺华SHP2的单药临床研究已经因有效性不足而宣告失败,一些MNC公司也纷纷搁浅这个前两年火热的靶点。
RAS激活复合物中有几种蛋白正被用于开发小分子药物,比如SOS蛋白,它是RAS复合体的一部分,在KRAS GDP转化为GTP的过程中起着重要作用。临床前和临床研究联合G12C和SOS抑制剂正在进行中。
BI公司开发了一种小分子药物BI1701963,这是一种SOS1抑制剂。SOS1是直接的KRAS相互作用蛋白,SOS1抑制剂也是靶向KRAS通路的一个非常有吸引力的靶点。但是, 靶向SOS和GRB2的抑制作用会带来毒性。
事实上,KRYSTAL 14的I期研究(NCT04975256) 联合Adagrasib和BI1701963,以及其他一些BI1701963的研究(NCT04111458、NCT04835714、NCT04627142)已被放弃或终止,原因都是毒性问题。我们必须仔细观察G12C抑制剂与SOS和GRB2抑制剂联用后,有效性和安全性的数据。
KRAS通路下游的MEK、ERK、RAF
早期专注于靶向MEK抑制的研究促进了曲美替尼的开发。然而,这种方法矛盾地通过磷酸化重新激活MEK。因此,针对MEK上下游的联合方案正在被开发以阻止其再活化。
下游效应物的抑制剂如ERK已被探索。然而,针对ERK的老一代药物是有毒的,这阻碍了任何进一步的临床开发药物。新的方法是RAS钳夹策略,可以同时阻断RAF和MEK (VS-6766)。该策略显示了令人印象深刻的MEK磷酸化阻断,钳夹抑制剂的临床前和临床研究正在进行中(NCT05074810, NCT05375994)。
其他耐药机制的研究
包括共突变对KRAS G12C抑制剂缓解率影响的分析。研究表明,P53突变、STK突变和KEAP突变与KRAS同时发生是导致患者预后不良的原因。有趣的是,由于这些突变,肿瘤的下游信号和免疫图谱也有很大的不同。
KRAS和P53突变的肿瘤具有高的MEK和ERK蛋白表达,这类肿瘤可以受益于MEK - ERK抑制剂联合用药,而KRAS和STK11共突变的肿瘤,它的MEK和ERK表达较低。KRAS和P53突变的肿瘤携带炎症特征,并被认为受益于免疫检查点抑制剂联合治疗,而KRAS和STK11突变的整个肿瘤是免疫惰性的。
此外,STK11和KEAP1共同突变的患者对G12C抑制剂的客观应答较差,如果患者只有STK11突变,他们往往会有更好的客观应答。
总的来说,这些基因组学研究表明,在采取一种定制的G12C单药治疗来选择对KRAS相应最好的患者之前,还有很长的路要走,以及确定哪些人将受益于更强化的联合用药也是如此。[7]

联合用药的毒性问题
G12C抑制剂与免疫检查点抑制剂的联合使用具有不相关联的毒性,对上游和下游通路的共抑制可能受到毒性的限制。KRAS与P53共同突变被认为携带炎症信号,并可能受益于免疫检查点抑制剂组合。
此外,SHP2也被证明影响肿瘤免疫微环境(图7),因为SHP2通过去磷酸化TCRζ抑制T细胞活化,这一过程涉及其在细胞质侧募集到PD-1和CTLA-4尾部。这些观察结果将KRAS和免疫治疗领域合并在一起。目前正在进行多项研究,以评估G12C抑制剂和免疫治疗(NCT04613596、NCT04185883、NCT04449874、NCT04699188、NCT04956640)的联合,以及确定SHP2抑制剂与免疫检查点抑制剂联合使用时的影响。
除了小分子药物,其他领域的创新工作也在进行中,如KRAS靶向的mRNA疫苗、RNAi和adoptive T细胞疗法。
mRNA-5671/V941疫苗可靶向KRAS G12C、G12D、G12V和G13D (NCT03948763)。上述提到的adoptive T细胞治疗G12D和G12V也正在进行研究(NCT03745326、NCT03190941)。最近报道的新抗原T细胞受体基因治疗KRAS G12D突变型胰腺癌的研究也再次引发了人们的兴趣[9]。
这些策略也将为这个已经火热燃烧的KRAS靶向治疗领域增加新燃料。
1.Asfar S Azm et al;Clinical progress of KRAS-targeted therapies: what next?, Future Med. Chem. DOI: 10.4155/fmc-2022-0128。
2. Malumbres M, Barbacid M. RAS oncogenes: the first 30 years. Nat. Rev. Cancer. 3(6), 459–465 (2003).
3.Drosten M, Barbacid M. Targeting the MAPK pathway in KRAS-driven tumors. Cancer Cell 37(4), 543–550 (2020).
4. Buscail L, Bournet B, Cordelier P. Role of oncogenic KRAS in the diagnosis, prognosis and treatment of pancreatic cancer. Nat. Rev.Gastroenterol. Hepatol. 17(3), 153–168 (2020).
5.Matthew A. Marx et al;Identification of MRTX1133, a Noncovalent, Potent, and Selective KRASG12D Inhibitor;J. Med. Chem. 2022, 65, 3123−3133.
6.Nagasaka M et al. KRAS inhibitors-yes but what next? Direct targeting of KRASvaccines, adoptive T cell therapy and beyond. Cancer Treat. Rev. 101, 102309 (2021).
7. Hsu J etal. Molecular signatures of KRAS-mutated lung adenocarcinoma: analysis of concomitant EGFR, ALK, STK11, and PD-L1 status. Clin. Pathol. 15, 2632010X221102054 (2022).
8.Kerr DL, Haderk F, Bivona TG. Allosteric SHP2 inhibitors in cancer: targeting the intersection of RAS, resistance, and the immune microenvironment. Curr. Opin. Chem. Biol. 62, 1-12 (2021).
9. Leidner R, Sanjuan Silva N, Huang H et al. Neoantigen T-cell receptor gene therapy in pancreatic cancer. N. Engl. J. Med. 386(22),2112–2119 (2022).
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)