2022-10-27 来源 : 学术查
组蛋白化学修饰是表观遗传调控的重要机制之一,广被熟知的有磷酸化、甲基化、乙酰化、泛素化、糖基化修饰等。2019年,华人科学家赵英明团队在《自然》杂志首次报道并揭示了组蛋白赖氨酸乳酸酰化(Kla)这一表观遗传蛋白修饰新机制,证明该机制参与了受细菌感染的M1巨噬细胞的稳态调控。乳酸不再仅仅是一种代谢产物,乳酸化修饰成为蛋白质翻译后修饰研究的新领域,乳酸在肿瘤、免疫领域的研究前景广阔。
巨噬细胞是单核细胞来源的先天免疫细胞,表型可变性和功能多样性是单个核吞噬细胞的重要特征,一般认为极化巨噬细胞是单核细胞活化后一系列功能状态两个极端,可分化为两种主要表型:促炎型(M1)和抗炎型(M2)。巨噬细胞作为免疫应答的第一道防线,可以通过识别清除病原体、杀伤靶细胞、抗原呈递、免疫调节等功能维持机体的稳态,然而,其过度的聚集和活化也会导致机体的组织损伤,故其动态平衡在组织的稳态中起着重要的作用。即巨噬细胞通过引发炎症反应消除病原侵害,对微生物和各种有害因素做出反应;但巨噬细胞从促炎状态到修复状态的转变对于消炎和恢复稳态至关重要。目前关于调控巨噬细胞功能转变的分子机制仍不清楚。
2020年12月01日,俄亥俄州辛辛那提儿童医院医疗中心在PNAS ( IF11.205 )上发表了题为“TLR signaling adapter BCAP regulatesinflammatory to reparatory macrophage transition by promoting histonelactylation”的文章,即TLR信号适配器BCAP通过促进组蛋白乳化作用来调节炎症性至修复性巨噬细胞的转化。结果表明, BCAP(B-celladapter for PI3K)是一种关键的细胞内在开关,通过印记表观遗传变化来调节炎症巨噬细胞向修复性巨噬细胞的转变。
1、巨噬细胞内在 BCAP 调节肠道炎症和组织修复
通过将携带 BCAP 的 floxed等位基因的小鼠培育成携带 LyzM Cre 启动子驱动的转基因小鼠,产生了在巨噬细胞中缺乏 BCAP 的小鼠。这种杂交产生了巨噬细胞足够(BCAPfl/fl;BCAPWT)或缺乏(BCAPfl/fl×LyzM-Cre;BCAPΔMφ)的 BCAP同窝仔。BCAPΔMΦ 和 BCAPWT 同窝仔鼠用 2.5% DSS 随意处理,发现 BCAPΔMφ 小鼠体重减轻更严重,结肠缩短,以及以隐窝消融和免疫细胞浸润为标志的广泛组织病理学(图 1A-C)。这些结果证实,巨噬细胞中 BCAP 的特异性缺失导致了类似的 DSS 诱导的结肠炎易感性。
BCAPΔMΦ 小鼠在固有层(LP)中显示出炎症单核细胞(CD11b+Ly6CHiLy6G-)的募集和浸润增加(图 1D)。通过流式细胞术分析了组织中的巨噬细胞,发现与 BCAPWT相比,BCAPΔMφ LP 中修复性巨噬细胞 (CD11b+CD206+) 的百分比和CD206 (Mrc1) 的表达降低(图 1F 和 G)。这些数据表明BCAP 的缺失会对结肠组织中修复性巨噬细胞的存在产生负面影响。
使用肠道组织修复模型,小鼠用 2.5% DSS 治疗 7 天,然后再进行 9 天的恢复阶段(图 1H),发现BCAPΔMφ 小鼠在第 8 天时比其BCAPWT 同窝小鼠的体重显着减轻了更多,并且在第 15 天时无法从这种体重减轻中恢复(图 1I)。此外,85% 的 BCAPΔMφ小鼠在第 16 天死于疾病(图 1J),表明它们无法解决结肠炎症。在 4 天的恢复阶段后杀死一组小鼠并收获结肠,发现存活的 BCAPΔMφ小鼠仍然表现出结肠缩短,而与水处理的对照相比,它们的同窝对照能够从 DSS 诱导的损伤中恢复(图 1K)。此外,在恢复期后 BCAPΔMφ 小鼠的结肠中检测到较低水平的 CD206 mRNA (Mrc1)(图 1L)。组织学表明BCAPΔMφ 小鼠在恢复阶段无法修复其肠道隐窝(图 1M)。这些数据表明,巨噬细胞中的 BCAP 表达对于解决 DSS 诱导的结肠炎后的组织损伤至关重要。有大量证据表明,炎性巨噬细胞转变为修复状态以帮助组织修复和伤口愈合,说明巨噬细胞内在 BCAP 可能在这一转变中发挥关键作用。
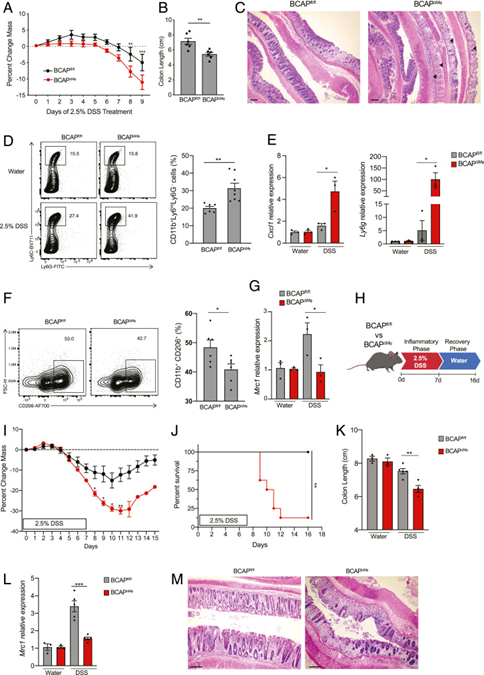
图1 巨噬细胞内在 BCAP 调节肠道炎症和组织修复
2、BCAP 的缺失导致巨噬细胞从炎症状态到修复状态的缺陷性转变
作者从 WT 小鼠产生 BMDMs 并用 LPS 脉冲它们 3 小时,彻底洗掉多余的配体,然后评估基因转录如何随时间变化(图 2A)。正如预期的那样,紧随 LPS 脉冲之后,WT BMDMs 上调炎性细胞因子 Il12b(图 2B)。然而,在去除 LPS 后,Il12b的产生随着时间的推移而减弱(图 2B)。反映炎性细胞因子的这种下调,WT BMDM 开始上调修复基因,例如 Arg1、Klf4 和 Mmp9(图 2C)。尽管是在更长的时间尺度上,作者在DSS 模型中观察到的体内巨噬细胞行为的基因表达表型的转变(图 1L)。热灭活 (HK) 大肠杆菌也用于评估这种从炎症到修复性巨噬细胞的转变,因为它激活了广泛的TLR 和 PRR,并且不需要洗涤以去除配体,因为细菌通过吞噬作用被巨噬细胞自然清除(图 2A)。再次发现了类似的双峰趋势,其中 BMDM 首先上调炎症基因,然后转向修复基因(图 2D 和 E)。作者还发现 BCAP-/-BMDM 在 3 小时 LPS 脉冲后在转录物和蛋白质水平上产生的 IL-12 比 WT BMDM 多(图2C)。BCAP-/- BMDM 表现出持续产生炎性细胞因子,因为它们在去除 LPS 24 小时后仍在产生 Il12b 转录物(图 2B)。虽然 WT BMDMs 能够在去除 LPS 后上调修复基因,但作者发现 BCAP-/- BMDMs 在这种修复转变中存在缺陷,因为它们在去除 LPS 24 和 48 小时后产生的Arg1、Klf4 和 Mmp9显着减少(图 2C)。作者再次使用 HK E.coli 来评估 BCAP-/- BMDMs中的这种修复转变,并发现了与以前类似的趋势,其中BCAP-/- BMDMs 随着时间的推移具有增强和持续的Il12b 产生并且未能有效地上调修复基因 Arg1 和Klf4(图 2D 和 E)。这些体外数据表明,巨噬细胞内在 BCAP 确实在各种炎症刺激后的修复性巨噬细胞转变中发挥着关键作用。
3、FOXO1 和 GSK3β 失活的缺乏有助于 BCAP 缺陷型巨噬细胞增强炎症反应
在对 WT BMDM 进行 LPS 刺激后,确实发现了 AKT、GSK3β 和 FOXO1 的诱导磷酸化,表明 TLR 信号传导的适当负调节因子在该系统中是活跃的(图 2F)。同时刺激的 BCAP-/- BMDM 显示 AKT 的磷酸化显着减少,这转化为 FOXO1 和 GSK3β 的磷酸化减少,这意味着这些因子保持组成型活性并持续过度炎症反应(图 2F)。BCAP-/- BMDMs 用 SB216763 (GSK3βi) 或 AS1842856 (FOXO1i) 预处理,并用 LPS 脉冲(图 2A)。GSK3β和 FOXO1 的急性抑制显着降低了 BCAP-/-BMDM 产生的 IL-12 和 IL-6,而对 WT BMDM 没有很大影响(图 2G)。当用另一种 GSK3β 抑制剂氯化锂 (LiCl) 预处理 BCAP-/- BMDM 时,观察到了相同的趋势。这些数据表明 BCAP 通过参与 PI3K-AKT 通路和灭活 FOXO1 和 GSK3β 来抑制巨噬细胞反应的炎症阶段。作者发现虽然 GSK3β 或 FOXO1 的抑制阻止了 BCAP-/- BMDM 中发现的炎症升高(图 2G),但它并没有挽救这些 BMDM 维持修复基因程序的失败(图 2H)。综上所述,这些数据表明,虽然在 BCAP-/- BMDMs 中发现的增强和持续的促炎反应是由于未能参与适当的负调节途径,但它们在进行修复过渡方面的缺陷可能是独立机制的结果。
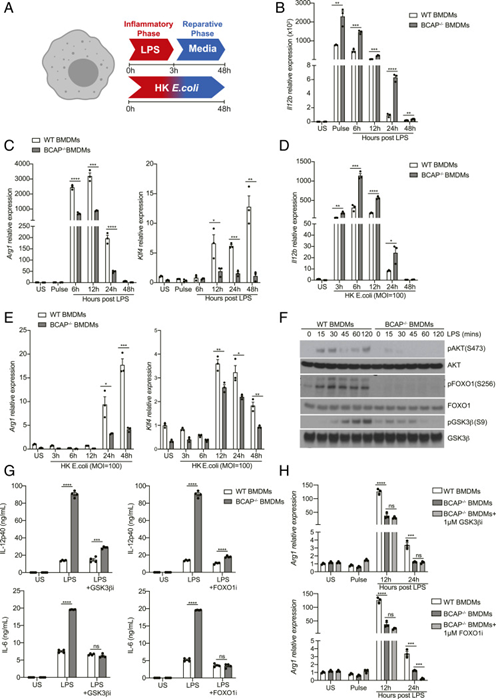
图2 FOXO1 和 GSK3β 失活缺乏促进 BCAP 缺陷型巨噬细胞增强炎症反应
4、微生物刺激后最佳糖酵解需要BCAP
用 HK 大肠杆菌或 LPS 脉冲 WT 和 BCAP-/- BMDMs 3 小时(图 2A)。在 Seahorse 平台上使用糖酵解压力测试测量了指定时间点的细胞外酸化率 (ECAR)。发现在去除 LPS 12 或 24 小时后,与 WT BMDM 相比,BCAP-/- BMDM 的 ECAR 显着降低,表明它们的糖酵解减少(图 3A 和 B),BCAP-/-BMDM 的糖酵解储备也显着减少(图 3C)。与 ECAR 数据一致,BCAP-/- BMDM 表现出乙糖激酶-2 (Hk2) 和乳酸脱氢酶 A (Ldha) 的表达降低,这是糖酵解的两个关键介质(图 3D)。与 Ldha 表达降低相关,在去除 LPS 12 和 24 小时后,BCAP-/- BMDM 产生的乳酸明显少于 WT BMDM(图 3E)。这些数据表明,BCAP 促进了TLR 连接后巨噬细胞的代谢重编程,特别是通过增强糖酵解和乳酸产生。

图3 微生物刺激后最佳糖酵解需要BCAP
5、BCAP 通过组蛋白乳酸化促进修复性巨噬细胞转化
LPS 去除 12 至 24 小时后,作者从 WT 和BCAP-/- BMDM 中分离组蛋白,并通过蛋白质印迹测量组蛋白乳酸化,发现 BCAP是巨噬细胞在 LPS 脉冲后有效乳酸化组蛋白所必需的。添加外源性乳酸钠 (NaLa) 促进组蛋白乳酸化,作者发现 BCAP-/-BMDMs 在用 NaLa 培养后确实能够挽救组蛋白乳酸化(图4A)。通过监测在 NaLa 存在下去除 LPS 12 至 48 小时后修复基因的表达,发现 BCAP-/- BMDM 现在能够将其表达上调至与Arg1 在12 小时和Klf4到 48 小时的WT BMDM 相当的水平(图 4B)。响应 HK E. coli 的刺激,BCAP-/- BMDMs 同样无法有效地使组蛋白乳酸化或上调修复性巨噬细胞基因(图 4C 和 D),但这可以通过添加NaLa 来挽救。这些数据表明,BCAP 是将 TLR 信号与巨噬细胞中最佳有氧糖酵解联系起来的上游接头,产生的乳酸是促进修复基因表达的适当组蛋白乳酸化所必需的,从而促进修复巨噬细胞转变。
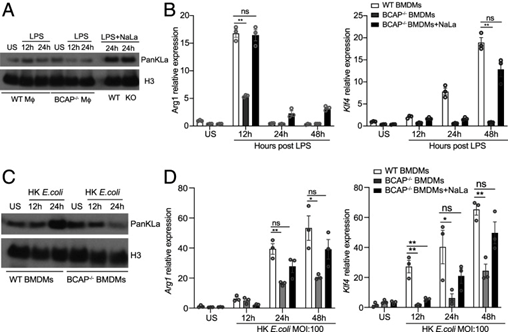
图4 BCAP 通过组蛋白乳酸化促进修复性巨噬细胞转化
基于本团队获取的2021年度国自然医学部2371条中标项目(面上、青年、地区项目、优青)分析,结合国自然医学部今年共资助项目大概为10,000个左右,那么小编对于国自热点的中标数统计如下:
热点 | 2021年医学部中标数 | 热点 | 2021年医学部中标数 | |
免疫调节 | 852 | 缺氧、低氧 | 211 | |
血管生成、重构 | 531 | 泛素化 | 186 | |
线粒体 | 485 | 乙酰化 | 135 | |
外泌体 | 430 | 细胞焦亡 | 118 | |
miRNA | 413 | 代谢重编程 | 118 | |
干细胞 | 371 | 单细胞 | 105 | |
lncRNA | 371 | 内质网 | 76 | |
细胞自噬 | 358 | 炎性小体 | 76 | |
肠道菌群 | 312 | 类器官 | 46 | |
circRNA | 287 | 超级增强子 | 25 | |
m6A m5C m7G | 270 | 相分离 | 21 | |
铁死亡 | 257 | 乳酸化修饰 | 21 | |
转录调控 | 232 | 迁移体 | 4 |
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)