上一次做汇总是在4月底,一图读懂中国PD-1/PD-L1 2022.4.28
半年后再引文一篇,看看中国PD-1形势,自2018年6月,国内获批第一个PD-1以来,短短5年间,国内PD-1/PD-L1免疫药物的商业化已经非常内卷。
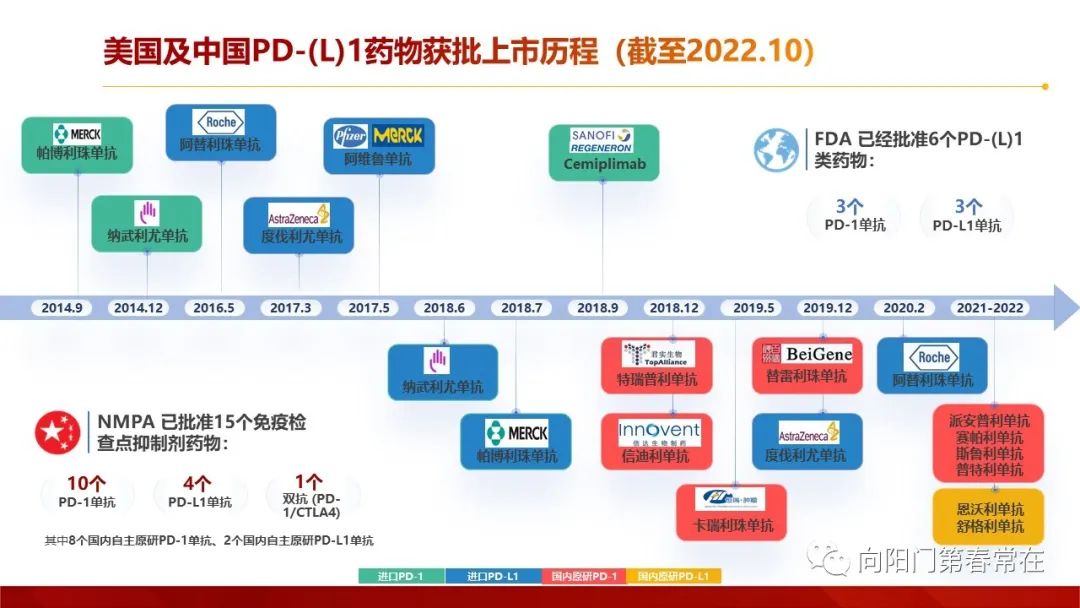
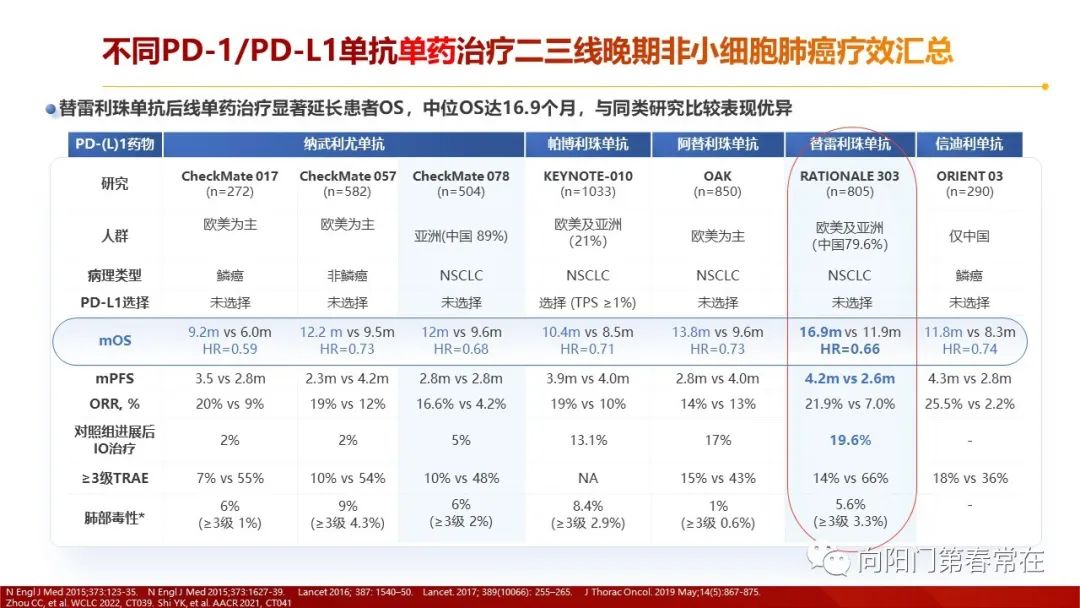
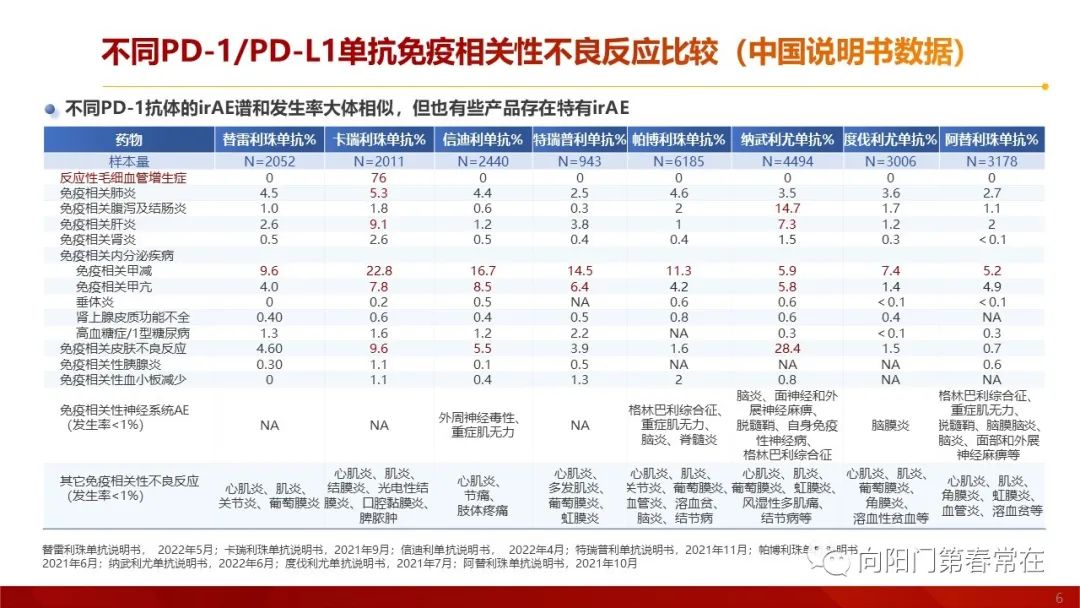
截至2022年10月,中国NMPA(国家药品监督管理局) 已批准15个免疫检查点抑制剂药物在国内上市,包括10个PD-1单抗和4个PD-L1单抗,和1个双抗(PD-1/CTLA4)。对比美国FDA只批准了3个PD-1单抗,3个PD-L1单抗。截至2022.10,帕博利珠单抗(也称作K药)和替雷利珠单抗在国内获批适应症最多,均为9个。 国内PD-1/PD-L1肺癌获批适应症汇总(截至2022.10)不同PD-1/PD-L1单抗单药治疗二三线晚期非小细胞肺癌疗效汇总不同PD-1/PD-L1单抗免疫相关性不良反应比较(中国说明书数据)目前,NMPA 已批准15个免疫检查点抑制剂药物在国内上市,包括10个PD-1单抗和4个PD-L1单抗,和1个双抗(PD-1/CTLA4)。不同免疫药物的疗效和irAE发生率存在一定差异, 通过对抗体来源、Fab 段及Fc结构域以及适应症等的深入了解,将有助于合理使用免疫治疗药物,减少不良反应发生,实现个体化治疗。药物的作用机制是良好临床疗效的基础。 Fc 段特征、药动学等方面均可能会对抗PD-1/PD-L1 单抗药物的药效学或药动学产生影响,从而可能影响该类药物的适应证、疗效和安全性。替雷利珠单抗凭借Fc段改造、Fa段彻底持久阻断、半衰期长等特点,多维度匹配了理想PD-1抑制剂模型,在肺癌多个研究中产生了持久且安全的疗效。目前已经针对肺癌、霍奇金淋巴瘤、肝癌、食管癌、鼻咽癌等多个瘤种在国内已获批适应症。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。











发表评论
注册或登后即可发表评论
登录注册
全部评论(0)