2022-11-29 来源 : 学术查
O-连接的β-D-N-乙酰氨基葡萄糖 (O-GlcNAc) 是最常见的糖基化修饰,可修饰细胞核、细胞质、细胞膜和线粒体中数千种蛋白质。包括蛋白激酶、转录因子和共激活因子、代谢蛋白、膜受体和其他信号分子等的丝氨酸或苏氨酸残基。作为细胞中的主要“营养传感器”,O-GlcNAc 通路对细胞代谢状态敏感。O-GlcNAc 在多个水平上调节蛋白质功能,包括酶活性、能量代谢、细胞周期、转录活性、亚细胞定位、分子间相互作用和降解。尽管O-GlcNAc的研究仍处于初始阶段,但越来越多的证据表明O-GlcNAc是一个有前景的治疗靶点,是当前研究的一大热点。
今天小编为大家总结了关于糖基化的相关知识,并附上了相关参考文献,快来和小编一起学习吧~
(一) O-GlcNAc的合成与调控
O-GlcNAc的合成主要通过己糖胺生物合成途径(Hexosamine biosynthetic pathway,HBP) ,它是是葡萄糖代谢的一个分支,利用L-谷氨酰胺、6-磷酸果糖氨基转移酶 (GFAT)、乙酰辅酶A和三磷酸尿苷(UTP)产生尿苷二磷酸N-乙酰氨基葡萄糖 (UDP-GlcNAc)。O-GlcNAc的生物合成由两种酶分别控制,即O-GlcNAc转移酶 (OGT) 和O-GlcNAc (OGA)。OGT 将来自UDP-GlcNAc基团的单个N-乙酰氨基葡萄糖 (GlcNAc) 连接到目标蛋白的丝氨酸 (Ser) 或苏氨酸 (Thr) 残基,形成UDP-GlcNAc。相应地,OGA 催化从氨基残基中去除 GlcNAc 部分(图 1)。
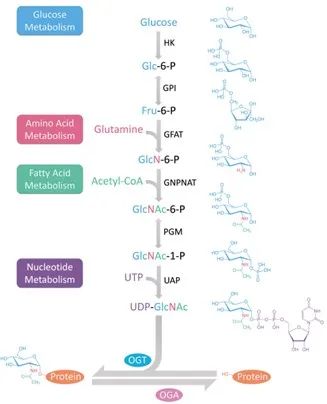
图1. 己糖胺生物合成途径(HBP)和O-GlcNAcylation
HBP 合成的 UDP-GlcNAc 是来自葡萄糖、氨基酸、脂肪酸和核酸代谢途径的代谢物。因此,UDP-GlcNAc 对所有这些营养物质都很敏感。而 OGT 对 UDP-GlcNAc 的活性和底物选择性都非常敏感。因此,UDP-GlcNAc 是新陈代谢的主要节点,而 O-GlcNAc 在细胞中充当“营养传感器”。异常的 O-GlcNAcylation 与许多人类疾病有关,包括癌症、糖尿病、心血管疾病和神经退行性疾病。

图2. O-GlcNAcylation 调控多种细胞功能及生理/病理活动
(二) O-GlcNAc 调节酶的活性。
已发现 O-GlcNAc 以多种方式调节细胞内蛋白质,包括酶活性、转录活性、亚细胞定位、分子间相互作用和蛋白酶体降解。O-GlcNAcylation 已在100多种激酶上得到证实调节酶活性,约80%的激酶是 OGT 的底物;O-GlcNAc 改变转录因子的活性或 OGT 过表达时 O-GlcNAcylation 水平升高增加 FoxO1 的转录活性;O-GlcNAc 改变蛋白质的亚细胞定位,在前列腺癌细胞系 (DU-145)中,当用 OGA 抑制剂PUGNAc 处理时,β-catenin 转位到细胞质中;O-GlcNAc 调节蛋白质之间的相互作用,例如,SOX2的O-GlcNA 酰化减少了其与PARP1的相互作用,将O-GlcNAcylation 的Ser 248位点突变为丙氨酸,SOX2和PARP1之间的相互作用增加。
O-GlcNAc 还可以调节蛋白质的稳定性。肿瘤抑制因子 p53 在 Thr155 的磷酸化将其标记为多泛素化和降解,p53 蛋白的积累导致细胞周期停滞。O-GlcNAc可添加到相邻位点(Ser149),从而阻断 Thr155 的磷酸化以及随后的泛素化和降解。
(一) O-GlcNAc 与人类疾病
1. O-GlcNAc 和癌症
Warburg 效应是癌细胞代谢的标志。它是指能量产生从有效的氧化磷酸化途径转移到糖酵解。这种效应赋予癌细胞在低氧环境下的优势,这是由于它们的快速和无限生长。然而,在有氧条件下也观察到了Warburg 效应。它包括由缺氧诱导因子-1 (HIF-1) 和癌基因诱导的葡萄糖转运蛋白和糖酵解酶的上调。其中,HBP 的限速酶谷氨酰胺果糖-6-磷酸氨基转移酶 (GFAT1) 上调,导致葡萄糖通量增加,UDP-GlcNAc水平升高,OGT 活性增强,最后细胞中 O-GlcNAc 水平升高。
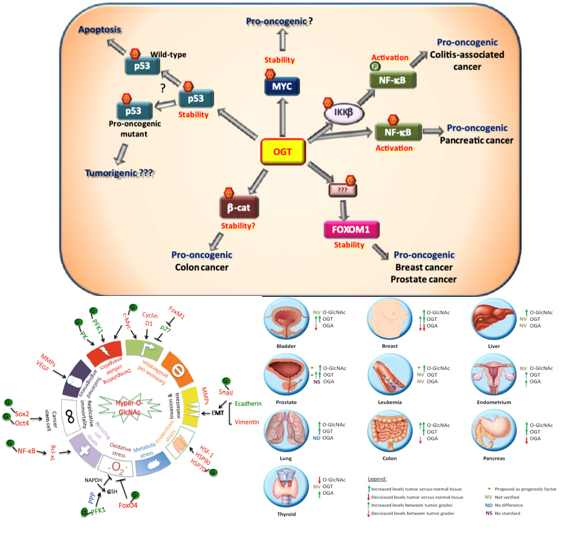
图3. O-GlcNAcylation调控致癌转录因子及肿瘤代谢
磷酸果糖激酶 1 (PFK1) 是糖酵解途径中的限速酶。在转化的癌细胞中,缺氧会诱导 PFK-1 上 Ser 529 残基发生O-GlcNAcylation,从而抑制该酶的活性。这将葡萄糖通量转向戊糖磷酸途径 (PPP)。提高的 PPP 通量通过提供更多NADPH 和谷胱甘肽 (GSH),从而保护癌细胞免受活性氧 (ROS) 介导的细胞死亡。
O-GlcNAcylation 是癌症的一般特征,已发现源于不同部位的肿瘤包括乳房、前列腺、胰腺、肺和结肠存在 O-GlcNAcylation。在胰腺导管腺癌细胞 (PDAC) 中,NF-κB和IKKα/IKKβ的p65 亚基发生 O-GlcNAcylated。通过敲除OGT来减少细胞的 O-GlcNAcylation 会抑制 p65亚基的 Ser 536 上的磷酸化,进而通过损害 p65 的核定位和抑制其转录活性来抑制 p65,降低了 p65 靶基因如 cyclin D1、Vimentin 和 Bcl-xL 的表达。事实上,在所有癌症类型中都观察到 O-GlcNAcylation,并且有学者提出将 O-GlcNAcylated 蛋白(例如 hnRNP A2/B1和annexin A2)作为癌症生物标志物。在癌症中,异常的O-GlcNAcylation 既是细胞代谢改变的结果,也是癌症的发生、进展和侵袭的促成因素。
2.O-GlcNAc 与糖尿病
糖尿病是代谢性疾病。影响糖尿病的中心通路是胰岛素信号传导。根据胰岛素信号受到的影响,糖尿病可分为两种类型即1型和2型。1 型糖尿病是由胰岛素产生不足引起的,通常是由于胰腺 β 细胞的损失。在 2 型糖尿病中,胰岛素的产生可能会或可能不会受损,但是,骨骼肌、肝脏和脂肪组织等组织不再对胰岛素产生反应。异常 O-GlcNAcylation 直接参与这两种糖尿病的病因,以及症状的发展,例如葡萄糖毒性、糖尿病性心肌病、肾病、视网膜病变。
注射链脲佐菌素(STZ)诱导小鼠和大鼠胰腺 β 细胞凋亡,表现为I型糖尿病。STZ是一种弱抑制 OGA 的GLCNAC 类似物。葡萄糖和氨基葡萄糖增强了其对β细胞的毒性,而氨基葡萄糖合成缺乏(GFAT敲低)的转基因小鼠对 STZ 诱导的高氧葡萄糖酰化、β 细胞凋亡和高血糖有抵抗作用。
Hyper-O-GlcNAcylation 还在胰岛素抵抗的发展中发挥作用,这是2型糖尿病的关键特征。Hyper-O-GlcNAcylation 改变了胰岛素信号通路的下游事件,尤其是与葡萄糖处理相关的事件。胰岛素刺激后,磷酸肌醇依赖性激酶 1 (PDK-1) 通过磷酸化 Akt 的Thr308 位点并激活它,活化的 Akt 通过 Ser9 磷酸化糖原合酶激酶3 (GSK3) 来抑制 GSK3。GSK3 是糖原合酶 (GS) 的负调节剂。结果,GS 的活性增强,有助于细胞对葡萄糖的摄取。在 3T3-L1 脂肪细胞中诱导高 O-GlcNAcylation 会降低 Akt (Thr308) 上的磷酸化,导致 GSK3 (Ser9) 上的磷酸化降低、葡萄糖摄取受损和胰岛素抵抗。此外,小鼠肝脏中 OGT 的过表达会改变多种途径中基因的表达,包括糖原合成、糖酵解、糖异生和脂肪生成。它还会导致胰岛素抵抗和血脂异常。总之,hyper-O-GlcNAcylation 不仅减弱了质膜上的胰岛素信号传导,而且还削弱了有助于葡萄糖摄取的下游信号。
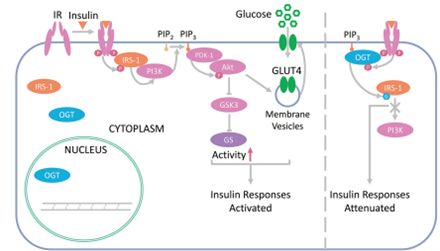
图4. O-GlcNAcylation抑制胰岛素信号通路
3. O-GlcNAc 与神经退行性疾病
阿尔茨海默病 (Alzheimer’s disease, AD) 是一种以记忆丧失为特征的慢性疾病,大多数AD是与衰老相关的代谢疾病,与葡萄糖代谢密切相关,AD 患者大脑中的葡萄糖代谢受损,与1和2型糖尿病相比,AD 的特征是大脑中的低 O-GlcNAc 酰化。神经原纤维缠结 (NFT)是AD进展的标志。NFT 是由 tau(一种微管相关蛋白)在其过度磷酸化状态下聚集形成的,小鼠大脑中 OGT 的基因缺失会导致 tau 过度磷酸化,tau 的过度磷酸化与 AD 中的神经元凋亡和小鼠的早期死亡有关。
帕金森病 (Parkinson’s disease,PD) 是由中脑黑质中的多巴胺能神经元退化引起的。α-突触核蛋白(α-Synuclein)聚集成淀粉样蛋白纤维是 PD 发展的核心事件,α-突触核蛋白是一种小蛋白,以高浓度存在于突触中。它促进膜结合囊泡的运输和第二信使的释放。在 PD 大脑中,发现α-突触核蛋白会形成有毒聚集体,这与患者的神经退化有关。O-GlcNAc 对α-突触核蛋白的聚集具有抑制作用,可保护神经元免受蛋白质聚集体的毒性并减轻 PD 的进展。

图5. O-GlcNAcylation和神经退行性疾病
4. O-GlcNAc 与心血管疾病
心力衰竭 (HF),也称为心功能不全,是许多心脏病的最终结果。同时,代偿性心脏肥大可能在持续压力下演变为心衰,据报道,蛋白质 O-GlcNAcylation与心脏肥大和心衰都相关。心脏肥大中c-Myc、肌钙蛋白I和肌钙蛋白T等几种蛋白质的O-GlcNAcylation水平明显升高,并导致心脏重塑。
内皮细胞产生的一氧化氮 (NO) 是预防血管疾病的重要调节剂,Akt 磷酸化并激活内皮一氧化氮合酶 (eNOS)。糖尿病中的Hyper-O-GlcNAcylation抑制IR/IR S/PI3K/Akt通路和Akt的活性,高血糖导致胰岛素诱导的eNOS 激活受损。在糖尿病小鼠中,hyper-O-GlcNAcylation 加速了血管钙化过程。此外,高-O-GlcNAcylation 会加重动脉粥样硬化。Hyper-O-GlcNAcylation 还通过激活钙/钙调蛋白依赖性蛋白激酶II (CaMKII) 导致糖尿病性心肌病和心力衰竭。CaMKII 表达和活性的增加有助于心肌病的进展,抑制这种激酶对心力衰竭有益。

图6. O-GlcNAcylation调控心血管功能
小编总结
O-GlcNAcylation是一种普遍存在的翻译后修饰,在调节生理及病理功能中起关键作用,异常O-GlcNAcylation与人类疾病相关,尽管许多详细的机制仍然未知,但已发现通过直接或在转录水平上修饰蛋白质,蛋白质的O-GlcNAcylation 可进一步干扰电信号级联、能量代谢、细胞周期、应激反应和血管功能。因此,加深O-GlcNAcylation在生理或病理中发挥作用的机制理解可能有助于发现疾病治疗方法的新靶标。
参考文献:
1. GlcNAcylation and cardiovascular disease. Biochemical Society transactions, 45(2), 545–553. https://doi.org/10.1042/BST20160164
2. Targeting O-GlcNAcylation to develop novel therapeutics. Molecular aspects of medicine, 79, 100885. https://doi.org/10.1016/j.mam.2020.100885
3. O-GlcNAc in cancer biology. Amino acids, 45(4), 719–733. https://doi.org/10.1007/s00726-013-1543-8
4. O-GlcNAcylation: The Sweet Side of the Cancer. Frontiers in oncology, 4, 132. https://doi.org/10.3389/fonc.2014.00132
5. Role of O-Linked N-Acetylglucosamine Protein Modification in Cellular (Patho)Physiology. Physiological reviews, 101(2), 427–493. https://doi.org/10.1152/physrev.00043.2019
2022年度国自然医学部国自然40大科研热点的中标数统计如下:
2022热点 | 2022中标数 | 2022热点 | 2022中标数 |
免疫调控 | 907 | 中性粒细胞 | 112 |
巨噬细胞 | 591 | 反馈回路 | 104 |
线粒体 | 491 | 乳酸化 | 104 |
血管功能 | 487 | 可变剪接 | 71 |
外泌体 | 470 | AI机器学习 | 67 |
自噬 | 404 | 类器官 | 67 |
铁死亡 | 337 | 炎症小体 | 62 |
干细胞 | 329 | 染色质重塑 | 58 |
代谢重编程 | 325 | 单细胞测序 | 54 |
m6A/m5C/m7G | 320 | 糖基化 | 50 |
泛素化 | 225 | 低氧缺氧 | 50 |
circRNA | 221 | 相分离 | 50 |
lncRNA | 204 | 泛凋亡PANoptosis | 42 |
细胞焦亡 | 175 | 细胞衰老 | 37 |
组蛋白 | 171 | 胞葬 | 33 |
肠道菌群 | 133 | CRISPR | 33 |
乙酰化 | 125 | 增强子 | 29 |
内质网 | 125 | 精氨酸甲基化 | 25 |
转录调控 | 112 | 迁移体 | 8 |
糖酵解 | 112 | 血管拟态 | 8 |
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)