面对迅猛发展的新冠疫情,我国亟需高效抗新冠病毒药物。尽管辉瑞公司的Paxlovid(奈玛特韦-利托那韦)和国产原研药阿兹夫定早已获得应急附条件批准治疗Covid-19,但或由于供应不足,或由于缺乏高质量证据,其远远不能满足临床需求。北京时间今日清晨,《新英格兰医学杂志》(NEJM)发表一项中国非劣效性3期随机对照临床试验,其结果表明,对于有高危因素的轻中度Covid-19成人患者,在至持续临床康复时间方面,国产VV116非劣于Paxlovid(4天 vs. 5天;风险比,1.17;95%置信区间,1.02~1.36),且不良事件更少。这项试验由上海瑞金医院赵任教授、上海仁济医院皋源教授和上海瑞金医院宁光院士牵头,在7家上海医院开展,是omicron变异株流行期间首个针对Covid-19患者开展的国产口服抗病毒药物“头对头”3期临床试验。VV116是由中国科学院上海药物研究所与武汉病毒研究所、新疆理化技术研究所等单位共同研发的一种新冠病毒RNA复制酶小分子抑制剂。这是NEJM发表的首个中国自主研发的新冠创新药临床试验,其在3~5月的上海极度困难时期高质量完成,尤为难能可贵。《NEJM医学前沿》特邀药理学家、中科院院士丁健教授和呼吸重症专家曹彬教授分别从药理学和临床试验角度解读这项研究。全球顶级权威期刊《新英格兰医学杂志》(The New England Journal of Medicine,NEJM,影响因子:176.079)
中日友好医院呼吸与危重症医学科;国家呼吸医学中心;中国医学科学院呼吸病学研究院VV116是我国首个国产靶向新冠病毒RdRp的小分子药物抑制剂。在2022年3至5月的上海疫情期间,研究者快速设计并开展了一项头对头的非劣效性临床试验(ChiCTR2200057856,NCT05341609),目前该药物临床试验结果通过同行评议,于北京时间12月29日在《新英格兰医学杂志》(NEJM)上发表[1]。该研究首次报道了omicron流行情况下使用VV116和Paxlovid对高危因素的人群症状改善时间的数据,可以为后续临床试验设计以及临床用药指导提供重要参考价值。为更好理解研究初衷和临床试验设计,有必要先梳理一下当时临床试验的背景。首先,一系列高质量临床研究相继证明:小分子抗病毒药物molnupiravir(莫努匹韦;发病5天内)、Paxlovid(发病5天内)和瑞德西韦(发病7天内)早期使用,可减少具有高危因素人群重症和死亡事件发生。这些临床试验主要集中在2020~2021期间,主要流行delta毒株,而且大多数受试者未接种新冠疫苗。但在VV116研究设计时,有几个重要因素需要考虑:(1)上海的流行毒株为omicron BA.2,致病力较delta下降;(2)我国上海地区大部分人群完成了疫苗接种;(3)Paxlovid已经被我国CDE批准并被纳入卫健委诊疗方案,成为具有高危因素人群标准抗病毒药物。研究团队设计了多中心随机对照非劣效的临床试验,旨在评估VV116 vs. 对照药物(辉瑞Paxlovid)对轻型和普通型具有高危因素的Covid-19患者的疗效。最终VV116和Paxlovid组各招募384和387受试者。人口学信息和基线情况结果表明仅有23.4%未接种新冠疫苗;92.1%属于轻型。主要终点(临床症状恢复时间)结果表明,VV116 组中位症状恢复时间为4 天,Paxlovid组症状恢复时间为5天(风险比,1.17;95%置信区间,1.02~1.36)。众所周知,抗病毒药物距离发病的使用时间,是影响药物效果的关键因素。发病时间5天内使用抗病毒药物两组间无明显差异。按照年龄、疫苗、疾病严重程度、发病时间等因素进行亚组分析,结果均与全分析集(FAS)结果保持一致,即VV116与Paxlovid在临床症状恢复时间方面相当。病毒学结果是评估抗病毒药物十分重要的次要临床终点。在新冠病毒(鼻咽拭子)转阴方面,两组也保持了相当的水平。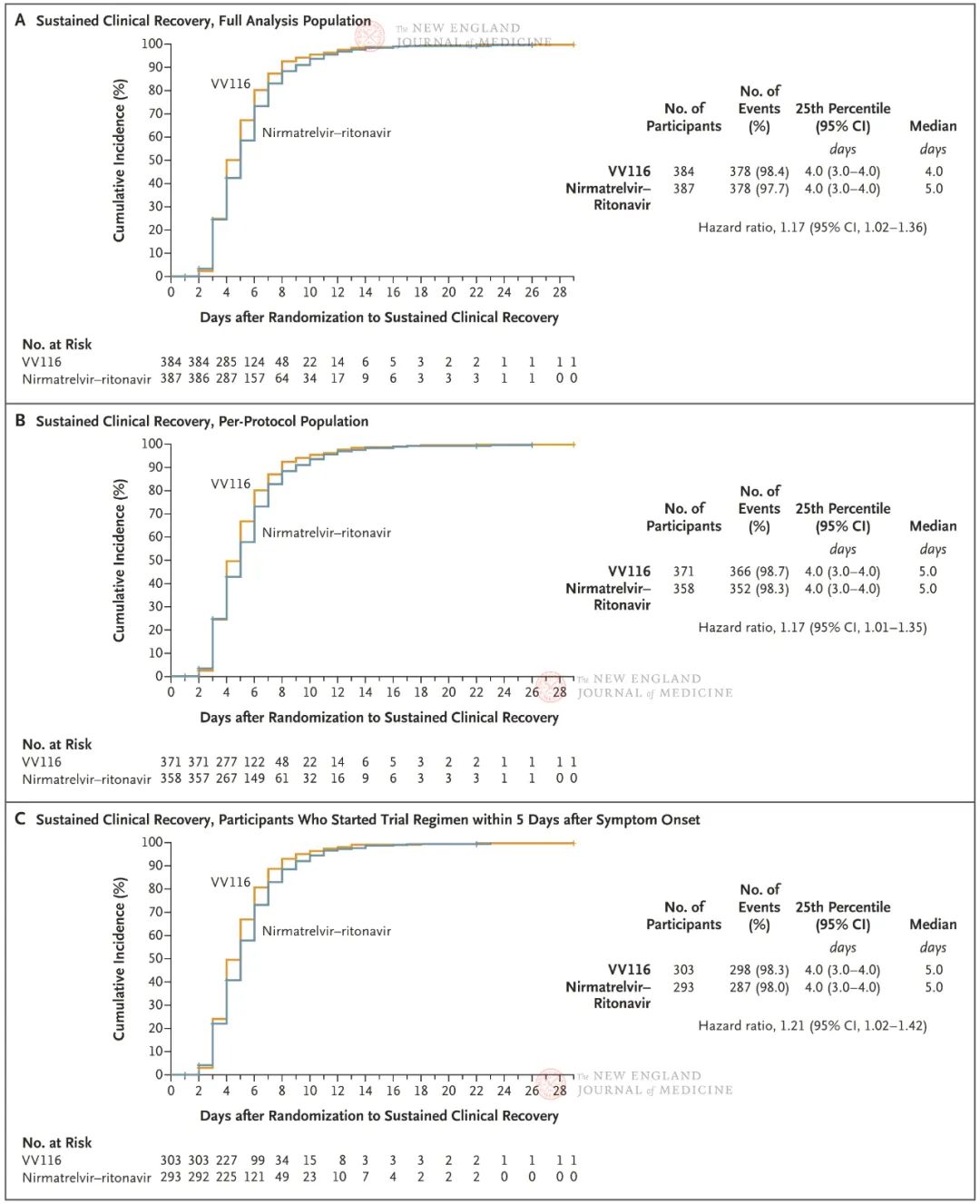
至症状恢复时间
在安全性方面,VV116与Paxlovid也表现出类似良好的安全性,甚至在某些不良反应发生率方面低于Paxlovid,尤其是味觉障碍。Paxlovid是奈玛特韦(3CL抑制剂)和利托那韦(用于提高血药浓度)的复合制剂,其中利托那韦因通过肝脏的CYP3A4酶代谢,与众多药物存在相互作用(可具体参考说明书或使用说明)。对部分无法停用基础用药的患者十分不便。因此,在安全性和用药方便性方面,VV116可能更为良好。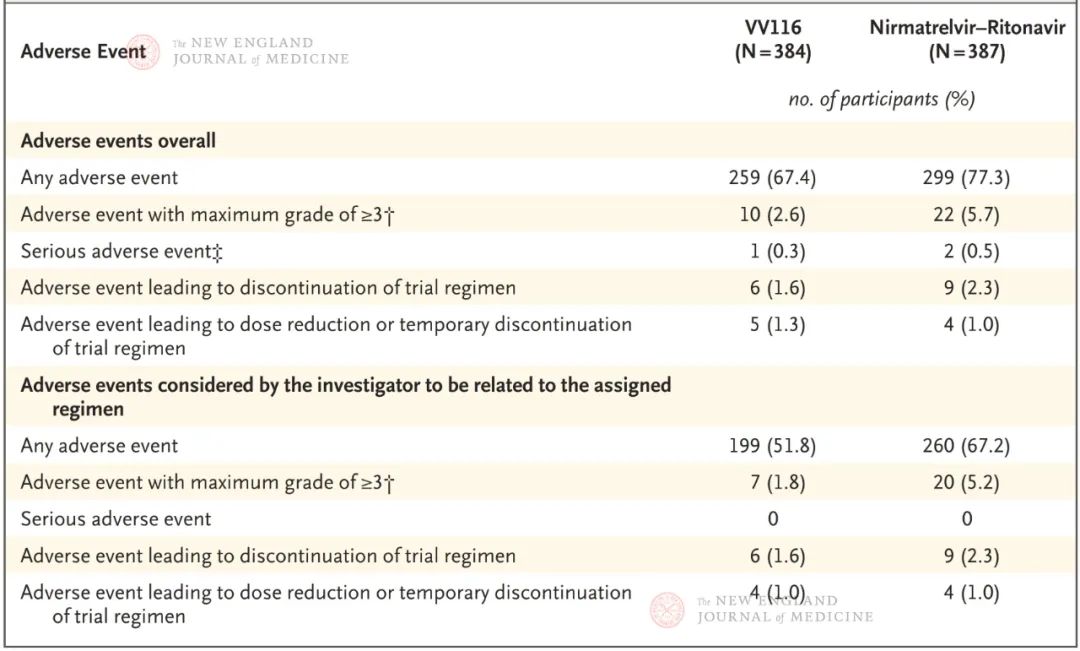
丁健
中国科学院大学药学院
抗新冠病毒药物是有效应对疫情的重要手段之一,尤其是我国在疫情有效防控取得积极重大成果的基础上,出台二十条优化措施和疫情防控新十条,实施疫情更加科学精准防控,更加需要加强抗新冠药物的研发、生产和储备。口服小分子抗新冠病毒药物具有使用方便、可及性好等方面的优势,将在当前和今后疫情防控中发挥重要作用。这项由上海瑞金医院赵任教授、上海仁济医院皋源教授和上海瑞金医院宁光教授牵头,7家来自上海的医院参与的“VV116与奈玛特韦-利托那韦口服治疗Covid-19比较”的临床研究结果表明,VV116与帕罗韦德(Paxlovid,奈玛特韦-利托那韦)对比,在患者持续临床恢复时间、病毒核酸转阴等方面,VV116均非劣于Paxlovid,且不良事件的发生率低于Paxlovid [1]。关于君实生物
君实生物(688180.SH,1877.HK)成立于2012年12月,是一家以创新为驱动,致力于创新疗法的发现、开发和商业化的生物制药公司。公司具有由超过50项在研产品组成的丰富的研发管线,覆盖五大治疗领域,包括恶性肿瘤、自身免疫系统疾病、慢性代谢类疾病、神经系统类疾病以及感染性疾病。
自2020年疫情爆发之初,君实生物迅速反应,与国内外科研机构及企业携手抗疫,利用技术积累快速开发了多款治疗COVID-19的创新药物,积极承担中国制药企业的社会责任。其中包括:国内首个进入临床阶段并参与全球抗疫的新冠病毒中和抗体埃特司韦单抗(JS016)于2021年在超过15个国家和地区获得紧急使用授权,新型口服核苷类抗新冠病毒药物VV116(JT001)已进入国际多中心III期注册临床研究阶段,以及其他多种类型药物,持续为全球抗疫贡献中国力量。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。








发表评论
注册或登后即可发表评论
登录注册
全部评论(0)