
化学诱导的临近效应(Chemical Induced Proximity,CIP)或化学诱导的二聚化(Chemically Induced Dimerization,CID)是指利用化学小分子诱导两种生物大分子发生临近互作而调控细胞进程,目前已成为调控细胞活性的重要手段,从细胞信号转导,到基因表达调控等等均可用CIP或CID实现。
现今广泛应用的CIP/CID系统主要有雷帕霉素系统、脱落酸系统、赤霉素系统和TMP-Cl系统。这些化学小分子临近诱导剂可以诱导蛋白质之间的相互作用,进而可以时间和空间分辨地对细胞进程进行调控。然而,传统的CIP/CID系统需要通过遗传修饰的方法对目标蛋白进行修饰融合外源标签才能发挥相应的功能,使得CIPs无法直接调控无配体靶标或者内源蛋白,也限制了在治疗疾病转化方面的前景。寻找可以直接调控内源蛋白,特别是靶向内在无序蛋白地内源性靶标的方法至关重要。近日,哈尔滨工业大学生命科学中心陈西课题组在 Nature Communications 期刊发表了题为:small molecule-nanobody conjugate induced proximity controls intracellular processes and modulates endogenous unligandable targets 的研究论文,在CIP领域取得了新的突破。该研究提出了基于小分子偶联纳米抗体的新一代临近诱导体系——SNACIP,首次将CIP技术用于调控内源的内在无序蛋白(intrinsically disordered
protein,IDP)靶标,并通过抑制微管分支成核而抑制肝癌肿瘤增生,解决了相关领域多年以来的难题。
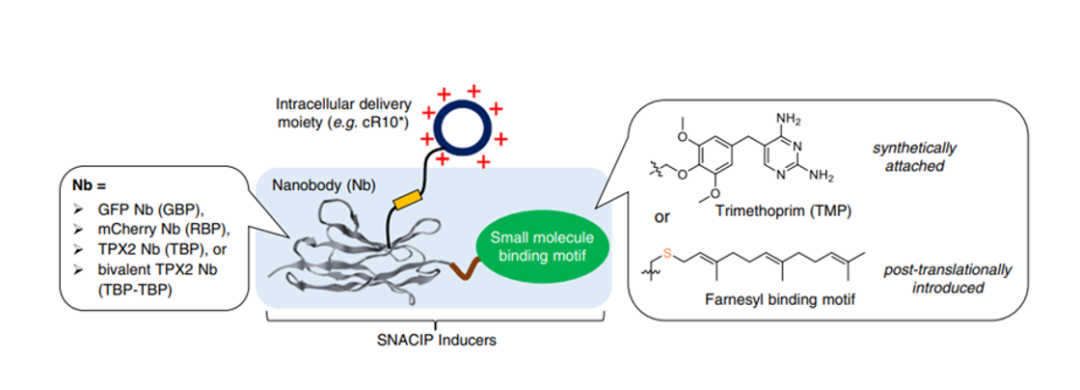
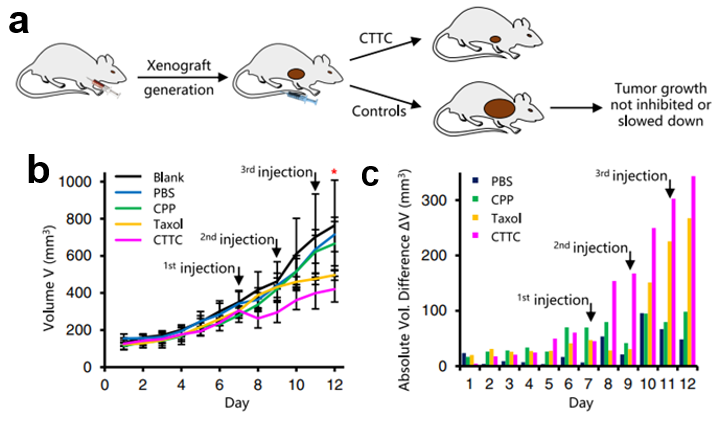
SNACIP临近诱导体系既能像传统CIP分子那样成为通用型的调控细胞进程的工具,还可实现对细胞内无配体识别靶标和内在无序蛋白的调控。研究团队通过将CIP临近诱导技术、纳米抗体化学工程化技术、以及环状跨膜肽非内吞递送体系这三个近年来不同领域的创新性突破交叉融合,设计出SNACIP诱导体系,用于解决CIP发展中所面临的困局。其中纳米抗体作为一种来源于骆驼科的仅含有单链重链可变区的最小抗原识别片段(VHH),相对于传统抗体有更小的分子量,仅有15kDa左右,因此具有更好的穿膜性。与小分子相比,纳米抗体具有良好的特异性和纳摩级乃至皮摩级的亲和力,可以更特异,更强地结合目标蛋白。因此利用纳米抗体作为CIP分子的模块之一,可以扩展传统CIP的应用范围以及实现直接对内源性蛋白质的快速调控。将纳米抗体与小分子配体偶联,利用纳米抗体来特异性结合目标蛋白,同时利用小分子配体来实现临近诱导,最后再整合环十精氨酸细胞跨膜肽(cyclic decaarginine, cR10*)以实现非内吞快速跨膜(t1/2<10min),最终发展出能应用于胞内靶标的SNACIP新一代临近诱导调控体系。在研究中将EGFP的纳米抗体GBP与eDHFR的结合配体TMP偶联,同时添加环十精氨酸细胞跨膜肽(cR10*)组装成cRGT。研究团队将cRGT与广泛应用的雷帕霉素(Rap)、脱落酸(ABA)和赤霉素(GA3AM)三种CIP分子进行了比较,cRGT不具有Rap一样的钩型效应,具有与ABA相似的动态范围,相比于GA3AM,cRGT可以利用TMP进行可逆调控。基于以上结果,研究团队之后又将SNACIP应用到信号转导,转运和铁死亡等多个细胞进程中。展现出SNACIP作为一种新的CIP分子可以直接调控内源靶标的优越特性,突破传统CIP应用的限制屏障。天然无序内源蛋白IDPs是目前大家关注的热点,因其结构内在无序,而导致无法成功解析出晶体结构,容易产生相分离现象,难以开发出相应的小分子配体来识别。其中,纺锤体组装中的一个关键微管成核因子TPX2就是属于天然无序蛋白。这个蛋白因子在诸多癌细胞中过量表达,被认为是一个治疗癌症的很有前景的靶点。此外,通过靶向微管分支成核而非仅仅结合微管本身,也被认为是治疗癌症的更优选方案,因为这样可以避免微管结合试剂的毒副作用,包括对神经系统的伤害(微管对于神经的功能极为重要)。但是通过靶向微管成核而抑制肿瘤的药物仍未开发出来,其中一个关键因素就是微管成核因子大都是天然无序蛋白。为此,陈西课题组首先利用噬菌体展示手段筛选出人源TPX2的纳米抗体,利用SNACIP技术,开发出了靶向微管成核的SNACIP诱导剂,不仅在细胞层面很好地抑制了癌细胞的增殖,而且在活体层面也有效抑制了肿瘤的增殖,解决了上世纪90年代微管成核现象被发现以来二十余年未能开发出靶向微管成核过程而抑制肿瘤增生的药物的问题。通过与经典的直接结合微管的抗癌药物紫杉醇相比,靶向微管分支成核的SNACIP药物不仅起效快,而且效果显著,同时规避了的佐剂的毒性,显示出靶向微管成核比直接结合微管的抗癌药物优越的特点。这个应用也展示了SNACIP技术的重要应用潜力,未来有可能发展成为小分子和抗体药物之外第三类重要的药物形式。总的来说,这项工作是对传统CIP体系的良好补充,实现了对细胞内进程甚至无配体结合蛋白的有效调控。作为新一代的CIP分子,SNACIP有望在生物学基础研究和药物开发相关领域中获得更广泛的应用。哈尔滨工业大学生命科学中心化学生物学与前沿生物技术实验室陈西研究员为论文通讯作者。课题组博士研究生孙晓峰、周成健、以及科研助理夏思敏为并列第一作者。该研究受到哈工大的科研基金,国家自然科学基金,黑龙江省自然科学基金等的资助。www.nature.com/articles/s41467-023-37237-x
医微客一站式科研服务平台,致力于服务医院和企业,协助医生解决科研上的痛点,提升临床科研水平,为企业提供医学写作、医学编辑、科研培训和学术传播等策略支持。
科研资讯(站内):
百度浏览
来源 : 生物世界
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。






发表评论
注册或登后即可发表评论
登录注册
全部评论(0)