2023-05-24 来源 : BiG生物创新社
胃癌作为全球第五大癌症,中国发病率位居全球第一,长期以来危害着人类的健康。今天小编将带着大家全面了解胃癌的分类、信号通路、全球负担、风险因素,发生与发展,并从微环境与分子特征出发,简述全球药物研发现状,剖析胃癌的精准治疗策略。

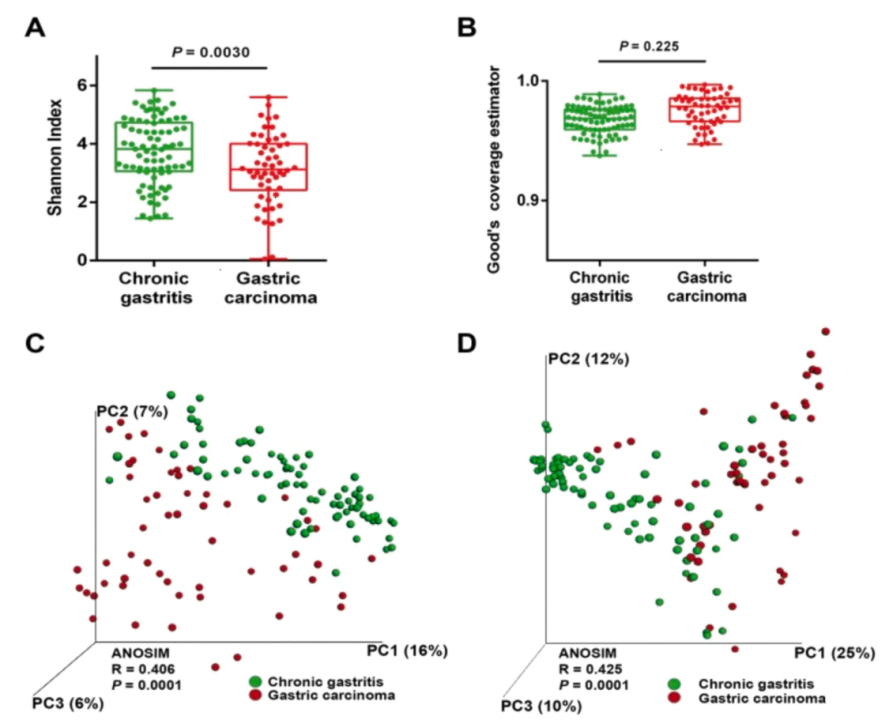
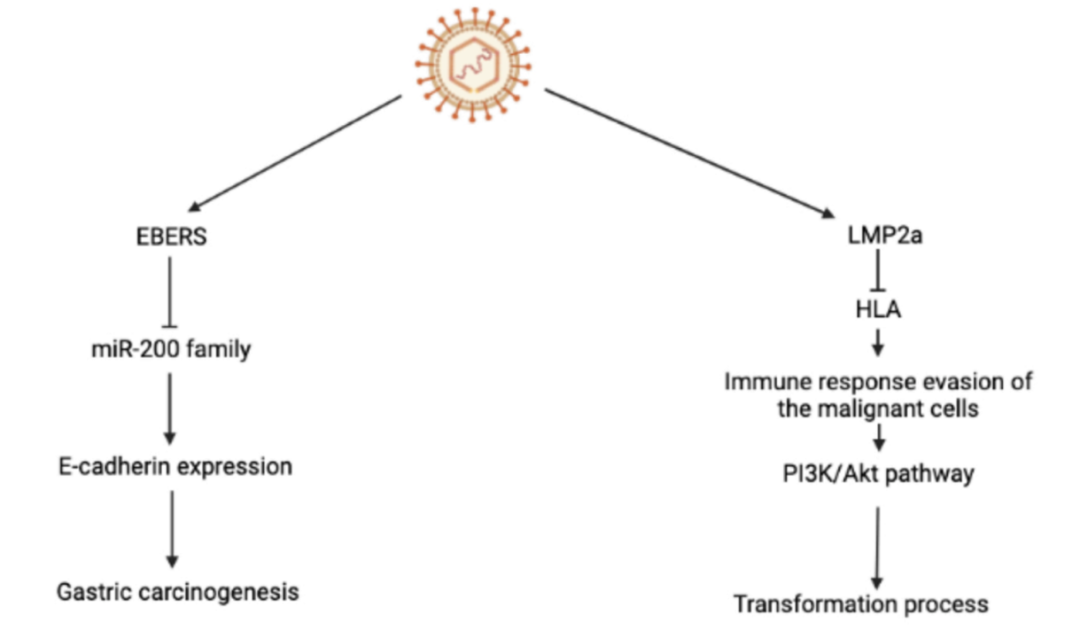
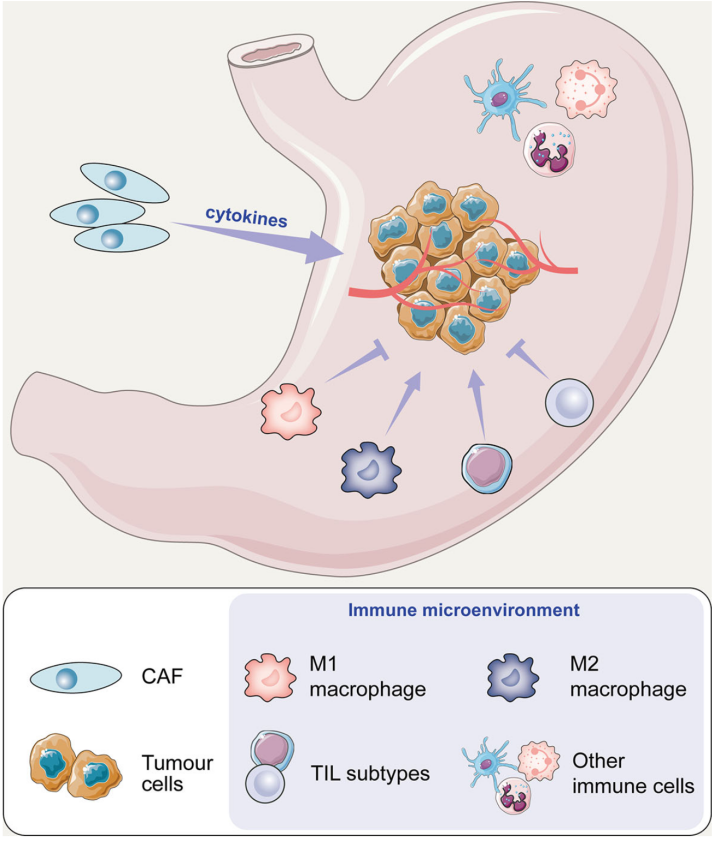
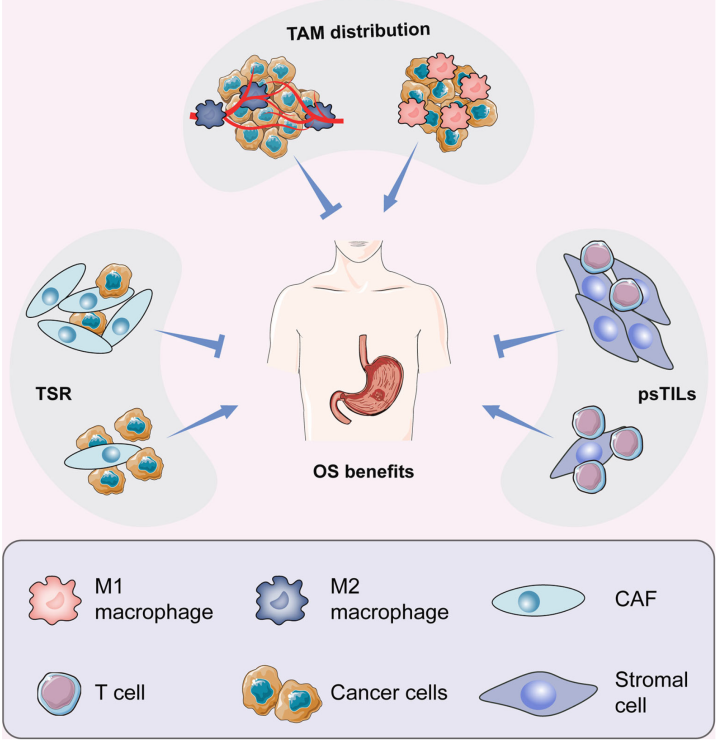
根据世卫组织全球癌症统计报告GLOBOCAN的估计,2020年,全球胃癌病例已达到108.9万(11.1/100,000),在所有癌症类型中,位列第五;与此同时2020年全球胃癌死亡人数达到76.9万,排名紧跟肺癌,结肠癌以及肝癌,位列第四。从流行病学变化趋势来看,尽管整体疾病发生率有所下降,但胃癌的发生率和死亡率有明显的地域、种族差异。有报道称,到2024年,全球胃癌病例将增长至177万。
6.1 国家人类发展指数(HDI)影响胃癌发生率
胃癌的发生率与HDI息息相关。研究表明,相对于中等或低HDI国家,高HDI国家胃癌发生率偏高,胃癌相关死亡相对偏低。值得注意的是,东亚或东南亚国家往往拥有高HDI和高毒性幽门螺旋杆菌(Hp)盛行的双重不利因素,因此这些地区几乎承接了2020年三分之二的胃癌确诊病例。与胃癌发生率相一致的是,这些地区也同时拥有较高的胃癌相关死亡率。但可喜的是,自20世纪中叶以来,大多数高HDI国家的胃癌发生率和癌症相关死亡率呈直线下降的趋势。真实数据表明,2020年,东亚,中/东欧以及南美是胃癌高发地区,其发生率分别为22.4/100,000, 11.3/100,000, 8.7/100,000。而北美相对来说则是低发地区,其发生率仅有4.2/100,000。
6.2 美国:胃癌发生率逐年下降,种族差异明显,早发型胃癌有抬头趋势
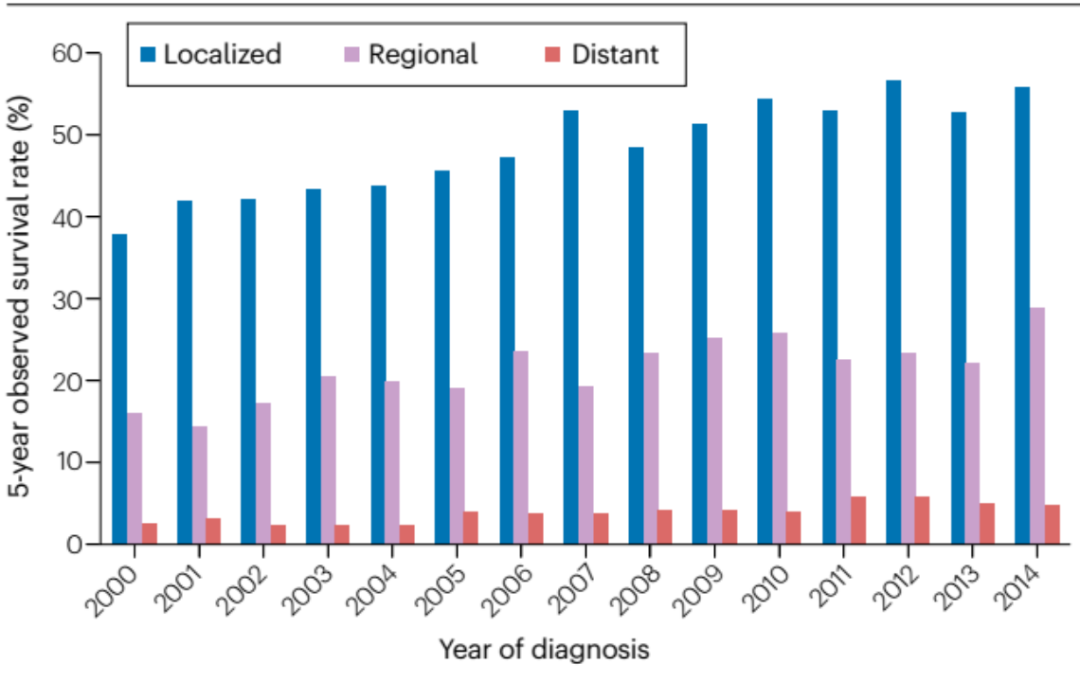
图注:美国2000年-2014年胃癌生存率
6.3 中国:胃癌发病率全球第一,胃癌筛查制度亟需完善
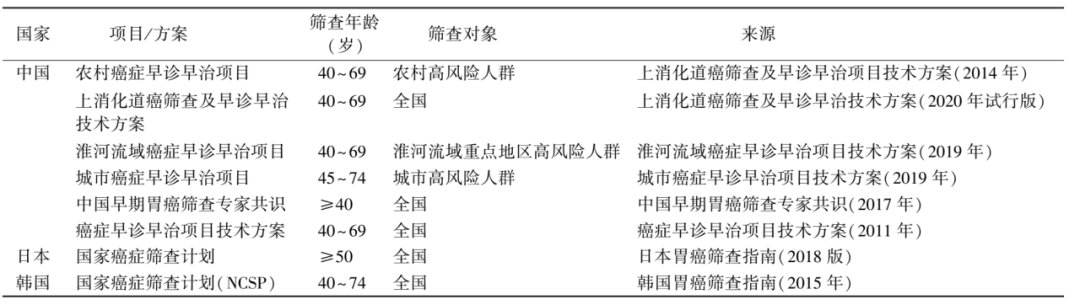
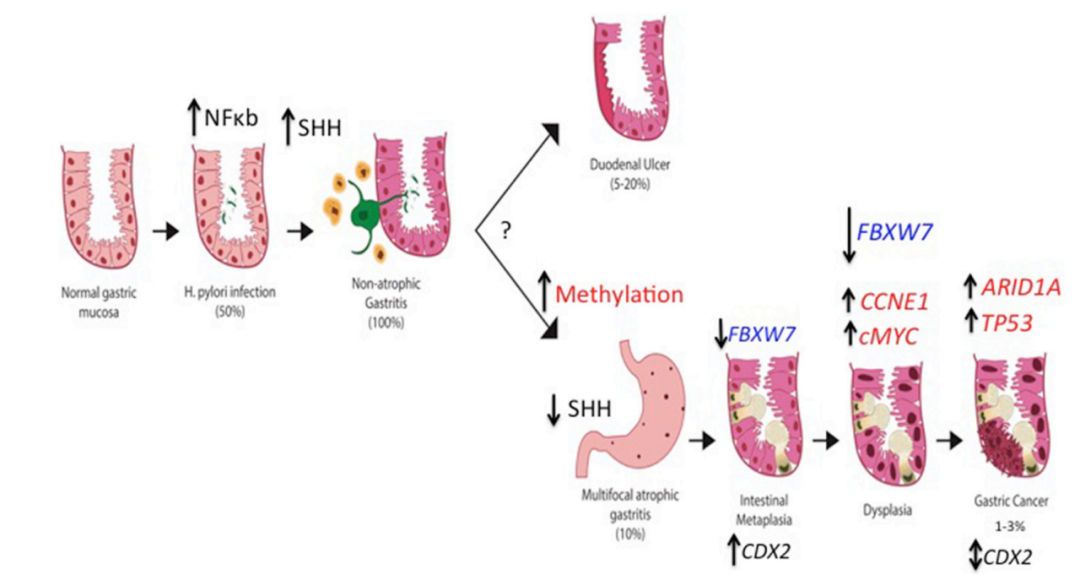
7.1 Hp感染
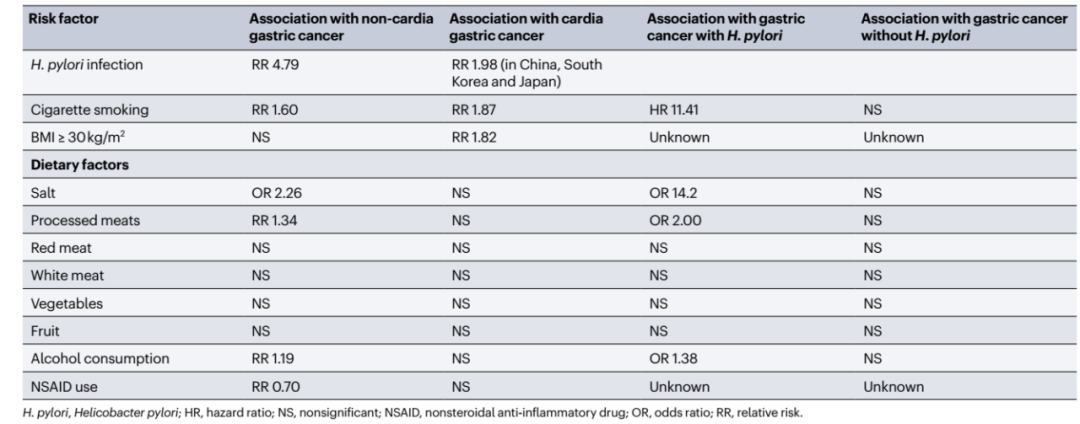
尽管Hp感染是胃癌发上的主要原因,但大约只有17%的胃癌感染者会进展成为胃癌。其中一个解释是酸性萎缩性胃炎可以减少胃酸分泌,是Hp感染发展成为胃癌的必要条件。
7.2 性别和年龄
年龄的增长是胃癌发生的高危因素。而从性别角度来说,男性的胃癌发生率几乎是女性的2~3倍。>=65岁的人群中,肠型胃癌胶弥漫型胃癌更为常见;而<70岁得老年患者和女性当中,弥漫型胃癌更为常见。
7.3 吸烟
研究表明,每日吸烟>=20支,烟龄>=40年,无论是既往吸烟者还是当前吸烟者,其均与肠型胃癌的高风险具有相关性,但与弥漫型胃癌风险无关。而戒烟可以降低未来,一项StoP研究项目表明,胃癌的发病风险随戒烟年限增加而降低。甚至戒烟超过10年的人群与从未吸烟人群的发病风险无异。
7.4 肥胖与代谢功能障碍
肥胖(BMI > =30kg/m2)这一风险因素只与贲门型胃癌的发生有显著关联(RR = 1.82),而其在各项研究中呈现不一致的结果可能是因为各地对于肥胖的定义有所不同(亚太分类系统往往将BMI>=25kg/m2定义为肥胖)。
除了BMI这一因素外,血清糖化血红蛋白水平也与胃癌风险增加相关(HR =1.36),但血清葡萄糖水平却与之无关。但另一项研究中表明,糖尿病与胃癌发病不具有直接相关性(OR = 1.01),但II型糖尿病可能会导致胃癌风险增加(OR = 1.16)。
7.5 饮食因素
与人类生活紧密不可分的饮食习惯问题一直都是风险因素研究的重地,高盐饮食可导致NaCl的过度摄入,为胃癌的发生发展营造有利环境。在一项大型的病例对照研究中发现,高盐饮食是非贲门型胃癌的显著风险因素(OR = 2.26),但因研究者发现Hp高流行地区往往偏爱高盐饮食,所以该阳性结果的成因尚不可完全确定。
在之前的临床前和临床研究中发现,饮酒可以增加活性氧的生成,使致癌物质活化,同时也会导致体内叶酸缺乏,使得DNA甲基化异常,从而导致胃癌发生。而在解剖部位分层分析之后发现,大量饮酒与非贲门胃癌相关(RR = 1,19),而与贲门型胃癌无关。
7.6 药物
除了以上危险因素之外,非甾体抗炎药(NSAIDs)的使用也已被证实可减少罹患非贲门胃癌的风险(RR=0.70),且每使用NSAIDs增加两年,胃癌风险降低11%。
7.7 遗传因素
除了以上几种后天风险因素之外,先天性因素也不容忽视。尽管胃癌的发生是随机的,但是它也可能遗传并且与特定的突变谱相关。主要有三类可遗传综合征与胃癌的发生相关,它们分别是:遗传性离散型胃癌(与CDH1和CTNNA1有关)、胃腺癌和胃近端息肉(与APC的启动子1B区域有关)以及家族性肠型胃癌(与IL12RB1突变有关)。胃癌还可作为家族性癌症综合征的症状之一,例如:林奇综合症(常见于携带MLH1或MSH2基因突变的个体)、家族性腺瘤性息肉并、Peutz-Jeghers综合征以及Li-Fraumeni综合征。
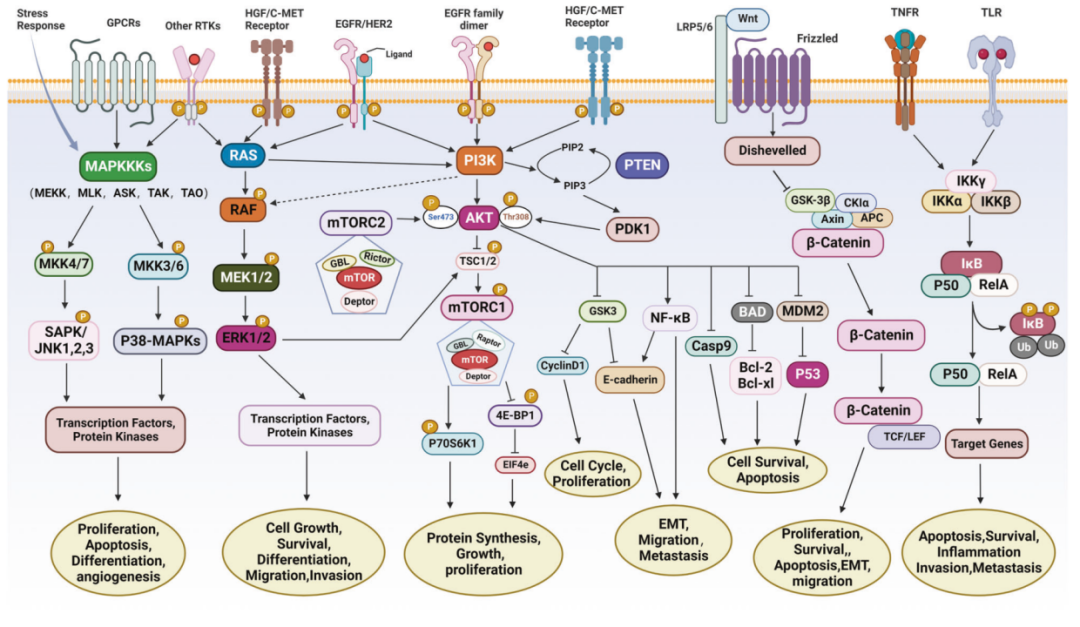
图注:主要信号通路在胃癌中的基本作用
10.1 MAPK/ERK信号通路
除此之外,大量的研究表明表观遗传调节通过MAPK/ERK通路涌向胃癌细胞生长转移。miRNA和IncRNA等非编码RNA都可通过MAPK/ERK信号通路诱导胃癌发生、发展和转移。例如:miR-592的过表达可通过靶向MAPK/ERK或者PI3K/AKT通路的SPRY-2促进胃癌细胞的增殖、迁移和侵犯;IncRNA CASC2 也可以通过调节ERK1/2和JNK/MAPK信号通路的方式一直胃癌细胞的增殖。
10.2 HER2信号通路
研究表明HER2阻断药物并不是对所有HER2阳性胃癌有效,PTEN缺陷和PISKCA突变可以直接导致下游AKT/mTOR信号异常活化,抵消HER2的抑制作用。因此全面理解EGFR家族和下游信号层级会帮助我们分辨出什么样的病人会从HER2靶向治疗中获益。
10.3 PI3K/AKT/mTOR信号通路
除此之外,大约有60%的胃癌患者mTOR异常活化,mTOR水平与胃癌的侵犯深度和淋巴结转移正性相关,且与胃癌患者的5年生存率呈负性相关。
10.4 HGF/c-MET信号通路
HGF/c-MET可预测治疗应答。过度表达的转磷酸根c-MET分子也可激发旁路信号引发相应靶向治疗的抗性。所以其与旁路通路的共抑制成为胃癌潜在治疗方向。有研究表明,携带METG1163O和D1228Y/N突变的胃癌患者可能会对TKI药物产生抗性,而携带MET V1092L, D1228G和Y1230H突变的胃癌患者则更可能从靶向治疗中获益。这表明MET突变分析对胃癌的精准治疗有利。
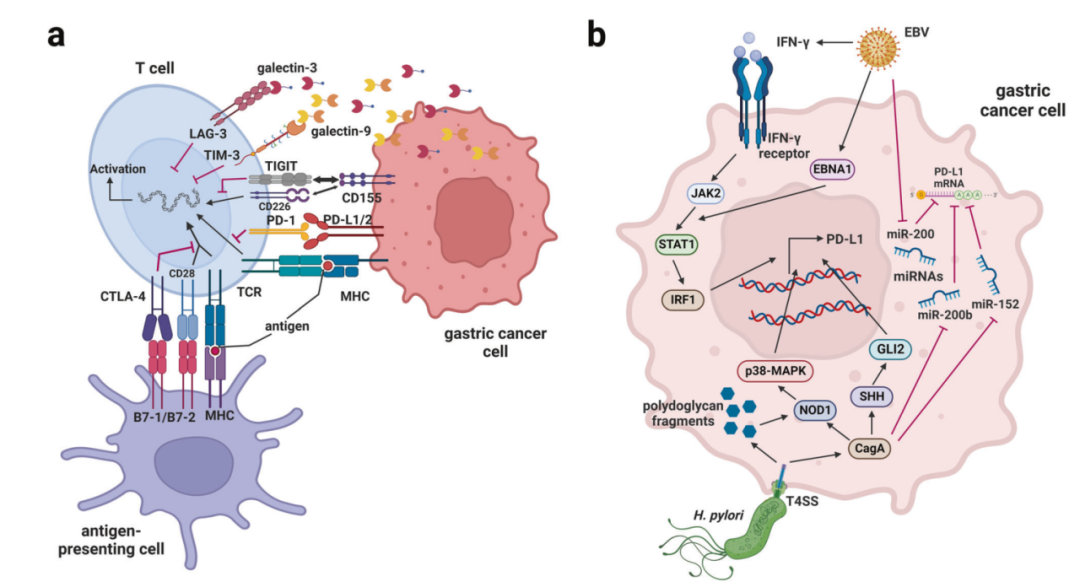
10.5 免疫检查点信号通路
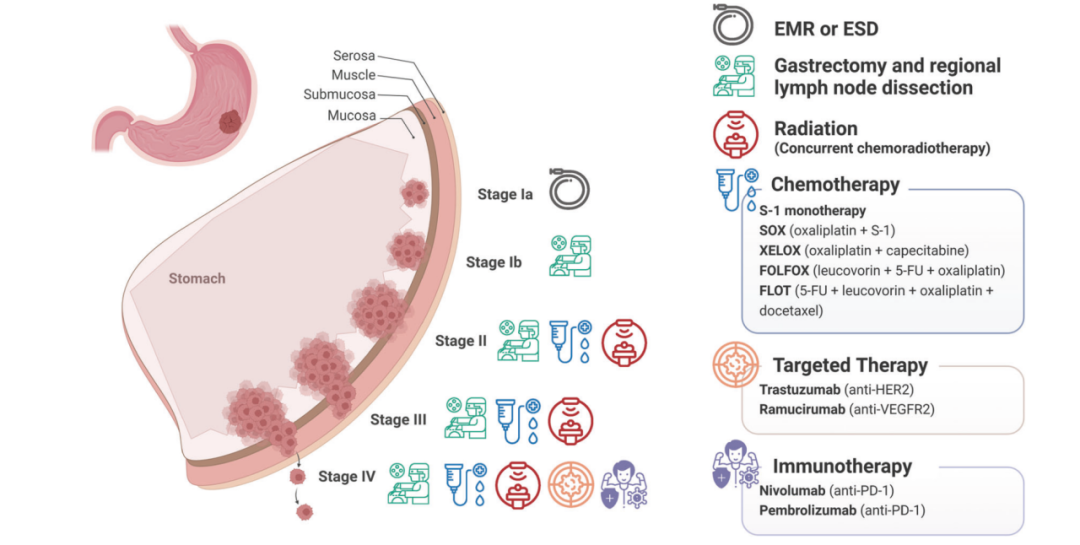
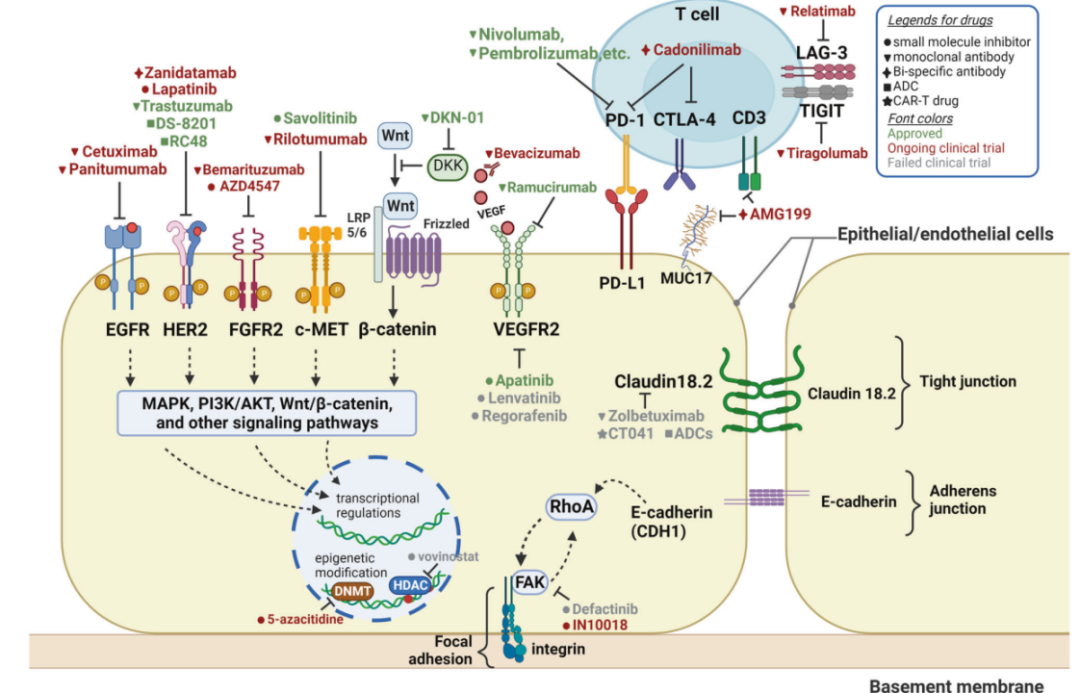
胃癌目前的治疗还是以全身性化疗和手术切除为主,病患整体预后较差。而在疾病晚期阶段,也仅有曲妥珠单抗和一些免疫检查点抑制剂(例如纳武利尤单抗和帕博丽珠单抗)对一些HER-2阳性或是PD-L1阳性的患者有着持续可信的效果。随着FGFR2、Claudin 18.2等新靶点的不断入局,小分子TKI,ADC,单抗,双特异性抗体和胃癌T疗法等技术途径齐头并进,我们正一步步向胃癌精准治疗的时代迈进。
11.1 HER2靶向治疗
2010年,一项旨在评估曲妥珠单抗(抗HER2)联合化疗一线治疗HER2阳性胃癌效应的III期试验TOGA显现了积极效果,mOS(13.8m vs 11.1m),这意味着靶向治疗胃癌的大幕正式拉开。然而开局王炸的HER2靶点在胃癌的赛道上并不一帆风顺。之后的帕妥珠单抗(抗HER2单抗)、拉帕提尼(EGFR和HER2双重TKI抑制剂)、T-DM1(抗体药物连药物)均在关键的临床试验阶段折戟。
而制约这些药物临床效果的原因也是多样化的,除了HER2的异质性以及HER2评分的复杂性以外,HER2治疗的原发耐药和获得性耐药也是重要的原因之一。如前文所述,某些基因的改变可以代偿HER2信号的阻断,抗HER2治疗也可能会驱使HER2的下调,使患者对药物无效。
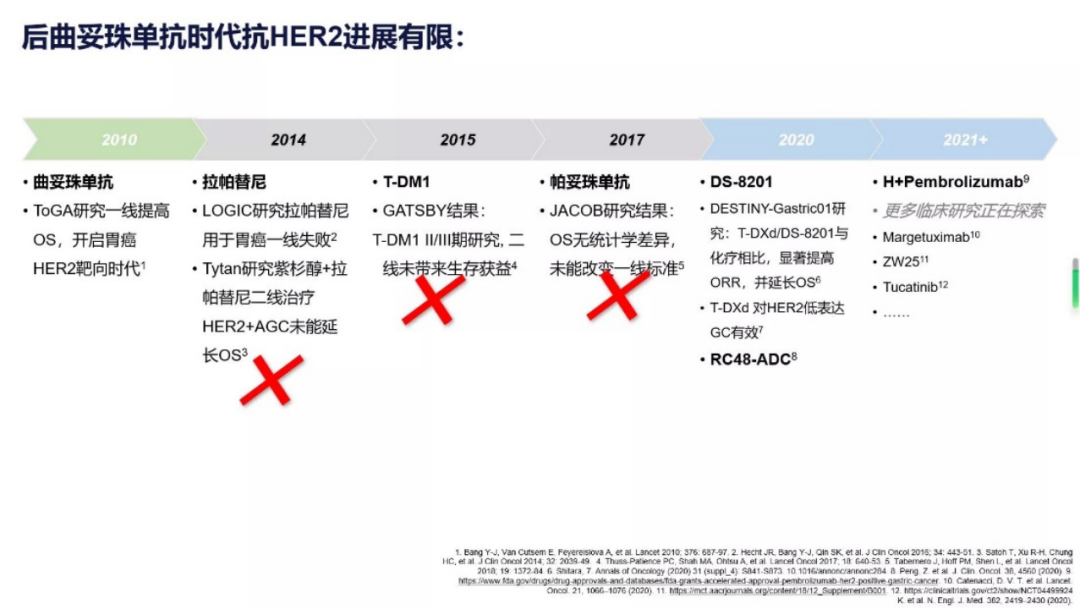
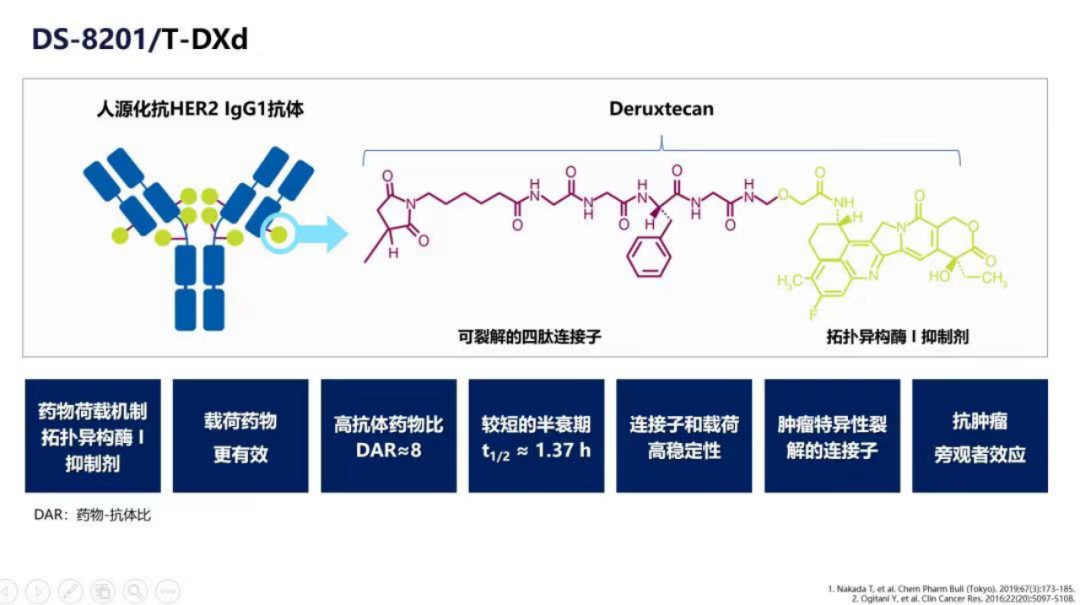
而在此领域,一些新兴的研究策略也正在冲击着曾经坚固的堡垒。新一代抗体偶连药物T-DXd的出现更是佐证了这一点,它由曲妥珠单抗,一个可裂解的四肽连接子一剂以及一种细胞毒性拓扑异构酶I抑制剂构成。在其关键临床试验DESTINY-Gastric01中,T-Dxd在胃癌患者(包含经历过前线治疗后进展的患者)中取得了显著的效果:ORR(51% vs 14%)。值得注意的是,该药物引起的旁观者效应可以破坏周围细胞,甚至在HER2低表达胃癌中表现出优异肿瘤活性,在解决HER2异质性问题上极富价值。
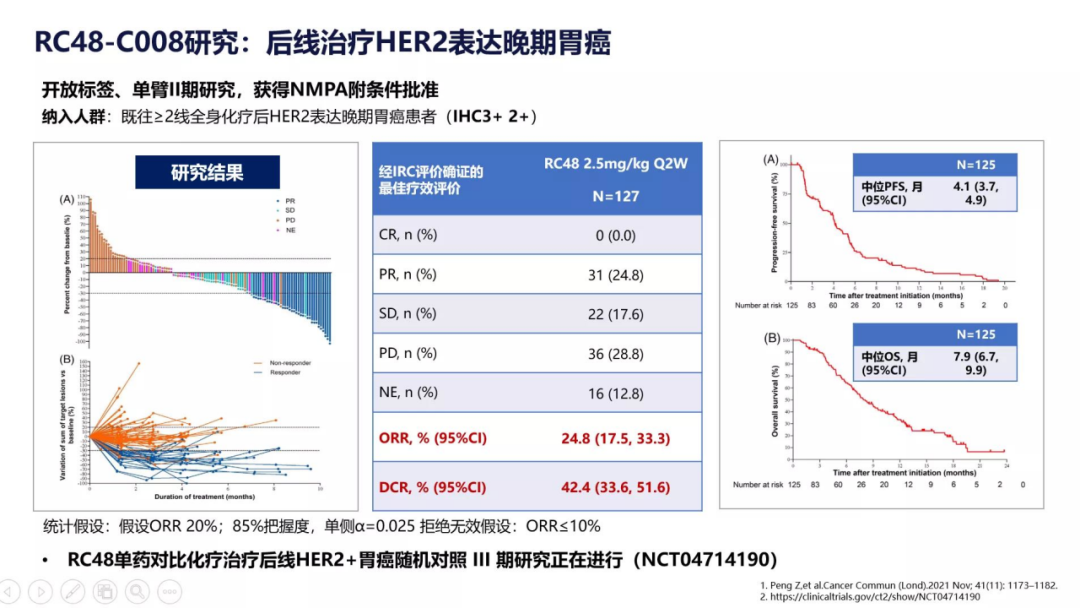
T-Dxd珠玉在前,荣昌生物的RC48也于2021年成为首个获NMPA批准用于晚期胃癌的国产HER2 ADC药物。在抗体的选择方面,RC48并未与T-Dxd一样选择曲妥珠单抗,而是采用了一种HER2表位不同且亲和力更高的自研抗体迪西妥单抗;而在连接子的选择上,其采用的连接子是与T-Dxd相同的可裂解型连接子,因而可以发挥出“旁观者效应”。而其获批是依据一项开放标签、单臂II期研究的积极结果。
值得注意的是,以上两种新型ADC对于HER2低表达胃癌均表现出一定的肿瘤活性,这或许会改变胃癌HER2靶点“阴阳分明”的治疗格局。

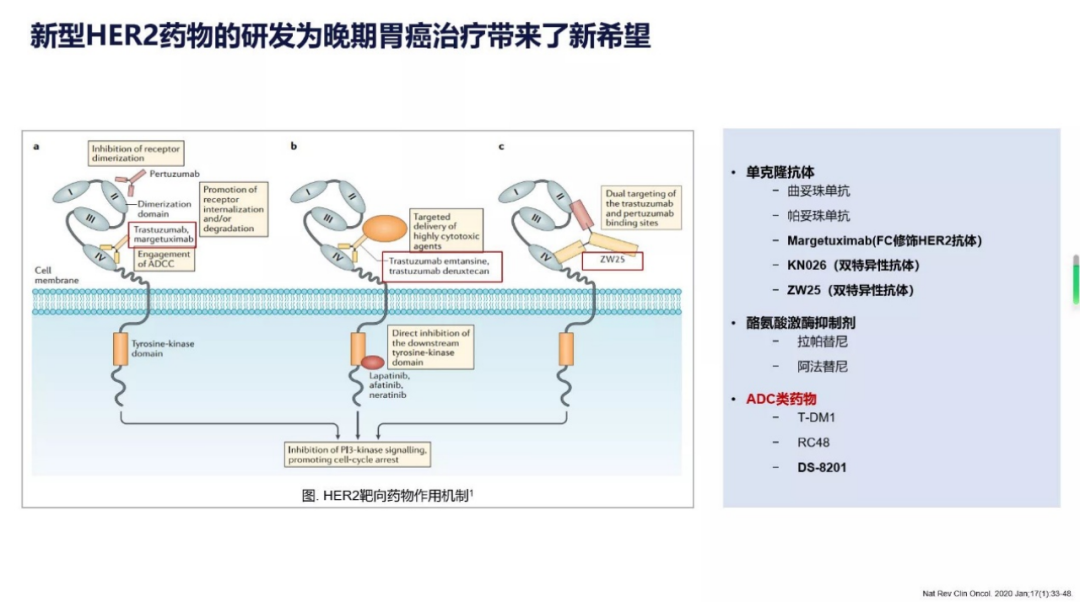
除此之外,围绕HER2靶点的药物临床研究也正在如火如荼地展开,药物类型包括单抗、小分子抑制剂以及双特异性抗体。
不仅如此,另一潜在治疗方向是抗HER2药物与免疫治疗联用。KEYNOTE-811试验也证实了这一观点,研究表明,相对于曲妥珠单抗+化疗的方案,曲妥珠单抗+化疗+帕博丽珠单抗(抗PD-1单抗)可以提高胃癌患者的ORR(51.9% vs 74.4%),这说明在HER2靶向药和ICIs可能有肿瘤治疗协同作用。
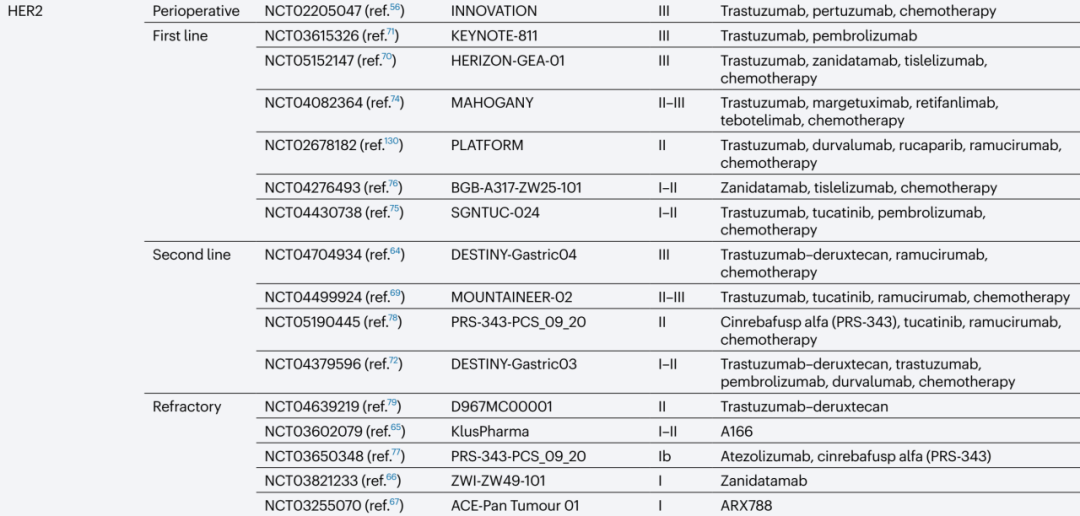
图注:抗HER2治疗胃癌临床在研情况
11.2 免疫治疗
免疫治疗是近些年来癌症治疗领域的重点,胃癌领域也不例外。在一项针对晚期胃癌的III期试验中,来自亚洲的493名患者被分为纳武利尤单抗(抗PD-1)组和安慰剂组,结果显示纳武利尤单抗显著延长了患者的中位生存期(5.26m vs 4.14m),这表明晚期胃癌可从纳武利尤单抗中获益。而后以CPS(PD-L1阳性表达细胞数评分)系统为基础,科学家们又论证了纳武利尤单抗胃癌治疗优越性与CPS评分的关系。CHECKMATE649显示:CPS>=5的人群,ORR更高,OS获益更优。
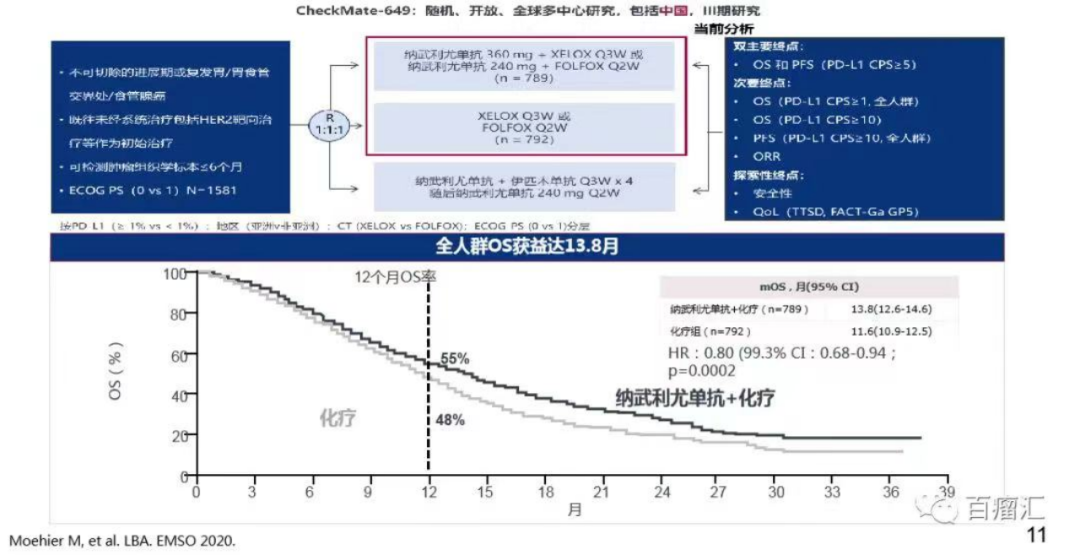
CHECKMATE-649开启了晚期胃癌一线免疫治疗时代。在该试验中,纳武利尤单抗联合化疗的方案明显优于单一化疗方案: mOS(13.1m vs 11.1m)。
而抗PD-1单抗+化疗的成功却没有在KEYNOTE-062中复刻,该试验选用的免疫治疗药物为帕博丽珠单抗,选择的人群PD-L1 CPS> =1。但在KEYNOTE-590中,帕博丽珠单抗与化疗的联用却使全人群OS提高:mOS(12.4m vs 9.8m)。这其中的差异可能与化疗药物的不同选择有关。
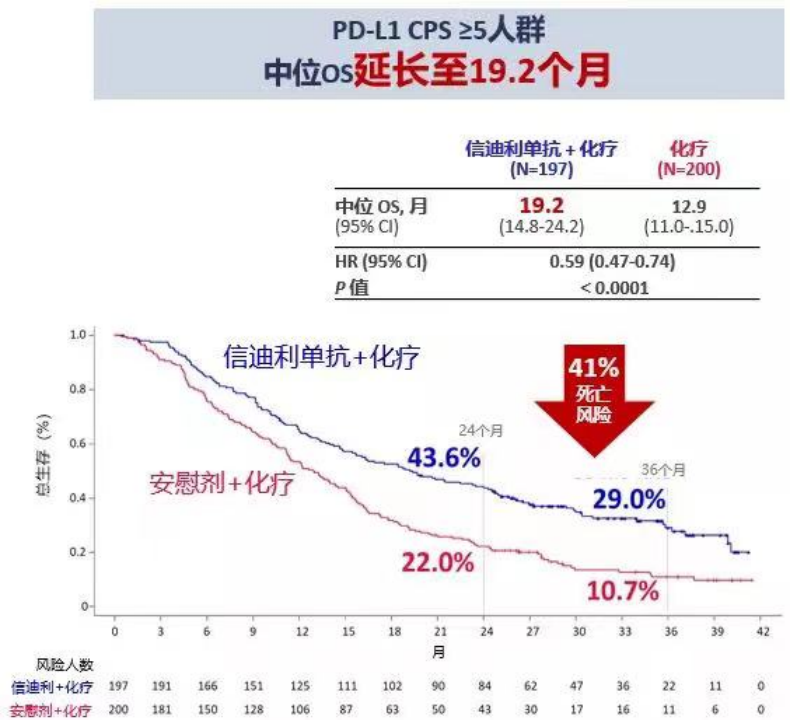
在刚刚落幕的2023AACR中,信达生物信迪利单抗(抗PD-1抗体)联合化疗一线治疗胃或胃食管交界处腺癌的多中心随机对照III期临床研究9(ORIENT-16)公布了最终OS的分析结果:mOS达到19.2个月,(CPS>=5人群, HR =0.59),3年生存率高达近30%,相较于传统化疗方案,使患者的生存期延长超过7个月。这一结果代表了胃癌治疗的又一重大突破。
基于前文提到的两个关于联合用药的关键试验,PD-1抑制剂联合含铂化疗(FOLFOX/XELOX),已成为国内外临床指南推荐的HER2阴性晚期胃癌的一线治疗方案。尽管ICIs治疗的最佳线数尚不确定,但考虑到相关的积极结果和胃癌患者的脆弱状态,ICIs一线治疗可能会使患者最大获益。除此之外,MSI-H以及EBV阳性患者可能会从ICIs单药治疗中获益。不仅如此,免疫治疗作为新辅助疗法/辅助疗法的有效性和可及性也正在不断探索当中。
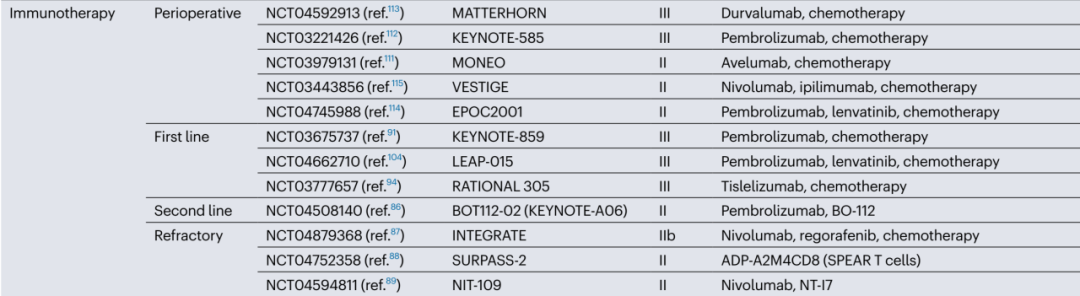
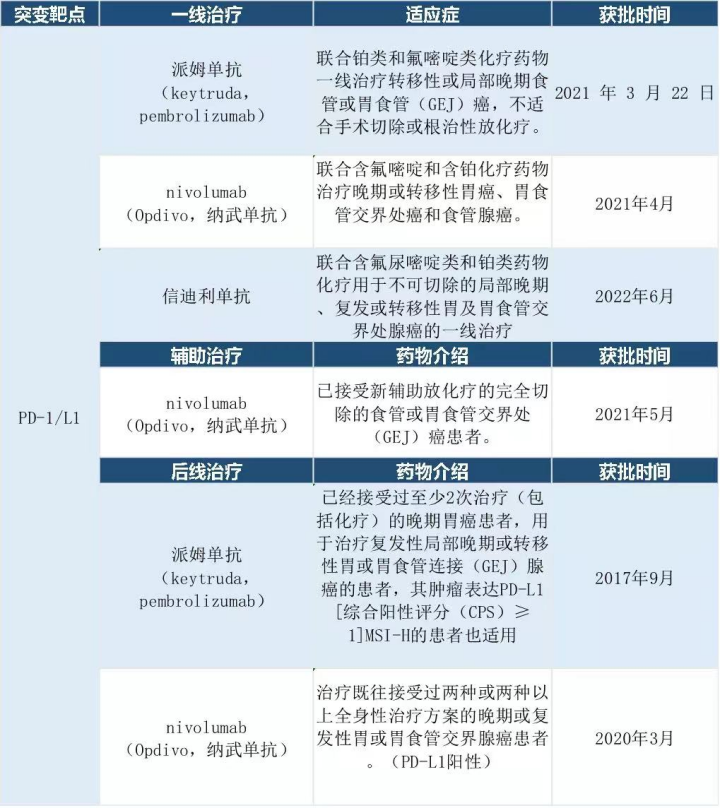
图注:PD-1/PD-L1胃癌适应症获批情况
11.3 抗血管生成治疗
胃癌细胞往往会表达高水平VEGF以及分泌促血管生成细胞因子。尽管雷莫芦单抗和甲磺酸阿帕替尼已分别被批准用于晚期胃癌二、三线治疗,且雷莫芦替尼与紫杉醇联合治疗已成为晚期胃癌的二线标准疗法之一,但在胃癌领域的抗血管生成治疗探索并不是一帆风顺。无论是雷莫芦单抗还是贝伐单抗在加入一线化疗方案后都没有体现出足够的有效性。不仅如此,受试对象的筛选还缺乏明确的生物标志物,但已有研究表明高血浆VEGF基线水平或者低神经纤维因子1基线水平可能与更优越的贝伐单抗治疗OS有关。
11.4 其他靶点的探索
除了上述治疗方法以外,还有一些尚未在胃癌适应症获批的靶点。它们有的中道崩殂,例如EGFR,MET ,PARP, mTOR等靶点,虽然较早开始在胃癌领域探索,但尚未有一种药物获批二线。但生物医药领域老树开出新花的实例并不鲜见,这些靶点仍然具有巨大潜力。2023年的AACR上,和黄医药披露赛沃替尼(MET小分子抑制剂)二线治疗MET+胃癌的II期早期数据,在研究纳入的20例MET+胃癌患者中,ORR达45%,4个月的持续缓解率未95.7%,中位观察时间为5.5个月,展现出了赛沃替尼治疗MET+胃癌的良好有效性和安全性。
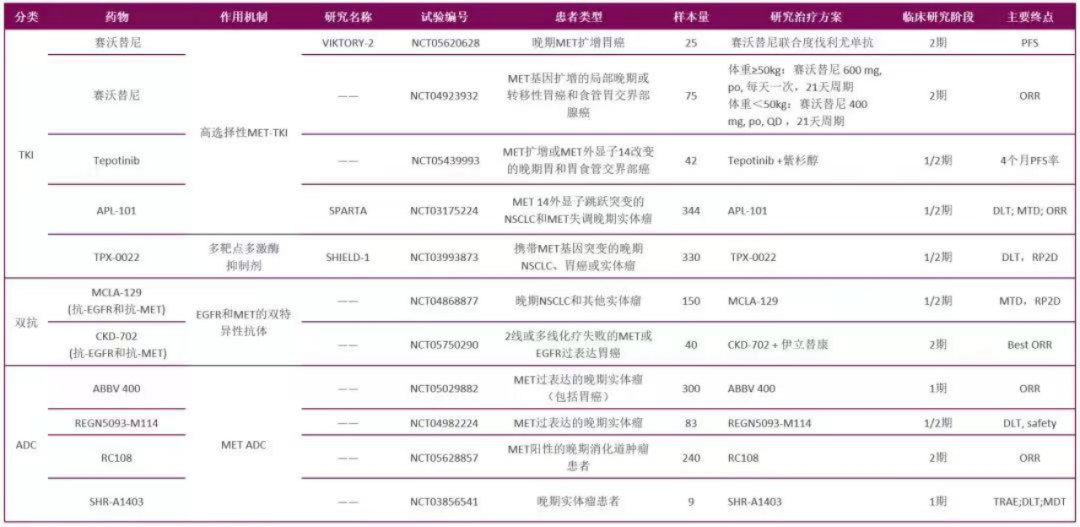
另外一种是近些年兴起的靶点,例如成纤维细胞生长因子2(FGFR2)以及Claudin 18.2。FGFR2靶点的First-in-class药物bemaritumab就在II期试验中显著延长了mOS(25.4m vs 11.1m)。

Claudin18.2作为近年来胃癌治疗的热门靶点,更是制造了无数惊喜。Claudin18.2是一种四次跨膜蛋白,结构复杂,在胃癌中高度特异性的表达,是研究人员开发胃癌疗法的理想靶点。目前Claudin18.2的开发可以说是百花齐放,技术路线遍及CAR-T、单抗、双抗以及ADC。下文为该靶点优秀临床结果的一些实例:
Claudin 18.2 CART CT041是一种针对实体瘤的CAR-T疗法。在2022年的ASCO大会接受过至少两种前线系统治疗的胃癌/食管胃结合部腺癌入组,ORR为60%,其中1例CR,约80%患者病情稳定;而在中国的Ib/II期试验中,14例晚期胃癌/食管胃结合部腺癌患者入组Ib期,ORR也达到了57.1%(8/14),DCR为83.8%,mPFS和mOS分别达到5.6个月和10.8个月。以上结果表明,CT041对晚期胃癌/食管胃结合部腺癌具有显著的疗效以及可控的安全性。
2023年3月23日,安斯泰来公布了佐妥昔单抗(抗Claudin 18.2抗体)在一线治疗局部晚期不可切除或转移性胃癌/食管胃结合部腺癌关键临床临床试验的积极结果。结果表明,与安慰剂组相比,佐妥昔单抗和CAPOX组合疗法可降低患者疾病或死亡风险达31.3%,并且延长PFS(8.21m vs 6.80m)和mOS(14.39m vs 12.16m)。此项结果也将助力安斯泰来向全球监管单位递交上市申请。
一体化精准医疗策略
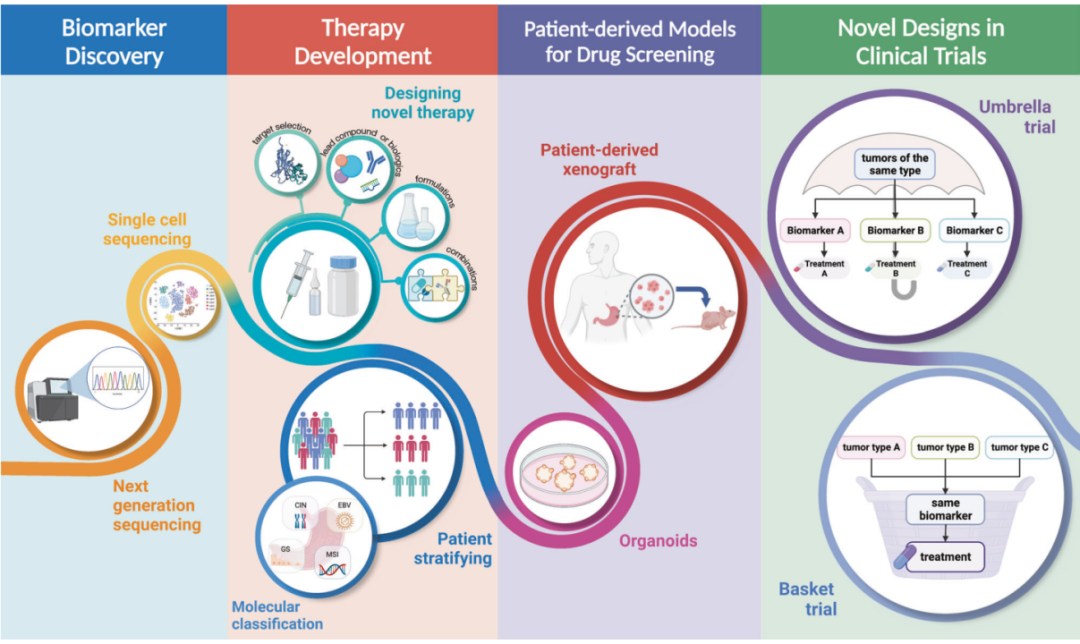 图注:生物标志物指导的精准医疗策略
图注:生物标志物指导的精准医疗策略展望
在掌握胃癌流行病学变化趋势的当下,第一,我们应当进一步辨析各种风险因素与胃癌风险的关联,探索其联系背后的因果关系;其次,建立、优化、验证基于风险因素的临床预测模型;优化筛选预防策略,在全球范围内普及Hp根除和内镜筛查;最后努力向基于胃癌分子特征的精准化治疗策略靠近,真正实现胃癌的个体化治疗。
主要参考文献
1.Alsina M, Arrazubi V, Diez M, Tabernero J. Current developments in gastric cancer: from molecular profiling to treatment strategy. Nat Rev Gastroenterol Hepatol. 2023 Mar;20(3):155-170. doi: 10.1038/s41575-022-00703-w. Epub 2022 Nov 7. PMID: 36344677.
2.赫捷,陈万青,李兆申,等. 中国胃癌筛查与早诊早治指南(2022,北京)[J]. 中华肿瘤杂志,2022,44(7):634-666. DOI:10.3760/cma.j.cn112152-20220617-00430.
3.Alsina M, Arrazubi V, Diez M, Tabernero J. Current developments in gastric cancer: from molecular profiling to treatment strategy. Nat Rev Gastroenterol Hepatol. 2023 Mar;20(3):155-170. doi: 10.1038/s41575-022-00703-w. Epub 2022 Nov 7. PMID: 36344677.
4.Lei ZN, Teng QX, Tian Q, Chen W, Xie Y, Wu K, Zeng Q, Zeng L, Pan Y, Chen ZS, He Y. Signaling pathways and therapeutic interventions in gastric cancer. Signal Transduct Target Ther. 2022 Oct 8;7(1):358. doi: 10.1038/s41392-022-01190-w. PMID: 36209270; PMCID: PMC9547882.
5.Ma M, Sun J, Liu Z, Ouyang S, Zhang Z, Zeng Z, Li J, Kang W. The Immune Microenvironment in Gastric Cancer: Prognostic Prediction. Front Oncol. 2022 Apr 28;12:836389. doi: 10.3389/fonc.2022.836389. PMID: 35574386; PMCID: PMC9096124.
6.Bessède E, Mégraud F. Microbiota and gastric cancer. Semin Cancer Biol. 2022 Nov;86(Pt 3):11-17. doi: 10.1016/j.semcancer.2022.05.001. Epub 2022 May 6. PMID: 35533800.
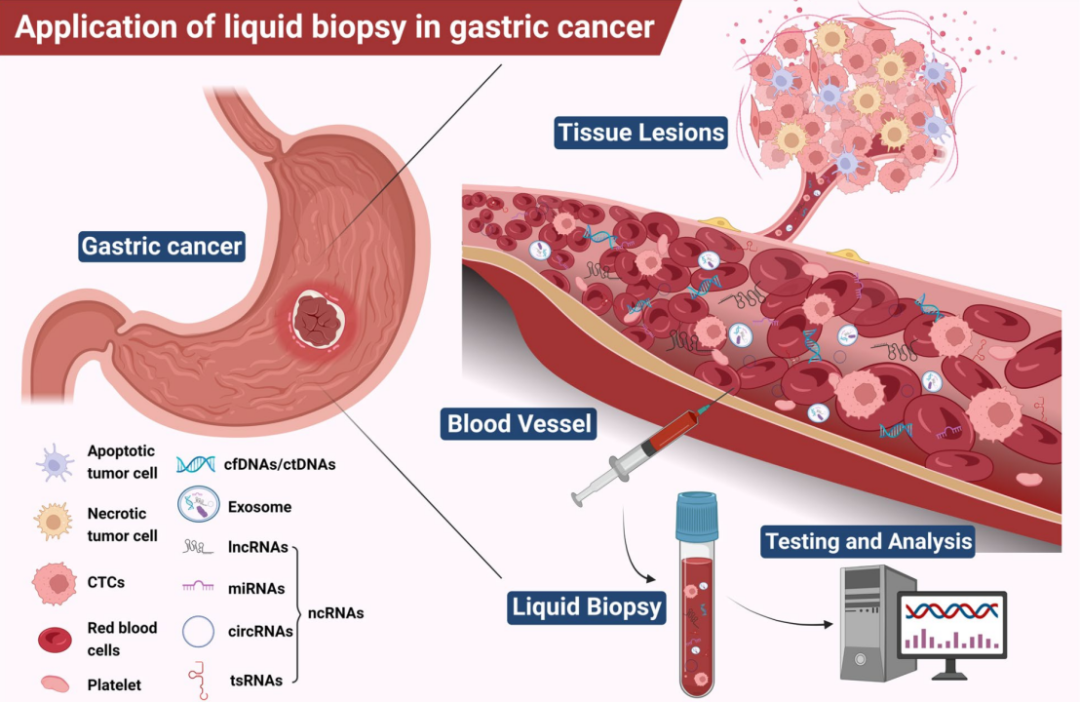
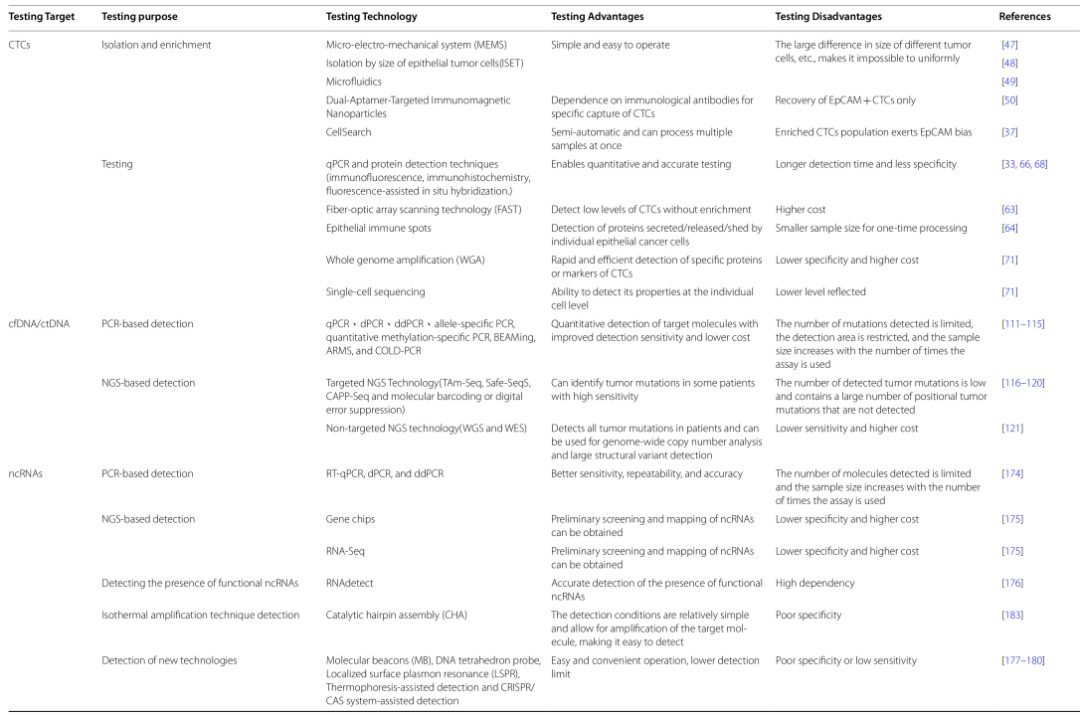
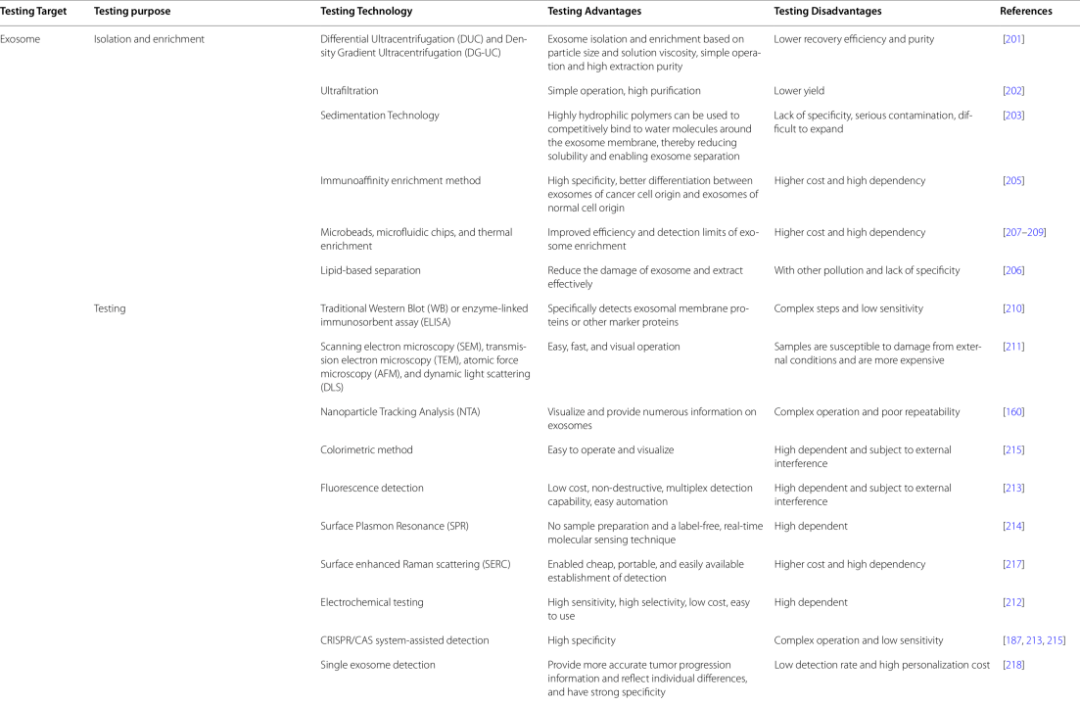
7.Ma S, Zhou M, Xu Y, Gu X, Zou M, Abudushalamu G, Yao Y, Fan X, Wu G. Clinical application and detection techniques of liquid biopsy in gastric cancer. Mol Cancer. 2023 Jan 11;22(1):7. doi: 10.1186/s12943-023-01715-z. PMID: 36627698; PMCID: PMC9832643.
8.丁香园Insight数据库
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)