
癌症免疫疗法的兴起深刻改变了癌症治疗的格局,其中免疫检查点阻断(ICB)疗法的进展更是重塑了肿瘤治疗的前景。以最为经典的抗PD-1/PD-L1治疗为例,该疗法通过靶向阻断肿瘤微环境(TME)中的免疫逃逸机制,有效地恢复肿瘤特异性T细胞免疫,在多种肿瘤类型中显示了持久的临床应答。值得注意的是,在癌症免疫治疗中,肿瘤有“冷”和“热”之分,抗PD-1/PD-L1治疗通常只对具有大量肿瘤特异性CD8+T细胞反应的“热肿瘤”有效。令人遗憾的是,许多肿瘤在免疫上是“冷”的,如急性髓系白血病(AML),这些肿瘤缺乏明显的T细胞浸润,导致患者对治疗无反应或产生获得性耐药。这一现象强调了迫切需要找到“冷肿瘤”实现免疫逃逸的耐药性机制,开发出对“冷肿瘤”有效的治疗策略,以提高癌症免疫治疗的效果。2023年8月8日,纽约大学格罗斯曼医学院王俊教授、Iannis Aifantis 教授(陈旭峰博士、鲁峤博士为共同第一作者)在国际顶尖学术期刊 Cell 上发表了题为:A membrane-associated MHC-I inhibitory axis
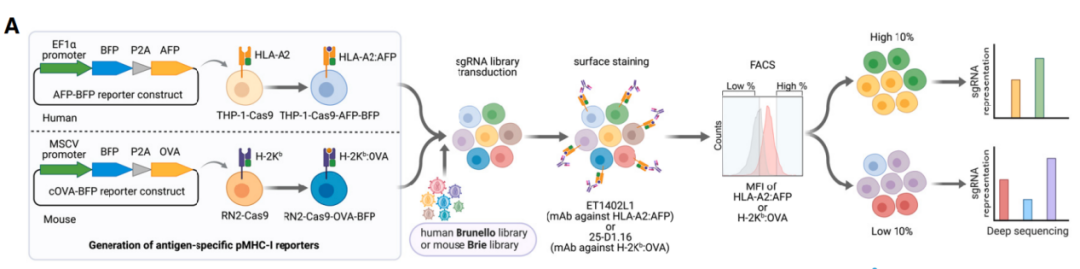
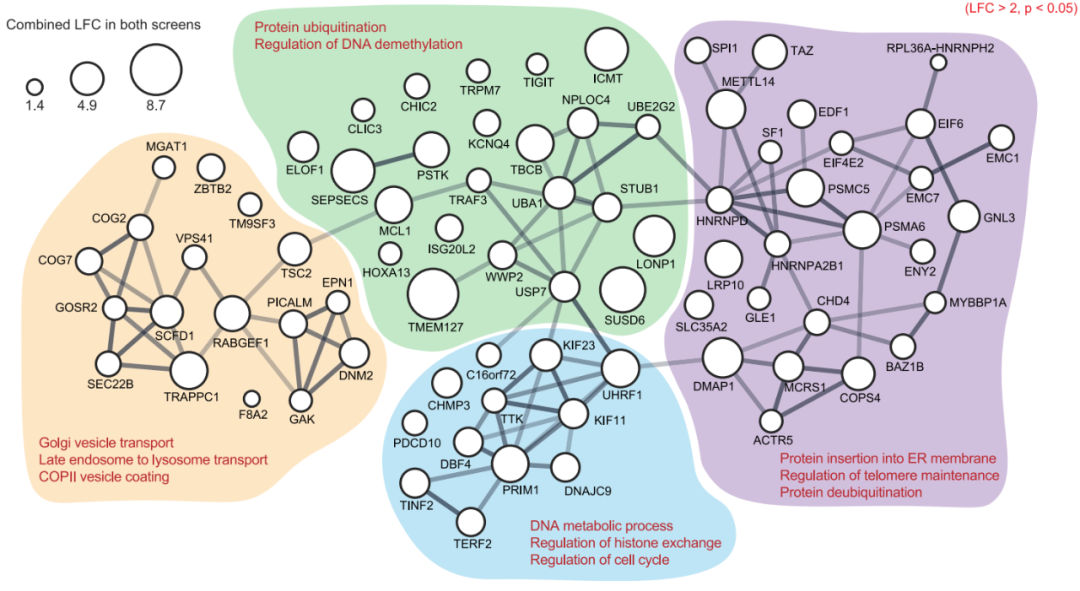
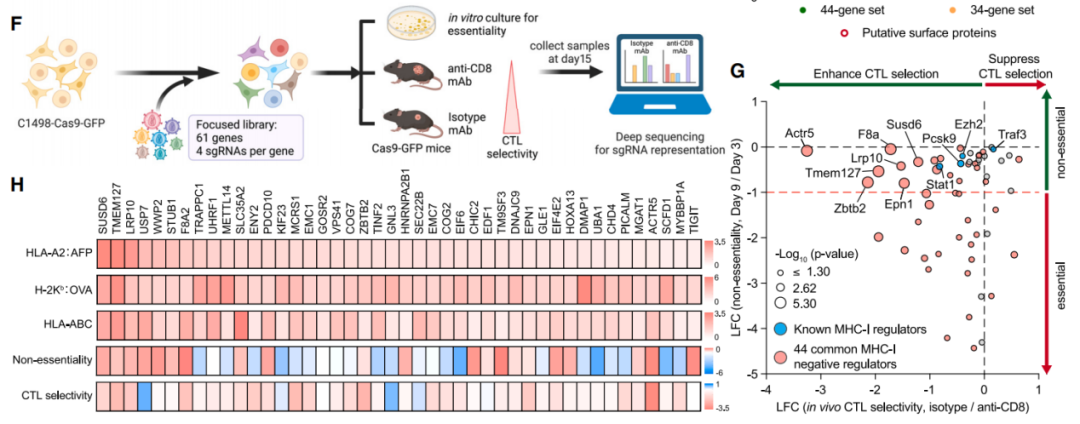
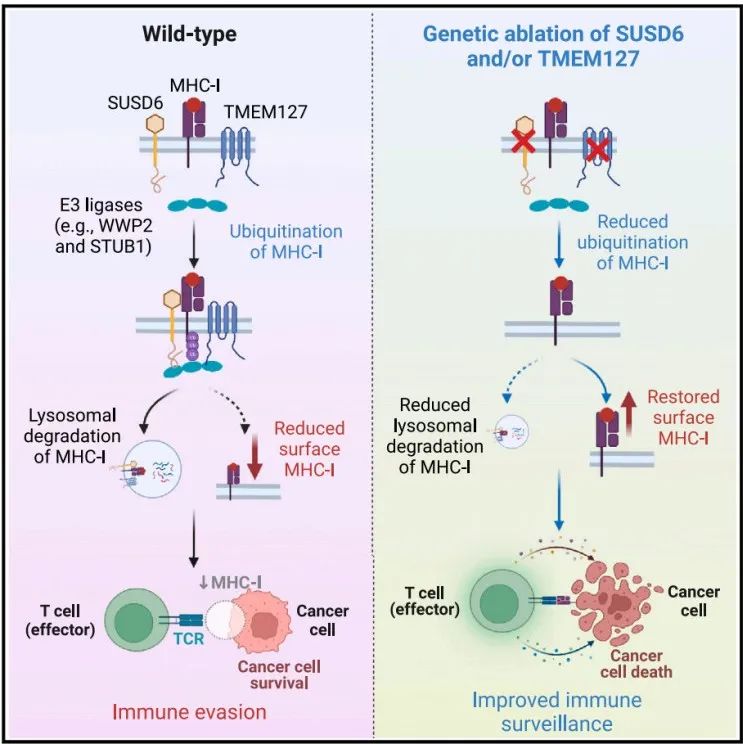
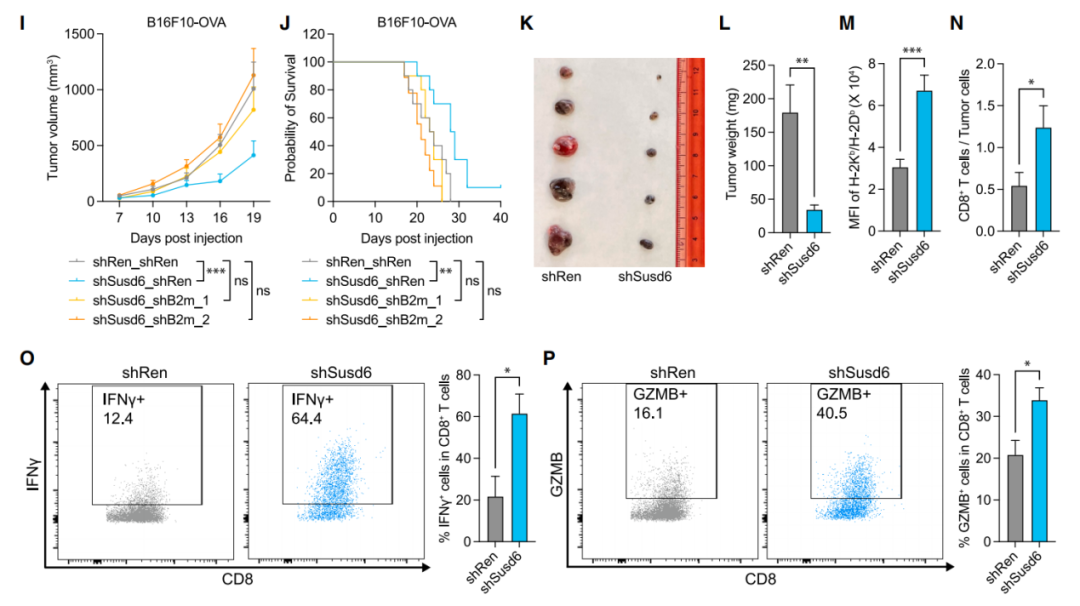
for cancer immune evasion 的研究论文。该研究在急性髓系白血病(AML)中使用特定的肽-MHC-I引导的CRISPR-Cas9全基因组筛选,确定了关键的MHC-I调节因子,其中排名最高的与癌症生存相关的负调控因子是SUSD6、TMEM127和WWP2,称为STW轴。在机制上,SUSD6、TMEM127和MHC-I形成三元复合物,招募WWP2进行MHC-I泛素化和溶酶体降解。因此,当敲除SUSD6/TMEM127/WWP2时,增强了MHC-I抗原呈递(MHC-I AP),并以CD8+ T细胞依赖的方式抑制肿瘤生长。这些研究结果定义了一个膜相关的MHC-I抑制轴作为白血病和实体肿瘤等“冷肿瘤”的潜在治疗靶点。主要组织相容性复合体I类(MHC-I)抗原呈递通路决定了CD8+ T细胞的特异性,并对它们的激活和增殖至关重要。抗原呈递细胞(APC)可以处理肿瘤抗原并将其呈递到细胞膜表面,形成肽-MHC-I复合物,抗原特异性T细胞受体(TCRs)识别之并触发CD8+ T细胞反应。这一过程十分复杂,涉及大量细胞分子,因此许多基因突变或缺失都会阻断MHC-I抗原呈递,导致肿瘤进展以及抵抗免疫检查点阻断(ICB)疗法的发展。因此,如果能识别与MHC-I抗原呈递相关的癌症特异性通路,特别是那些直接与膜MHC-I相互作用的细胞因子,可以作为免疫治疗的潜在新靶点。在这项最新研究中,为了系统地识别与癌症相关的MHC-I抑制因子,研究团队在人类和小鼠急性髓系白血病(AML)中进行了细胞表面肽-MHC-I引导的CRISPR-Cas9全基因组筛选。以AML作为筛选对象具有两项优点:1)其免疫原性差,突变负担低;2)它代表了髓系祖细胞的恶性对应物,可以分化为专业的抗原呈递细胞,其机制可能可以扩展到其他癌症类型。肽-MHC-I引导的全基因组CRISPR筛选的流程图通过CRISPR-Cas9敲除全基因组筛选,研究团队构建了MHC-I调节的正调控网络和负调控网络。与预期一致,由于MHC-I是一种膜定位复合物,因此筛选到的排名靠前的因子大多具有膜相关的定位,如内质网、高尔基体和核内体。全基因组CRISPR筛选构建MHC-I调节的正调控网络和负调控网络值得注意的是,在筛选到的负调控因子中,研究人员发现了一个膜相关MHC-I抑制轴,其中包括SUSHI结构域6(SUSD6)、跨膜蛋白127(TMEM127),它们共同招募E3泛素连接酶WWP2,形成SUSD6/TMEM127/WWP2轴(STW)。TMEM127,是一种四次跨膜蛋白,与罕见的神经内分泌肿瘤易感相关,也被认为是一种Nedd4家族E3连接酶适配器,可以在沙门氏菌效应蛋白SteD存在下降解MHC II。而SUSD6,则是一种单通道跨膜蛋白,目前没有已知的免疫功能。研究团队探究了STW信号轴在急性髓系白血病(AML)和实体肿瘤中的抗肿瘤功效。在分子机制上,SUSD6与TMEM127形成复合物,通过相互作用招募E3泛素连接酶WWP2,靶向MHC-I并将其泛素化,从而通过溶酶体降解途径将其清除。因此,在AML和实体肿瘤中,SUSD6的敲除缺失可增强MHC-I的表达,并促进T细胞介导的免疫监测。实际上,STW信号轴在不同肿瘤类型中的高度相关表达。研究团队使用TCGA数据库探讨了STW轴的临床相关性,并发现STW轴在急性髓系白血病和胰腺癌中显著上调,并与患者的总生存期呈负相关。研究团队还通过体外和体内研究共同证实,靶向抑制STW轴可以恢复肿瘤MHC-I的表达,延缓肿瘤生长,延长荷瘤动物生存时间。SUSD6抑制实体肿瘤模型中MHC-I的表达和T细胞逃逸这些研究结果表明,STW轴是一种癌症相关的免疫逃避机制,同时也可能是一种“冷肿瘤”的潜在治疗靶点,从而为癌症免疫治疗开辟新的道路。论文第一作者陈旭峰博士,于2009年本科毕业于华中科技大学,2015年博士毕业于中国科学院上海生化所,师从刘小龙研究员。此后在上海生化所从事博士后研究、任副研究员,主要从事造血系统谱系发育的相关研究。2017年,陈旭峰博士前往纽约大学格罗斯曼医学院 Iannis Aifantis 教授实验室从事博士后研究,现为纽约大学格罗斯曼医学院病理系讲师,致力于通过系统筛选揭示白血病耐药机制及寻找靶向/免疫治疗新靶点。陈旭峰博士已以第一作者身份于 Cell、Cancer Discovery、Cell Research、Nature Communications 等期刊发表多篇高质量论文并获得白血病研究协会(LRF)和美国血液学会(ASH)的经费支持。陈旭峰博士目前计划寻找良好的科研平台进一步发展,邮箱:Xufeng.Chen@nyulangone.org

论文共同第一作者鲁峤博士,博士毕业于耶鲁大学(师从抗原呈递界泰斗Peter Cresswell)现于纽约大学王俊教授课题组从事博士后研究,致力于抗原呈递和免疫治疗等方向的研究。作为第一/共同第一作者在 Cell、Immunity、Nature Communications 等期刊发表多篇论文。鲁峤博士的此项研究得到了美国癌症研究机构(Cancer Research Institute)的博士后基金支持。

论文通讯作者王俊博士为纽约大学医学院病理系助理教授,多年来致力于发现和理解新的细胞表面免疫调节分子的功能以及其在肿瘤以及自身免疫疾病中应用。除了在抗4-1BB免疫疗法肝毒性以及乙肝肝炎机制方面的早期探索外,他还建立了全基因组受体和功能筛选技术,发现并参与开发包括Siglec-15、FGL1/LAG-3等之内的多个创新靶点。王博士在免疫治疗方面的经验还近期应用于理解COVID-19免疫病理学,以及开发针对病毒免疫相互作用的新型COVID-19免疫疗法。近年来,王博士作为通讯作者或第一作者在 Cell、Nature Medicine、Immunity、JEM、Clinical Cancer Research、Cell
Research 等期刊发表十多篇高水平论文。王博士实验室也得到NIH RO1/R37/R21, 以及多个国际著名肿瘤基金 (V Foundation, Mark Foundation, Melanoma Research Alliance等)的丰厚研究支持。同时他也是多家生物科技公司(包括BMS、Rootpath Genomics)的顾问,以及BioSpark Group的联合创始人。
王俊博士实验室致力于在人类疾病环境中发现关键的免疫反馈调节机制,深入了解其分子和疾病生物学,并设计基于这些新机制的前沿免疫疗法来治疗人类癌症和自身免疫疾病。实验室诚招对基础免疫学以及免疫治疗有着浓重兴趣以及具有探索精神的博士、博士后,以及访问学者加盟。Together, let’s make a difference and answer critical questions in
immunotherapy!

论文共同通讯作者 Iannis Aifantis 博士于哈佛医学院完成博士后工作后,先后于芝加哥大学和纽约大学任助理教授, 曾任霍华德·休斯医学研究所(HHMI)青年科学家。现任教于纽约大学格罗斯曼医学院,为病理系系主任。其实验室致力于探索造血干细胞及前体细胞生理分化及病理病变过程的分子机制,主要研究:a)基因表达的转录/表观遗传调控对癌变的影响,b)白血病中的非编码RNA,c)RNA结合蛋白在白血病中的作用,d)白血病中三维染色体结构的调控,以及 e)白血病与其肿瘤微环境之间的相互作用。实验室目前正在招聘博士后,详见:https://aifantislab.com/
cell.com/cell/fulltext/S0092-8674(23)00783-3
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。











发表评论
注册或登后即可发表评论
登录注册
全部评论(0)