2024-04-16 来源 : 医界望远镜
截止2024年3月12日,在中国获批上市的PD-1抑制剂已达10款之多。
众多PD-1抑制剂为广大肿瘤患者提供了丰富的免疫治疗选择。同时,也有很多PD-1抑制剂在同类型的癌种里进行了各自的探索,对这些患者来说,不同PD-1抑制剂之间的比较是非常重要的。但遗憾的是,目前仍未有PD-1抑制剂之间头对头比较的大型临床研究结果公布。
2020年,广东省人民医院吴一龙教授团队启动II期临床试验CTONG1901研究,这是全球首个「PD-1 vs PD-1」的头对头研究,旨在比较信迪利单抗和帕博利珠单抗一线治疗NSCLC的疗效与安全性。
2022 ASCO及2022WCLC上,研究团队分别公布了中位随访5.6个月及11.5个月时的中期分析数据。近日,CTONG1901研究中位随访时间16.5个月的完整数据正式公布,并在《Science Bulletin》(科学通报)上发表。
研究设计
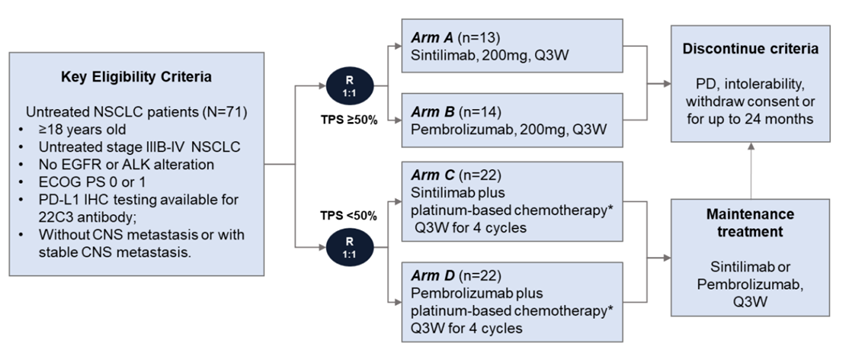
CTONG1901是一项前瞻性、开放标签、II期随机对照临床试验(NCT04252365)[1]。
根据PD-L1 表达评分进行分组,PD-L1高表达(TPS≥50%)的患者,采用单药治疗方案,分别给予信迪利单抗(A组)或帕博利珠单抗(B组);PD-L1低表达或阴性(TPS<50%)的患者采用联合治疗方案,分别给予信迪利单抗+化疗(C组)或帕博利珠单抗+化疗(D组)。
为了能用最小的样本量得出有效结果,研究采用了优化的两阶段设计。在第一阶段,先招募20名患者进行初步评估。若信迪利单抗组的客观缓解率(ORR)达到预设标准(40%),则继续进入第二阶段并进一步扩大样本量。
第一阶段A 组和 C 组的前 10 名患者中有 4 名确认 PR。信迪利单抗组的 ORR 为 57.1%,帕博利珠单抗为 33.3%,该研究进入第二阶段。根据第一阶段生成的实际ORR数据以及设定的显著性水平α=0.05和把握度1-β=0.80,计算得出整个研究所需的样本量为68名患者,即两组额外再纳入24名患者。
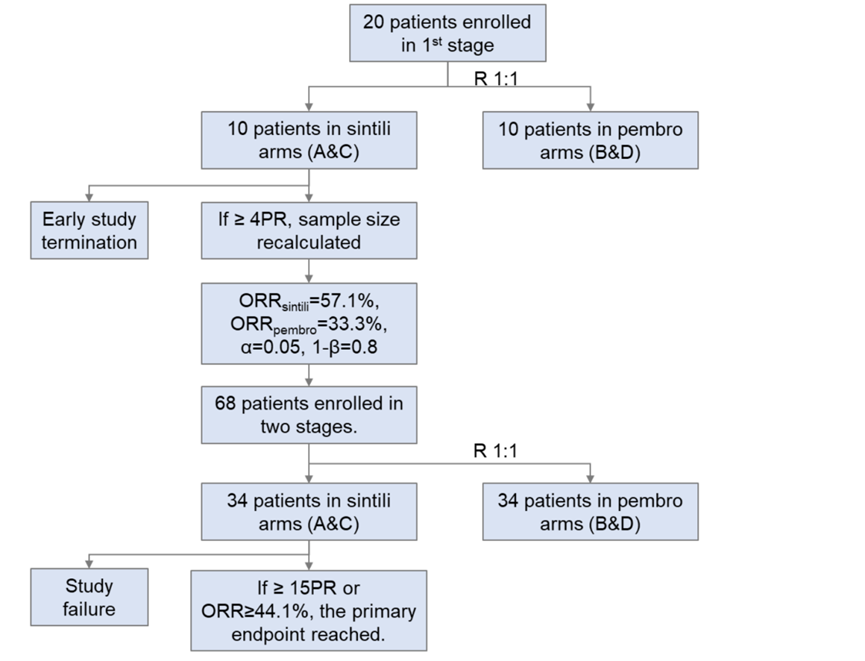
主要终点为客观缓解率。在信迪利单抗治疗的所有患者中,若达到至少15例患者确认的完全缓解(CR)或部分缓解(PR),或者信迪利单抗组(单药和联合治疗组合并,即A组+C组)的确认ORR达到44.1%以上,则视为达到主要终点。
次要终点包括疾病控制率(DCR)、无进展生存期(PFS)、总生存期(OS)以及药物的安全性和耐受性。
研究结果
如何理解近50%的mOS差?
两个阶段共 80 名患者接受了资格评估,其中 71 名患者符合标准。截至 2022 年 10 月 31 日,中位随访时间为 16.5 个月,研究达到了主要终点。
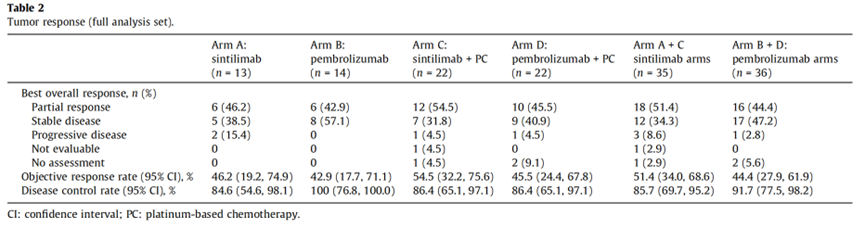
ORR和DCR
ORR方面,单药对比A 组vs B组 = 46.2% vs 42.9%;联合治疗对比C组 vs D组 = 54.5% vs 45.5%;总体对比A+C组 vs B+D组 = 51.4% vs 44.4%。
DCR方面,A 组vs B组 = 84.6% vs 100%;C组vs D组 = 86.4% vs 86.4%;A+C组 vs B+D组 = 85.7% vs 91.7%。
无论是作为单一疗法还是作为基线特征定义的亚组中的联合疗法,信迪利单抗组或帕博利珠单抗组之间的 ORR 相似。
具体如下图所示:
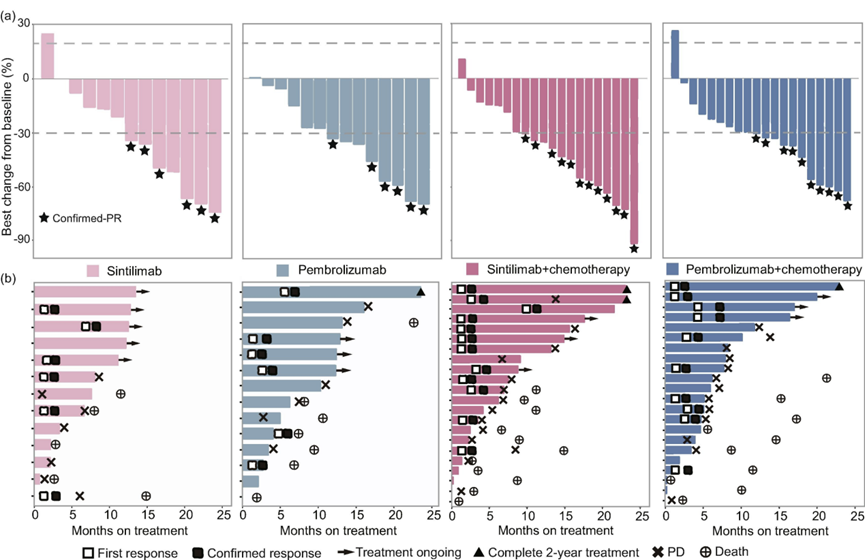
缓解持续时间(DOR)结果
A组 vs B组 = 7.3个月 vs 未达到;
C组vs D组 = 12.5个月 vs 11.0个月;
A+C组 vs B+D组 = 11.2个月 vs 未达到
所有治疗组中达到 PR 的中位时间相似,从 1.3 个月到 2.1 个月不等。具体如下图所示:
mPFS和mOS结果
尽管信迪利单抗和帕博利珠单抗治疗组的mPFS和mOS数据没有统计学差异,但从绝对数值上看,结果的差异很大,这也是我们要重点解读的部分。
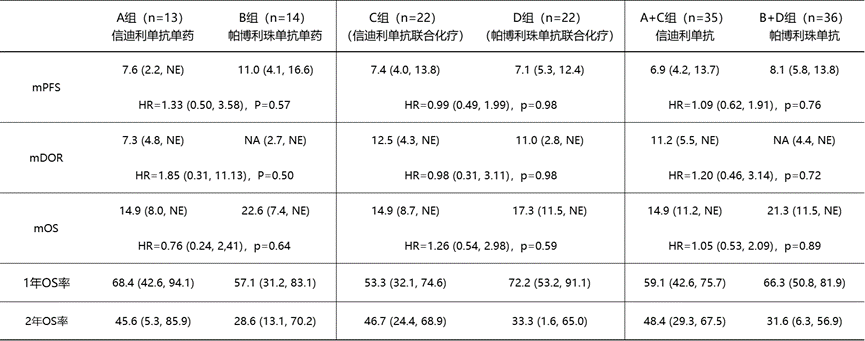
从绝对数值上分析,帕博利珠单抗组的mOS数据几乎比信迪利单抗延长了50%。要理解其中的原因,需要明白mOS的计算方法。mOS不是OS的平均值,而是研究期间一半患者存活的时间点。
因此,mOS的数据不会受到超额获益的患者影响,但会受到超进展死亡患者的影响。
从下图可以看出,由于A组和C组半数患者存活的时间点差异较大,所以A组vs B组(下图左)和A+C组vs B+D组(下图右)的OS差异较大,从实际生存曲线上来看,各两组之间是交叉的。而联合治疗组的半数患者存活时间相对接近(下图中),所以数值差异较小。
总的来说,信迪利单抗组运气不太好。当然,而更底层的原因是样本量过小。
另外,从生存曲线上看,信迪利单抗治疗组的患者早期进展较快,但长期生存获益是要略优的,这与1年OS率和2年OS率展现出来的结果类似。
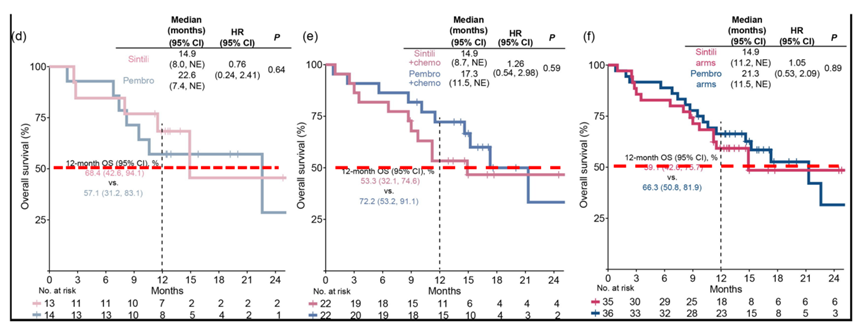
那么通过HR是否能评估信迪利单抗和帕博利珠单抗的获益呢?很遗憾,依然不能。因为置信区间跨度太大,mOS数据里最大的可以从0.54~2.98,由于P值远大于0.05,HR可信度低。

安全性
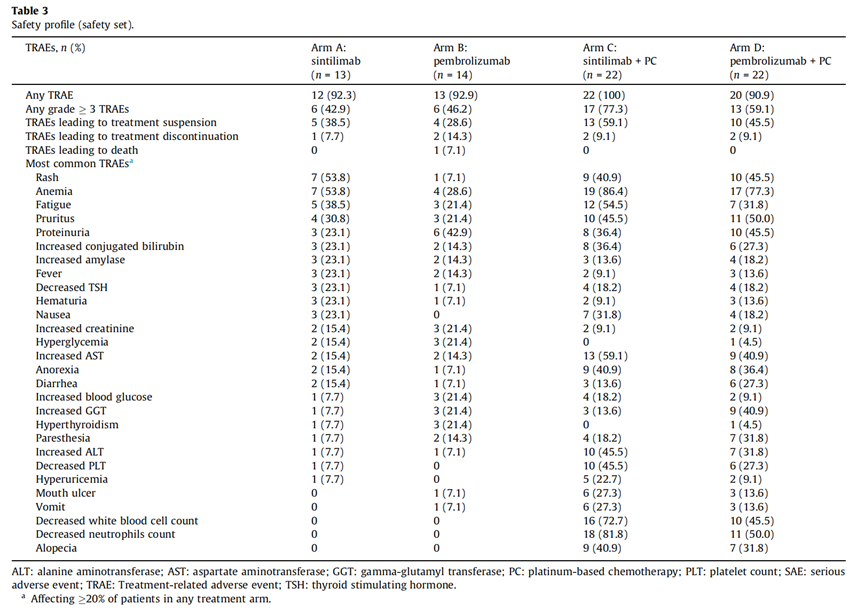
研究安全性结果显示,无论是信迪利单抗还是帕博利珠单抗,不论是作为单药治疗还是联合含铂类化疗,大部分患者(超过90%)都报告了治疗相关不良事件(TRAEs),其中近半数患者经历了3级或以上的TRAEs。
在接受组合疗法的患者中,TRAEs导致治疗暂停的情况更为常见,尤其是在信迪利单抗联合化疗组中,接近60%的患者曾因TRAEs暂停过治疗;不过治疗中止的比例在各组中相对较低,均不超过10%。1例患者因严重的治疗相关不良事件(间质性肺炎合并肺部感染且激素治疗无效)死亡。
总的来说,信迪利单抗和帕博利珠单抗在晚期非小细胞肺癌患者中的安全性表现相似,大多数不良事件均可控,且与既往研究中的安全性数据相符。
信迪利单抗单药治疗组中某些特定不良事件如皮疹的发生率略高于帕博利珠单抗单药治疗组。尽管如此,两种药物均显示出较好的耐受性。
总结
CTONG1901作为一项开放标签的II期研究,研究结果在普适性上有较大的局限性,部分结果也受到了一定的随机影响。但作为全球首个「PD-1 vs PD-1」的头对头研究,其意义依然重大,验证了信迪利单抗与帕博利珠单抗两款PD-1抑制剂之间并无显著性差异。
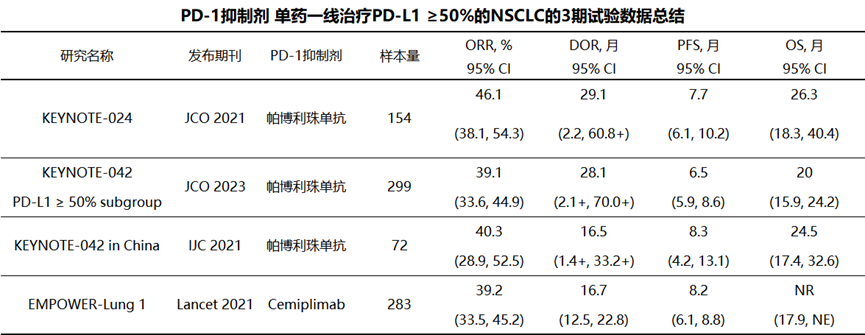
另外,研究还总结了以往III期研究中PD-1抑制剂一线治疗NSCLC的数据(下图),以供参考。

参考资料
[1] Maggie Liu SY, Huang J, Deng JY,et al. PD-L1 expression guidance on sintilimab versus pembrolizumab with or without platinum-doublet chemotherapy in untreated patients with advanced non-small cell lung cancer (CTONG1901): A phase 2, randomized, controlled trial. Sci Bull (Beijing). 2024 Feb 26;69(4):535-543. doi: 10.1016/j.scib.2023.12.046. Epub 2023 Dec 26. PMID: 38185589.
版权/免责声明:
本文内容仅用于医疗行业信息传播、知识分享,我们会对发表的内容进行溯源、求证,力求专业、可靠,但不对内容的准确性做出承诺;不提供任何医疗、商业、投资建议,欢迎个人转发至朋友圈分享。如需转载,请务必注明文章作者和来源,否则我们将保留追究法律责任的权利。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)