2024-07-24

虽然癌基因可以被小分子抑制,但肿瘤抑制蛋白的丢失更为常见,并且存在问题,因为肿瘤抑制蛋白不再存在靶向。值得注意的例子包括SMARCB1 突变癌症,这是由SWI/SNF(也称为 BAF)染色质重塑复合物亚基失活驱动的高度致命的恶性肿瘤。
2024年3月27日,圣裘德儿童研究医院Charles W. M. Roberts及哈佛医学院Eric S. Fischer共同通讯在Nature期刊发表题为“Targeting DCAF5 suppresses SMARCB1-mutant cancer by stabilizing SWI/SNF”的研究论文,该研究表明靶向DCAF5通过稳定SWI/SNF抑制SMARCB1突变癌症。
为了深入了解SMARCB1突变的后果并识别漏洞,研究人员将14个SMARCB1突变细胞系用于近全基因组CRISPR筛选,作为癌症依赖图谱项目的一部分。该研究报道了很少被研究的基因 DDB1-CUL4相关因子5 (DCAF5)是SMARCB1突变癌症存活所必需的。
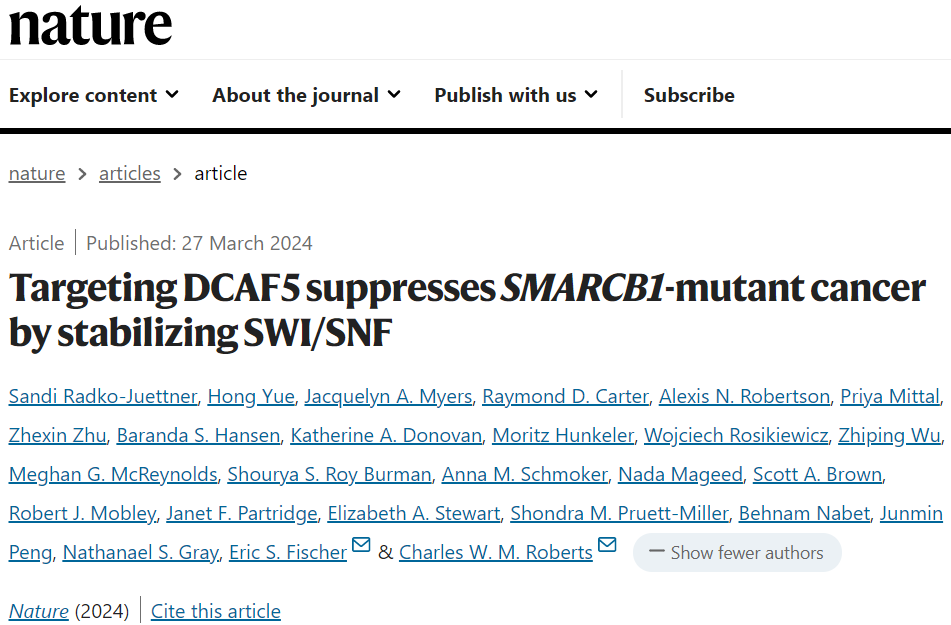
该研究发现DCAF5对SWI/SNF复合物具有质量控制功能,并在没有SMARCB1的情况下促进不完全组装的SWI/SNF复合物的降解。在DCAF5耗尽后,SMARCB1缺陷的SWI/SNF复合物重新积累,结合靶位点,并将SWI/SNF介导的基因表达恢复到足以逆转癌症状态的水平,包括在体内。
因此,癌症的发生不是由于SMARCB1功能本身的丧失,而是由于DCAF5介导的SWI/SNF复合物的降解。这些数据表明,针对泛素介导的质量控制因子的治疗可能有效地逆转一些由肿瘤抑制复合物破坏驱动的恶性状态。
SWI/SNF染色质重塑复合物水解ATP,动员核小体在增强子和启动子处调节DNA可及性和基因表达。核心亚基SMARCB1在分裂过程中对增强子功能和细胞记忆的控制至关重要,最近的结构研究表明,它作为一个锚点结合到核小体酸性补丁上,在那里它为SWI/SNF重塑活性提供了有利条件。编码SWI/SNF亚基的基因在近25%的癌症患者中发生突变。SWI/SNF亚基SMARCB1失活发生在几种侵袭性癌症类型中,包括横纹肌样肿瘤(RTs)和肉瘤。
SMARCB1是一种真正的肿瘤抑制因子,因为种系突变易导致癌症,在小鼠中缺失SMARCB1会导致所有小鼠的快速发病癌症。RTs具有简单的二倍体基因组,SMARCB1的缺失通常是唯一确定的驱动突变。由于SMARCB1肿瘤抑制蛋白缺失,唯一的驱动突变不能直接靶向治疗。因此,识别SMARCB1突变细胞特有的遗传脆弱性有可能深入了解SMARCB1缺失促进癌症的机制,并为治疗方法提供信息。
癌症依赖图谱项目(DepMap)是一个大规模的合作项目,利用数百种癌细胞系系统地识别遗传依赖性、小分子敏感性和识别预测它们的生物标志物。为了寻找SMARCB1突变癌症的遗传脆弱性,研究人员向DepMap提供了14个SMARCB1突变的RT系,用于近全基因组CRISPR-Cas9功能缺失筛查。
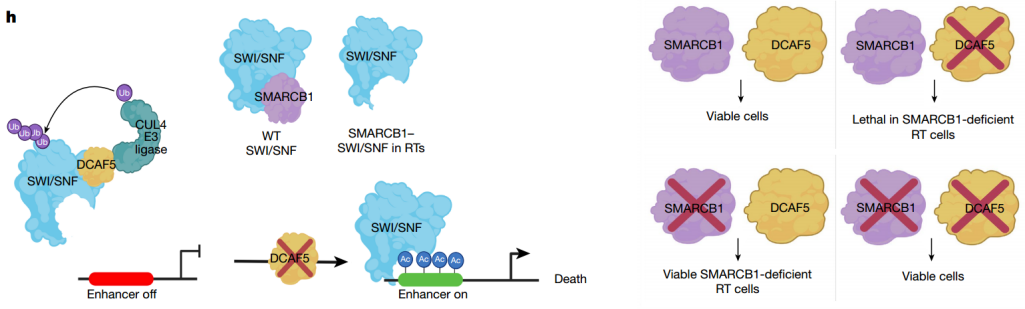
RTs中DCAF5丢失的机制模型
该研究确定了一种作用不同的合成致死关系。而不是产生毒性,靶向灭活质量控制因子实质上恢复多亚基蛋白复合物的功能,否则在失去肿瘤抑制亚基后降解。之前已经证明,SMARCB1缺失通过损害高增殖祖细胞中增强子的激活来驱动癌症,从而阻断分化并使其持续增殖。从机制上讲,DCAF5的失活可恢复大量SWI/SNF功能,恢复分化并逆转癌症表型。
研究发现,在SMARCB1缺失的情况下,DCAF5通过促进SWI/SNF亚基的降解,对SWI/SNF复合物具有质量控制功能。之前证明,SMARCB1的缺失比SMARCA4或ARID1A的缺失导致SWI/SNF复合物更大的不稳定,这可能解释了与其他SWI/SNF突变型癌症相比,SMARCB1突变型癌症对DCAF5的优先依赖性。总的来说,该研究揭示了一种机制,该机制是多蛋白复合物质量控制的基础,并构成了肿瘤抑制基因突变失活驱动的癌症中可靶向的合成致命易感性。
原文链接:
www.nature.com/articles/s41586-024-07250-1
百度浏览 来源 : iNature
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)