2020-05-29 来源 : vip说
1
表1. 黑色素瘤在中国与欧美人群的发病部位差异
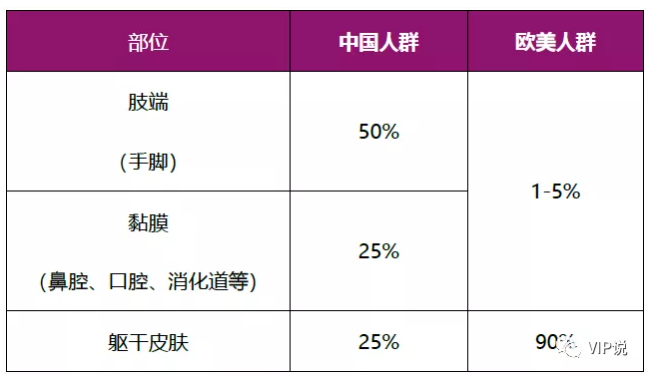


 图1 黑色素瘤分期与治疗
图1 黑色素瘤分期与治疗
图2 黑色素瘤系统治疗药物FDA获批进展
表2. 靶向药物汇总

表3. 靶向药物疗效汇总[7, 9-14]
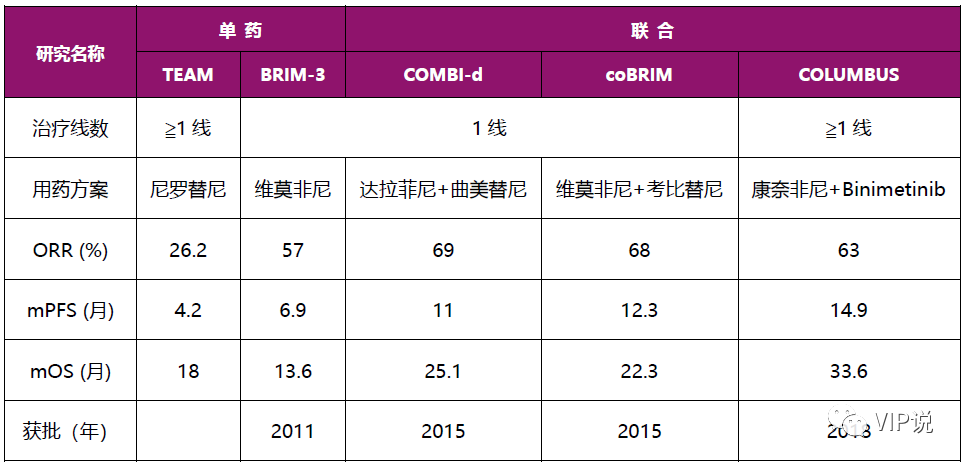
表4. 免疫治疗二线及以上研究[16, 18-21]
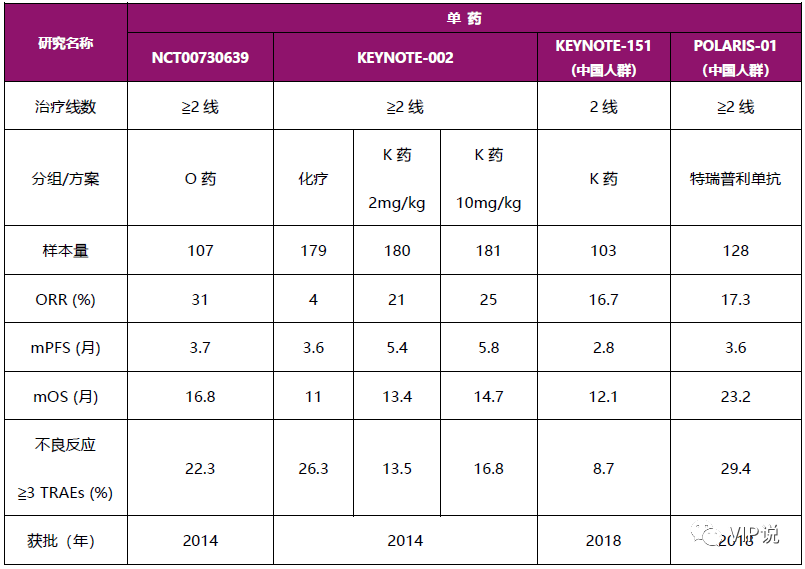
表5. 两项中国人群研究的基线对比[21-23]
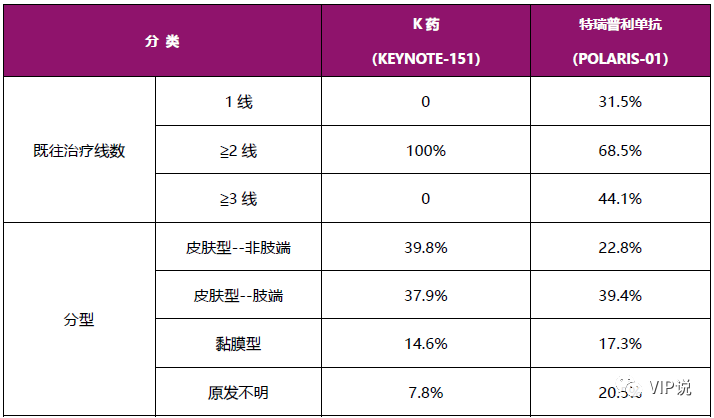
表6. 免疫治疗一线研究[17, 24-27]
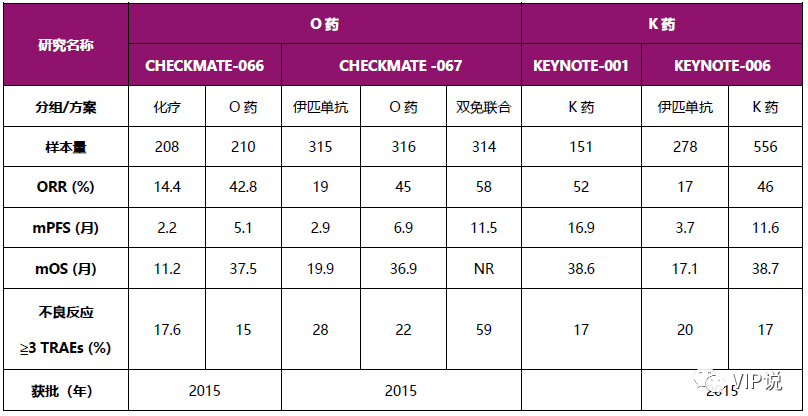
表7. 黏膜型数据对比

参考文献
[1] 北京大学肿瘤医院副院长,北京市肿瘤防治研究所副所长,肾癌黑色素瘤内科主任 郭军接受腾讯健康采访.
[2] Lian B, Cui CL, Zhou L, et al. The natural history and patterns of metastases from mucosal melanoma: an analysis of 706 prospectively-followed patients. Ann Oncol. 2017. 28(4): 868-873.
[3] Guo J, Qin S, Liang J, et al. Chinese Guidelines>[4] Tyrrell H, Payne M. Combatting mucosal melanoma: recent advances and future perspectives. Melanoma Manag. 2018. 5(3): MMT11.
[5] Hersh EM, Del Vecchio M, Brown MP, et al. A randomized, controlled phase III trial of nab-Paclitaxel versus dacarbazine in chemotherapy-naïve patients with metastatic melanoma. Ann Oncol. 2015. 26(11): 2267-74.
[6] Chapman PB, Hauschild A, Robert C, et al. Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med. 2011. 364(26): 2507-16.
[7] McArthur GA, Chapman PB, Robert C, et al. Safety and efficacy of vemurafenib in BRAF(V600E) and BRAF(V600K) mutation-positive melanoma (BRIM-3): extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol. 2014. 15(3): 323-32.
[8] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)恶性黑色素瘤诊疗指南. 2019 .
[9] Long GV, Stroyakovskiy D, Gogas H, et al. Dabrafenib and trametinib versus dabrafenib and placebo for Val600 BRAF-mutant melanoma: a multicentre, double-blind, phase 3 randomised controlled trial. Lancet. 2015. 386(9992): 444-51.
[10] Larkin J, Ascierto PA, Dréno B, et al. Combined vemurafenib and cobimetinib in BRAF-mutated melanoma. N Engl J Med. 2014. 371(20): 1867-76.
[11] Dummer R, Ascierto PA, Gogas HJ, et al. Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2018. 19(5): 603-615.
[12] Dummer R, Ascierto PA, Gogas HJ, et al. Overall survival in patients with BRAF-mutant melanoma receiving encorafenib plus binimetinib versus vemurafenib or encorafenib (COLUMBUS): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2018. 19(10): 1315-1327.
[13] Ascierto PA, McArthur GA, Dréno B, et al. Cobimetinib combined with vemurafenib in advanced BRAF(V600)-mutant melanoma (coBRIM): updated efficacy results from a randomised, double-blind, phase 3 trial. Lancet Oncol. 2016. 17(9): 1248-60.
[14] Guo J, Carvajal RD, Dummer R, et al. Efficacy and safety of nilotinib in patients with KIT-mutated metastatic or inoperable melanoma: final results from the global, single-arm, phase II TEAM trial. Ann Oncol. 2017. 28(6): 1380-1387.
[15] Curtin JA, Busam K, Pinkel D, Bastian BC. Somatic activation of KIT in distinct subtypes of melanoma. J Clin Oncol. 2006. 24(26): 4340-6.
[16] Hodi FS, O'Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med. 2010. 363(8): 711-23.
[17] Robert C, Ribas A, Schachter J, et al. Pembrolizumab versus ipilimumab in advanced melanoma (KEYNOTE-006): post-hoc 5-year results from an open-label, multicentre, randomised, controlled, phase 3 study. Lancet Oncol. 2019. 20(9): 1239-1251.
[18] Topalian SL, Sznol M, McDermott DF, et al. Survival, durable tumor remission, and long-term safety in patients with advanced melanoma receiving nivolumab. J Clin Oncol. 2014. 32(10): 1020-30.
[19] Hamid O, Puzanov I, Dummer R, et al. Final analysis of a randomised trial comparing pembrolizumab versus investigator-choice chemotherapy for ipilimumab-refractory advanced melanoma. Eur J Cancer. 2017. 86: 37-45.
[20] Ribas A, Puzanov I, Dummer R, et al. Pembrolizumab versus investigator-choice chemotherapy for ipilimumab-refractory melanoma (KEYNOTE-002): a randomised, controlled, phase 2 trial. Lancet Oncol. 2015. 16(8): 908-18.
[21] Si L, Zhang X, Shu Y, et al. A Phase Ib Study of Pembrolizumab as Second-Line Therapy for Chinese Patients With Advanced or Metastatic Melanoma (KEYNOTE-151). Transl Oncol. 2019. 12(6): 828-835.
[22] Chi Z, Tang B, Sheng X, et al. A phase II study of JS001, a humanized PD-1 mAb, in patients with advanced melanoma in China. Journal of Clinical OncologyJournal of Clinical OncologyJCO. 2018. 36(15_suppl): 9539.
[23] 拓益说明书 .
[24] Ascierto PA, Long GV, Robert C, et al. Survival Outcomes in Patients With Previously Untreated BRAF Wild-Type Advanced Melanoma Treated With Nivolumab Therapy: Three-Year Follow-up of a Randomized Phase 3 Trial. JAMA Oncol. 2019. 5(2): 187-194.
[25] Hodi FS, Chiarion-Sileni V, Gonzalez R, et al. Nivolumab plus ipilimumab or nivolumab alone versus ipilimumab alone in advanced melanoma (CheckMate 067): 4-year outcomes of a multicentre, randomised, phase 3 trial. Lancet Oncol. 2018. 19(11): 1480-1492.
[26] Carlino MS, Long GV, Schadendorf D, et al. Outcomes by line of therapy and programmed death ligand 1 expression in patients with advanced melanoma treated with pembrolizumab or ipilimumab in KEYNOTE-006: A randomised clinical trial. Eur J Cancer. 2018. 101: 236-243.
[27] Hamid O, Robert C, Daud A, et al. Five-year survival outcomes for patients with advanced melanoma treated with pembrolizumab in KEYNOTE-001. Ann Oncol. 2019. 30(4): 582-588.
[28] Ou W, Taymor E, Diede SJ, Whitman ED. Real-world outcomes of advanced melanoma patients treated with pembrolizumab who have failed prior lines of therapy. Journal of Clinical OncologyJournal of Clinical OncologyJCO. 2019. 37(15_suppl): e21031.
[29] Hamid O, Robert C, Ribas A, et al. Antitumour activity of pembrolizumab in advanced mucosal melanoma: a post-hoc analysis of KEYNOTE-001, 002, 006. Br J Cancer. 2018. 119(6): 670-674.
[30] Sheng X, Yan X, Chi Z, et al. Axitinib in Combination With Toripalimab, a Humanized Immunoglobulin G4 Monoclonal Antibody Against Programmed Cell Death-1, in Patients With Metastatic Mucosal Melanoma: An Open-Label Phase IB Trial. J Clin Oncol. 2019. 37(32): 2987-2999.
[31] Testori A, Ribero S, Indini A, Mandalà M. Adjuvant Treatment of Melanoma: Recent Developments and Future Perspectives. Am J Clin Dermatol. 2019. 20(6): 817-827.
[32] Weber J, Mandala M, Del Vecchio M, et al. Adjuvant Nivolumab versus Ipilimumab in Resected Stage III or IV Melanoma. N Engl J Med. 2017. 377(19): 1824-1835.
[33] Eggermont A, Blank CU, Mandala M, et al. Adjuvant Pembrolizumab versus Placebo in Resected Stage III Melanoma. N Engl J Med. 2018. 378(19): 1789-1801.
[34] Lian B, Guo J. Adjuvant therapy of mucosal melanoma. Chin Clin Oncol. 2014. 3(3): 33.
[35] Lian B, Si L, Cui C, et al. Phase II randomized trial comparing high-dose IFN-α2b with temozolomide plus cisplatin as systemic adjuvant therapy for resected mucosal melanoma. Clin Cancer Res. 2013. 19(16): 4488-98.
[36] Lian B, Cui C, Song X, et al. Phase Ⅲ randomized, multicenter trial comparing high-dose IFN-a2b with temozolomide plus cisplatin as adjuvant therapy for resected mucosal melanoma. Journal of Clinical OncologyJournal of Clinical OncologyJCO. 2018. 36(15_suppl): 9589.
[37] Tawbi HA, Forsyth PAJ, Hodi FS, et al. Efficacy and safety of the combination of nivolumab (NIVO) plus ipilimumab (IPI) in patients with symptomatic melanoma brain metastases (CheckMate 204). Journal of Clinical OncologyJournal of Clinical OncologyJCO. 2019. 37(15_suppl): 9501.
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)