2020-05-29 来源 : vip说
尿路上皮癌起源于移行上皮,绝大多数来源于膀胱(约90%),大约8%来源于肾盂,剩余约2%来源于输尿管、尿道近端2/3(远端尿道由鳞状上皮覆盖)。
根据2018年的全球数据和中国数据:
膀胱癌全球新发病例549393人,死亡病例199922人;
中国新发病例82270人,死亡病例38208人,
膀胱癌占癌症死亡病例第10位,其中90%是尿路上皮癌[1]。治疗手段包括手术、化疗、放疗和免疫治疗,诊疗流程见下图
非肌层浸润性膀胱癌(NIMBC),约占初发患者的70%,特征是高复发率和低死亡率,1976年Morales等[2]首次报道了膀胱内灌注卡介苗(BCG)治疗这类患者的疗效,完全缓解率(CR)可达70%~80%,通过经尿道膀胱肿瘤电切术+膀胱灌注标准治疗,5年总体生存率约为90%。至今,BCG治疗仍是NIMBC患者治疗首选。
肌层浸润性膀胱癌(IMBC),约占初发患者的20%,标准治疗是根治性膀胱全切+盆腔区域淋巴结清扫术,5年总体生存率约为60%。
局部晚期和转移性膀胱癌(mUC),约占初发患者的10%,30年里无重要治疗进展,化疗是mUC患者的唯一选择,对无禁忌患者,含铂化疗联合用药方案是标准疗法。
1. 初治mUC的标准治疗方案是以铂类为基础的化疗,总体ORR约为50%, mOS大约9-15m,5年总生存率约为5-15%。
2. 一线铂类化疗失败的mUC患者的预后非常差,mOS大约5-7m,二线化疗有效率仅为10%左右,无标准化疗方案,仅有紫杉醇类、培美曲塞、长春氟宁等备选药物,且毒性较大[3-4],汇总如下图。
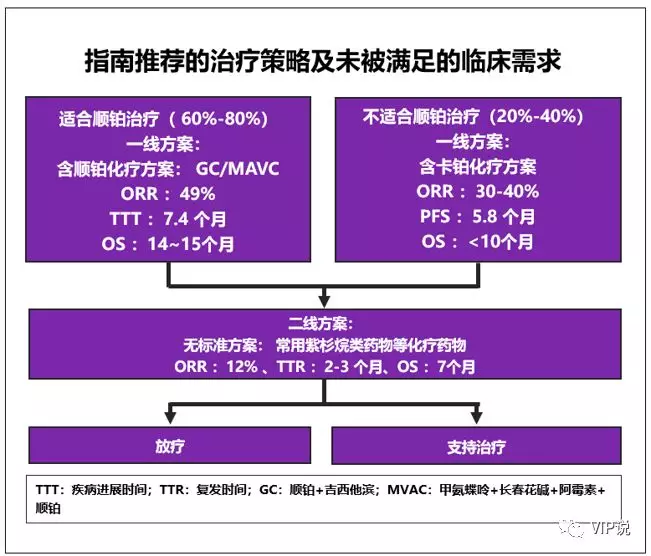
如何延长mUC的OS成为临床研究迫切需要解决的问题。
膀胱癌肿瘤突变负荷(TMB)居第三位[5],仅次于肺癌和黑色素瘤。肿瘤细胞的TMB越高,免疫原性越强,T细胞越容易识别,免疫杀伤效果越好。目前已经公布的各大常见肿瘤接受免疫检查点抑制剂治疗的有效率,和TMB大小几乎是线性关系。
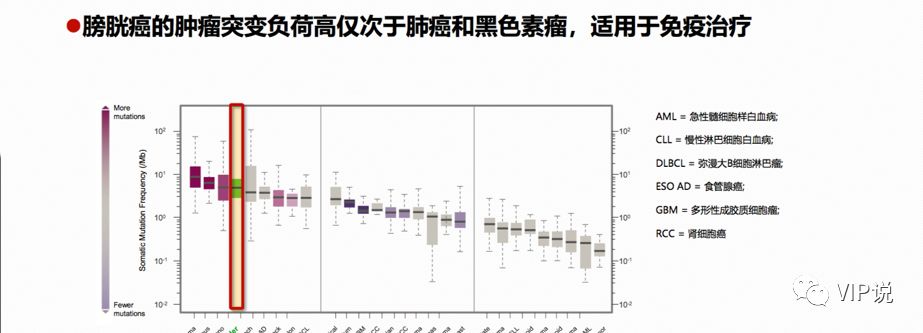
2016年以来,免疫治疗在晚期尿路上皮癌(膀胱癌为主90%)治疗领域的研究取得了巨大成功,彻底改变了晚期尿路上皮癌以化疗为主的治疗格局[4]。

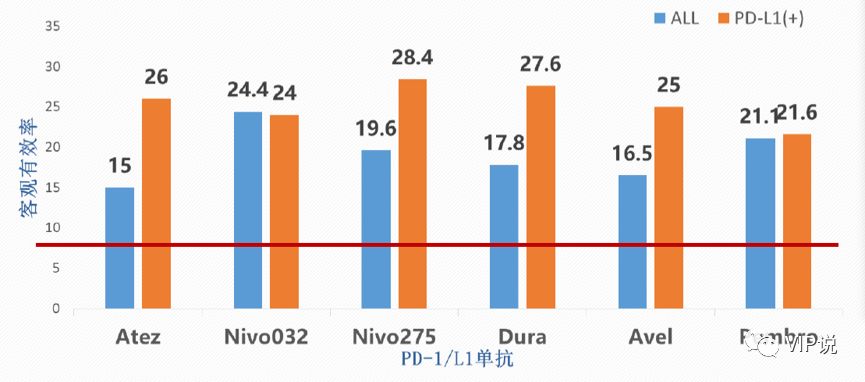
免疫治疗打破了30年来膀胱癌治疗只有吉西他滨+顺铂一个方案的现状。FDA先后批准了5种PD-1/PD-L1用于膀胱癌的治疗。二线治疗的客观缓解率(ORR)从10%左右提升至27%,其中PD-L1高表达的患者ORR高于低表达患者;mOS从7个月提高至近20个月;一线不耐受顺铂患者的mOS从不足10个月提升至19个月[6-8]。
看完进口药物疗效,再看看国产PD-1疗效如何?
特瑞普利单抗的Ⅱ期注册临床研究,整体人群的ORR达到22.7%,疾病控制率50.0%,mPFS达到1.9个月,mOS达到18.7个月;对于PD-L1表达阳性患者,ORR高达38.5%;mPFS长达10.9个月[9]。
替雷利珠单抗抗的BGB-A317-204研究,入组PD-L1表达阳性的mUC患者,ORR也达到了23.1%[10],mOS 9.8个月。
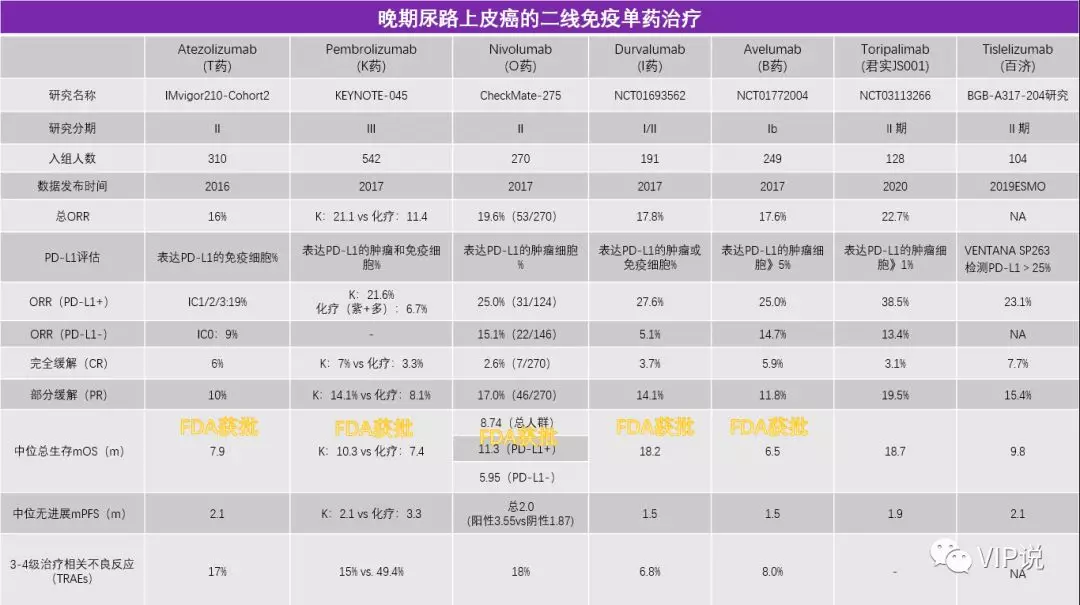
由于局部晚期/转移性的尿路上皮癌患者的体力状况以及相关并发症,仅约1/3的患者能够承受以顺铂为基础的一线化疗方案。
根据国际共识,肾小球滤过率<60 ml·min-1·1.73 m-2的患者不能接受顺铂,并且很难使用其他非铂类的化疗药物治疗。
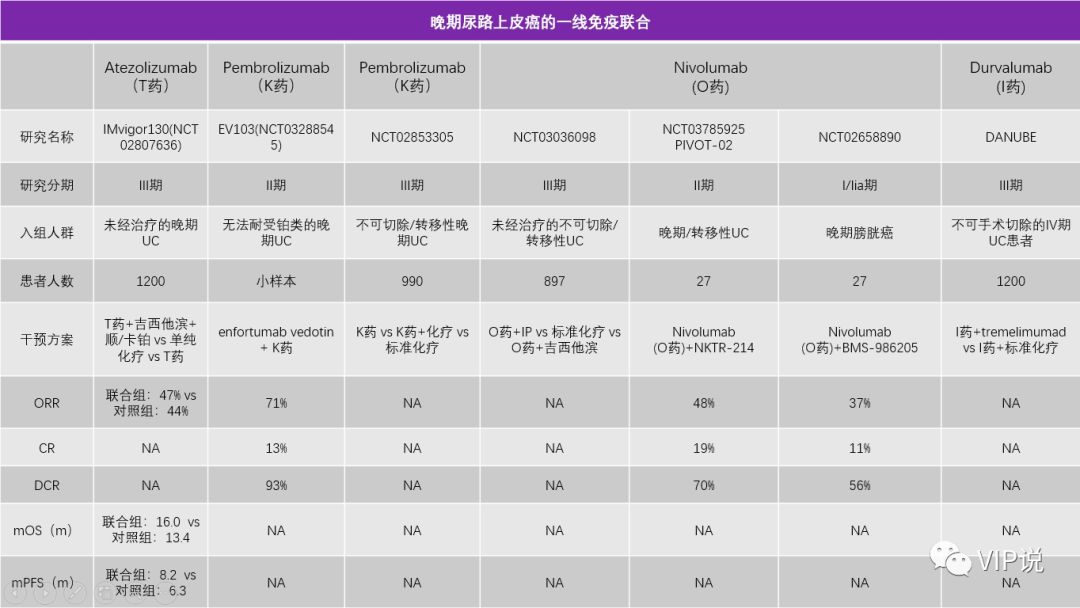
美国和欧洲已经批准K药和T药等药物用于不耐受铂类的mUC一线治疗, ORR在20%左右, mOS在11.3-15.9个月,而既往的化疗一线数据mOS在9-15个月。
值得注意的是,在一线治疗的IMvigor210-Cohort1临床试验中,PD-L1蛋白表达与OS/ORR无关;
但在一线治疗的Keynote-052研究,二线治疗的IMvigor210-Cohort2以及Checkmate275临床试验中,PD-L1蛋白高表达组较低表达组却有更加好的mOS/ORR。
近期Avelumab的III期临床试验JAVELIN Bladder 100中期分析也到达了改善OS的主要终点,结果发现,Avelumab+最佳支持治疗(BSC)治疗组患者的OS显著长于仅接受BSC的患者,而且这种统计学显著性差异在所有患者和PD-L1阳性亚组患者中均有体现,安全性良好,可能会成为首个获批的一线维持治疗膀胱癌的PD-L1单抗。
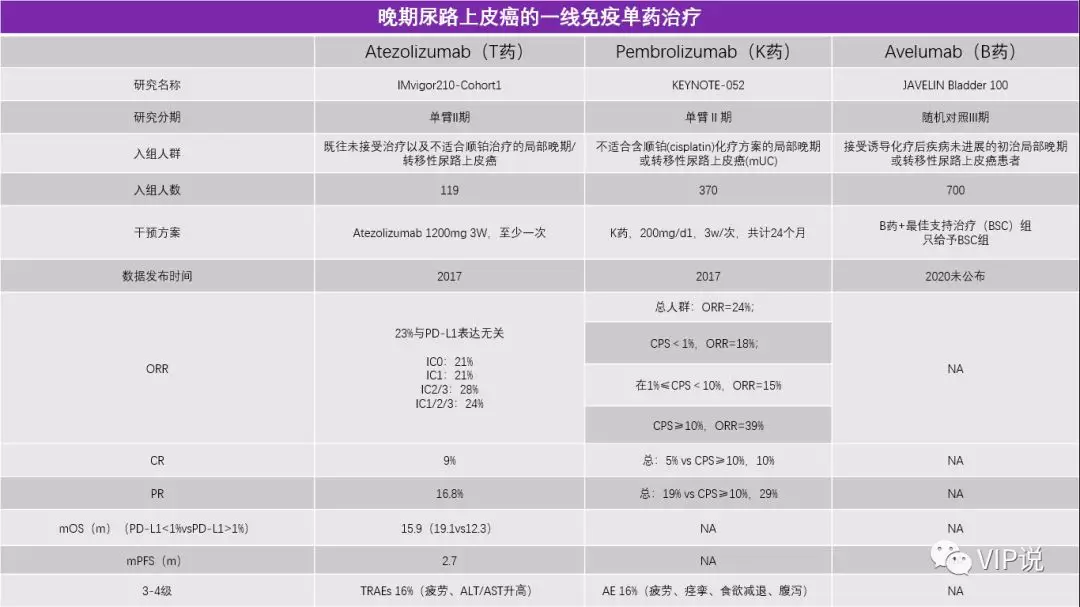
2019年ESMO公布了IMvigor130的结果,采用T药+吉西他滨+顺铂对比单纯化疗,主要研究终点PFS从6.3个月提高到8.2个月,虽然是阳性结果,但价值相对有限。
OS从13.4个月提高到16.0个月,数据无统计学差异。
T药单药与化疗相比,也没有OS的获益,仅PD-L1阳性亚组人群能够从单药治疗中取得OS获益 [10-11]。
在晚期尿路上皮癌的一线/二线治疗中,免疫治疗取得了空前的成功,但免疫治疗有其局限性,比如总体ORR仅在20%左右,PFS时间短(仅为2-3个月),延长OS有限(3-5个月),不良反应事件发生率较多,价格昂贵等等;但一旦治疗有效,患者可长期获益,疗效持续时间甚至可达到近2年,因此人群筛选很重要。
泌尿系统肿瘤尚无成熟的生物标记物,大部分研究显示PD-L1阳性患者免疫治疗的疗效可能更好,但PD-L1尚不能成为成熟的疗效预测标记物,其意义尚需进一步探索。
IMvigor210临床试验中,对免疫治疗有效(CR+PR)的患者相较无效的患者有更高的TMB,提示TMB高的人群可能获益更多,仍待进一步证明;
抗体偶联药物(ADC)- Enfortumab vedotin(EV)用于晚期尿路上皮癌二、三线治疗的1期临床研究的结果,ORR 31%,其中肝转移39%,mPFS 5.4月,mOS 13.6月[12],FDA可能在今年批准其二/三线治疗尿路上皮癌。
膀胱癌中FGFR突变概率只有20%左右,2018年ASCO公布的FGFR抑制剂Erdafitinib治疗合并FGFR突变mUC的2期临床研究,ORR 40%,mPFS 5.5个月,优于二线PD-1/PD-L1治疗[11],2019年美国FDA批准其二线治疗携带FGFR突变的转移性尿路上皮癌。FGFR抑制剂可能成为在mUC靶向治疗领域的新突破。
以上两个研究提示免疫和靶向/ADC联合可能是未来的发展方向。
迄今为止,尿路上皮癌关于免疫检查点抑制剂的临床试验主要集中在转移性尿路上皮癌(mUC)上。
免疫治疗、靶向药物、FGFR抑制剂、抗体偶联药物都是可选药物,但免疫治疗已成为标准二线治疗方案;
一般情况好、淋巴结转移、瘤负荷小、无FGFR突变的mUC患者,尤其是PD-L1阳性,顺铂不耐受的患者,首选免疫治疗;
特瑞普利单抗在二线治疗mUC取得了较好疗效,值得关注;
化疗为主,免疫为辅,一线治疗中免疫联合化疗治疗暂时不能改变临床实践,合理的优势人群筛选非常必要;
未来也许免疫治疗与抗体偶联药物/靶向药物的联合,会打破铂类化疗在mUC的治疗地位。
1. GLOBOCAN 2018
2. MORALES A, EIDINGER D, BRUCE A W. Intracavitary Bacillus Calmette-Guerin in the treatment of superficial bladder tumors[J]. J Urol, 1976, 116(2): 180-183.
3. 膀胱癌诊疗规范(2018年版)
4. NCCN Guideline 2020 V2.
5. Choudhury NJ, et al. EurUrolFocus. 2016;2:445-452. 2. KandothC, et al. Nature. 2013;502(7471):333-339.
6. Balar AV, Galsky MD, Rosenberg JE, et al: Atezolizumab as first-line treatment in cisplatin-ineligible patients with locally advanced and metastatic urothelial carcinoma: a single-arm, multicentre, phase 2 trial. Lancet 389:67-76, 2017
7. Patel MR, Ellerton JA, Infante JR, et al. Avelumab in patients with metastatic urothelial carcinoma: pooled results from two cohorts of the phase 1b JAVELIN solid tumor trial[J]. J Clin Oncol, 2017, 35(6_suppl): 330.
8. Bellmunt J,de Wit R,Vaughn DJ,et al.Pembrolizumab as Second-Line Therapy for Advanced Urothelial Carcinoma.N Engl J Med 2017.(keynote045)
9. J Clin Oncol 38, 2020 (suppl 6; abstr 504)
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)