2021-09-08 来源 : 知乎 作者 知识分子
新冠病毒的起源是一个科学难题,病毒的基因组突变特征为追溯其进化历程提供了新证据 | 图源:pixabay.com
导 读
2019年新冠疫情暴发以来,特别是2021年5月以来,新冠病毒是否起源于自然界的争论愈演愈烈。一部分学者基于进化理论和历史经验指出,新冠病毒起源于自然界;另一部分学者则提出了新冠病毒来源于人工改造的可能性。两种起源假说目前均缺乏足够的实证性数据支持,这一情形也导致了关于新冠病毒起源的讨论逐渐超出了科学的范畴。8月27日,美国国家情报总监办公室发布所谓 “新冠病毒溯源调查报告” 要点,进一步偏离了病毒溯源的科学属性。
中科院遗传发育所的科研人员通过分析新冠病毒的突变特征,对新冠病毒的起源开展了实证研究,结果支持新冠病毒起源于自然界,该研究于2021年8月30日在线发表于The Innovation 期刊。无独有偶,中山大学的科研人员运用了相似的研究思路并得出了同样的结论,于2021年7月5日发布于bioRxiv 预印本网站。科研人员是基于什么样的科学原理得到相关结论的呢?
01 为什么新冠病毒的起源会存在科学争议?
新冠病毒是有记录以来与人类交手的第七种冠状病毒 [1]。冠状病毒是危害人类健康的老对手,为什么偏偏新冠病毒的起源存在科学争议呢?新冠病毒的几个 “亲戚”,同属于β属冠状病毒的非典病毒(SARS-CoV)和中东呼吸综合征病毒(MERS-CoV)它们的起源过程是如何确定的?同样的方法为什么不适用于新冠病毒呢?
对于非典病毒和中东呼吸综合征病毒,在这两次疫情的暴发初期,科学家们分别在果子狸和骆驼中分离出与他们序列相似度超过99%的同源病毒,随后,又进一步在蝙蝠中发现了相关的冠状病毒 [2,3,4]。这些证据显示,蝙蝠是冠状病毒的自然宿主,而果子狸和骆驼则分别是非典病毒和中东呼吸综合征病毒的中间宿主,两种病毒均起源于自然界。
然而,对于新冠病毒,科学家们尚未从野生动物中分离到与其序列足够相似的病毒。目前已报道的最为相近的病毒是从菊头蝠中测序得到的蝙蝠冠状病毒RaTG13,与新冠病毒序列的相似度仅为96% [5]。据科学家推测,新冠病毒与RaTG13的进化分歧大约发生在1969年,到2019年疫情暴发,新冠病毒在这50年之中积累了500多个突变 [6,7]。这500多个突变就如同一道鸿沟,横亘在新冠病毒溯源的道路上,让新冠的起源成为一个科学难题(图1)。
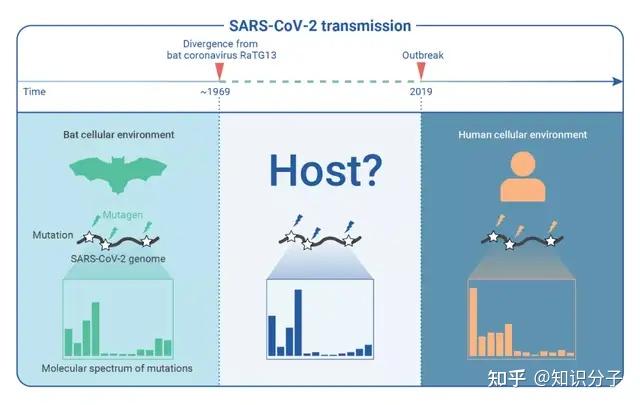
图1 新冠病毒的起源是一个科学难题。图源:参考资料[9]
02 新冠病毒的基因组突变特征,或可帮助追溯其进化历程
虽然目前还没有找到序列与新冠病毒足够相似的冠状病毒,但是已有的冠状病毒基因组序列中,是否隐藏着新冠病毒进化的蛛丝马迹?这些信息是否可以用来追溯其起源历程呢?
我们先来想象这样一种场景,假设我们想知道某个人曾经在哪个地区生活过,遗憾的是,这个人的履历信息是一片空白,因此我们并没有直接证据来判断他的经历。但是由于每个地区都有自己的独特的方言,在这一地区生活过的人或多或少带有一些口音。因此,这个人的口音就可以成为判断其生活经历的重要证据。
新冠病毒的现有序列数据中会不会有这种 “口音” 信息呢?科学家们把目光转移到了在疫情暴发前新冠病毒基因组上发生的500多个突变上。组成新冠病毒基因组序列的碱基共有4种,分别是A、U、C、G。每一种碱基都可以突变成另外3种,因此在病毒基因组上,共有4×3=12种突变类型。当病毒在宿主细胞中扩增时,12种突变类型的发生频率不尽相同,因此病毒基因组上检测到的12种突变类型数目的相对比例,就组成了病毒的突变频谱。
中科院遗传发育所的研究者利用一种全新的方法鉴定了新冠病毒在细胞中扩增时产生的新生突变频谱,发现病毒突变频谱特征(后文简称为 “突变特征”)几乎完全决定于病毒扩增所处的细胞环境。举个例子,细胞代谢过程不可避免地会产生活性氧,其氧化性会诱发G>U突变。当新冠病毒在活性氧浓度较高的灵长类动物细胞中进化时,会产生较多的G>U突变(图2)[8,9],而在活性氧浓度较低的其它一些物种(例如蝙蝠)进化时,就不会产生过多的G>U突变。也就是说,活性氧(以及其他可能会诱发产生突变的物质)会形成的细胞类型特异的突变特征,这就成为了病毒的 “口音”。
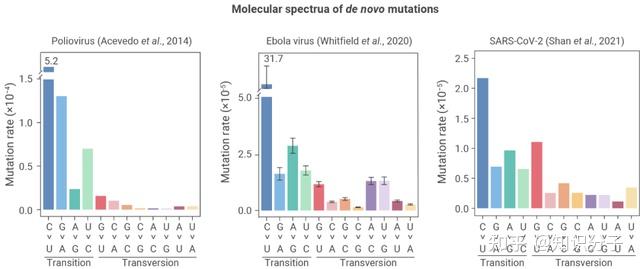
图2 新冠病毒及其它RNA病毒的新生突变频谱(左起:脊髓灰质炎病毒、埃博拉病毒、新冠病毒)。图源:参考资料[9]
03 新冠病毒在疫情暴发前积累的突变特征,与野生蝙蝠细胞环境一致
这些突变特征似乎可以对科学家们 “说出” 病毒的经历。如果新冠病毒起源于自然界,那么它在疫情暴发前积累的突变特征(上文提到的500多个突变包含的信息)就会和某一自然宿主的细胞环境相吻合。如果新冠病毒源于人工改造,那么其突变特征可能会和自然过程产生的特征大相径庭。
有了理论上的支持,科学家们就开始正式探索 “破案”。为此,他们构建了非典病毒、中东呼吸综合征病毒、新冠病毒以及与它们相关的冠状病毒的进化树,这些病毒分离于病人、蝙蝠、骆驼、果子狸、穿山甲和刺猬(图3)。
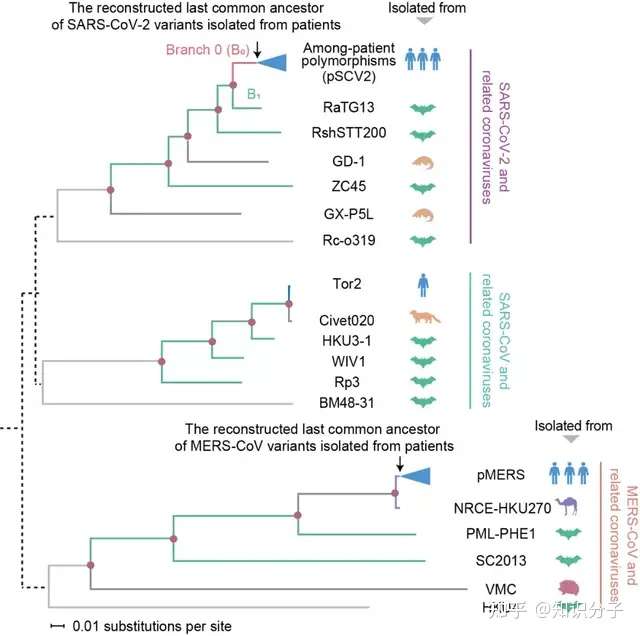
图3 非典病毒、中东呼吸综合征病毒、新冠病毒以及相关冠状病毒的进化树。图源:参考资料[9]
科学家们鉴定了病毒进化历程上不同时期发生的突变,发现在不同宿主环境中进化的冠状病毒带有各自鲜明的突变特征。例如在人类细胞中扩增的病毒的突变特征显著区别于蝙蝠细胞中扩增的病毒,而且宿主物种的进化关系越近,病毒的突变特征越相似(图4)。
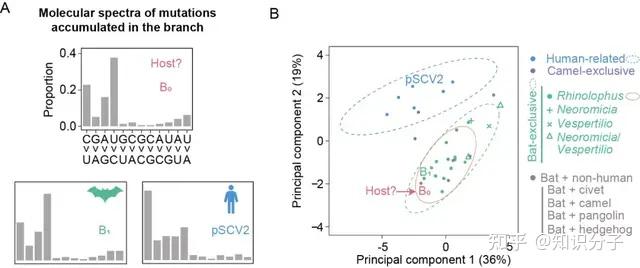
图4 新冠病毒在1969-2019年间的突变特征与野生菊头蝠细胞环境高度相符。图源:参考资料[9]
在疫情暴发前的这段时期内,研究人员关注的新冠病毒积累的突变特征(图4红色B0点)与野生菊头蝠细胞环境(橙色椭圆)一致,提示着新冠病毒在这段时期内所处的细胞环境与野生蝙蝠的细胞环境高度相似,这为新冠病毒的自然起源提供了公开透明和实证性的数据支持 [9]。
04 蝙蝠与人之间是否可能存在中间宿主?
在疫情暴发前积累的突变特征,显示新冠病毒在这一阶段的进化历程与在野生蝙蝠中的进化过程高度一致,暗示着新冠病毒从蝙蝠直接传给了人。因为如果有较长时间的中间宿主,那这500多个突变应该会混杂有两个宿主的突变特征,检测到的突变特征不会完全和蝙蝠细胞环境一致。
但是,中间宿主的可能性可以被完全排除吗?
回到 “口音” 的例子,由于 “口音” 的形成取决于一个人在这个地区生活的时长,如果这个人在一个地区生活时间过短,他可能无法形成可识别的口音。基于突变特征进行溯源也有类似的局限性,该方法可能无法检测到病毒存在较短时间的宿主。
在上述研究中,中东呼吸综合征病毒在传给人之前的宿主(骆驼)确实可以利用突变特征检测到,但被认为是非典病毒中间宿主的果子狸并未在非典病毒的突变特征中留下明显的痕迹(图4)。因此,该研究无法排除新冠病毒在从蝙蝠传染给人之前曾在某个中间宿主中短暂停留的可能性。
同一时间,中山大学的科学家使用了类似的思路分析了新冠病毒的突变,他们的结论同样支持新冠病毒的自然起源 [10]。总之,利用病毒基因组上的突变特征追溯病毒的进化历程,可以揭示病毒基因组进化的基本规律,目前的数据表明新冠病毒极有可能起源于自然界。
歌德说过,“十全十美是上天的尺度,而要达到十全十美的这种愿望,则是人类的尺度”。科研探索也是一样,完美的科研论证也许并不存在,科学家总是在不断的探索中不断的扬弃,但正是这样的过程中,人类更接近了自然科学的真相。新冠病毒起源,依然值得更多的努力去探索,相信不久的将来,真相一定会水落石出。
参考资料
1. Zhu, N., Zhang, D., Wang, W., et al. (2020). A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med 382, 727-733.
2. Guan, Y., Zheng, B.J., He, Y.Q., et al. (2003). Isolation and characterization of viruses related to the SARS coronavirus from animals in southern China. Science 302, 276-278.
3. Alagaili, A.N., Briese, T., Mishra, N., et al. (2014). Middle East respiratory syndrome coronavirus infection in dromedary camels in Saudi Arabia. mBio 5, e00884-00814.
4. Cui, J., Li, F., and Shi, Z.L. (2019). Origin and evolution of pathogenic coronaviruses. Nat Rev Microbiol 17, 181-192.
5. Zhou, P., Yang, X.L., Wang, X.G., et al. (2020). A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 579, 270-273.
6. Lytras, S., Hughes, J., Martin, D., et al. (2021). Exploring the natural origins of SARS-CoV-2 in the light of recombination. bioRxiv 10.1101/2021.1101.1122.427830.
7. Boni, M.F., Lemey, P., Jiang, X., et al. (2020). Evolutionary origins of the SARS-CoV-2 sarbecovirus lineage responsible for the COVID-19 pandemic. Nat Microbiol 5, 1408-1417.
8. Panchin, A.Y., and Panchin, Y.V. (2020). Excessive G-U transversions in novel allele variants in SARS-CoV-2 genomes. PeerJ 8, e9648.
9. Shan, K.-J., Wei, C., Wang, Y., Huan, Q., and Qian, W. (2021). Host-specific asymmetric accumulation of mutation types reveals that the origin of SARS-CoV-2 is consistent with a natural process. The Innovation 2, 100159
10. Deng, S., Xing, K., and He, X. (2021). Mutation signatures inform the natural host of SARS-CoV-2. bioRxiv 2021.07.05.451089.
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)