肺癌是中国及世界范围内发病率和死亡率较高的恶性肿瘤之一,其中非小细胞肺癌(NSCLC)是最常见的类型,约占肺癌患者的85%,且多数患者确诊时已处于中晚期。
近年来,随着PD-1/PD-L1抑制剂相关研究的不断探索,推动了肿瘤免疫治疗的发展,提高了患者的生存获益。多项临床试验已经证实了PD-1/PD-L1抑制剂在多种恶性肿瘤中的优越疗效。但应用PD-(L)1治疗难免会产生耐药,对PD-(L)1治疗耐药的NSCLC患者预后不佳。目前,针对PD-(L)1耐药后的患者,临床研究已进行了诸多探索,更换ICI药物、PD-(L)1再挑战或免疫联合方案都显示了一定的临床获益,而双特异性抗体、抗体偶联药物(ADC)等新型治疗药物的不断涌现,更是为该类患者带来了新的希望。
免疫治疗耐药主要分为原发性耐药和获得性耐药[1]。
- 原发性耐药(primary resistance):指肿瘤患者初始接受免疫治疗完全无反应,相反,病情发展迅速或进展。
- 获得性耐药(acquired resistance):指肿瘤患者初始对免疫治疗较好的应答,但是随后出现进展。
免疫治疗获得性耐药与多种机制相关:如免疫抑制性细胞增加、肿瘤微环境中细胞因子和肿瘤代谢物释放、免疫抑制分子上调等,针对不同耐药机制的应对策略正在探索中。
(1)更换其它免疫检查点抑制剂(ICI):
① 使用某种PD-(L)1耐药后更换另一种PD-(L)1
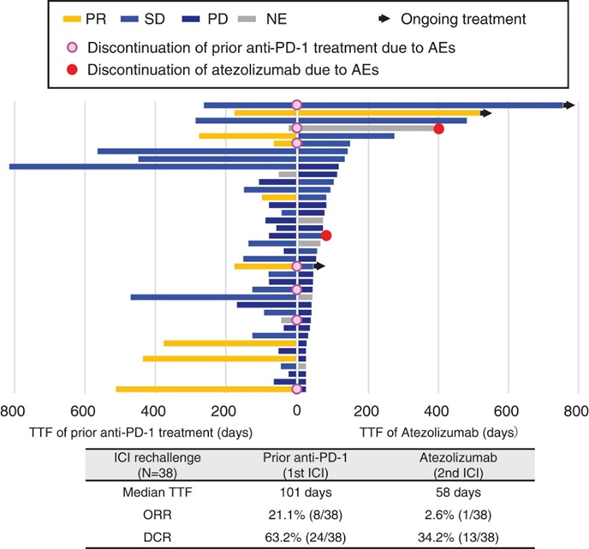
即使是同为PD-1抗体的帕博利珠单抗和纳武利尤单抗在药物结构及药理性质上也存在很大差异,疗效也有所不同。因此,当其中一种药物出现耐药后更换另一种药物也许可以取得不同的治疗结果。PD-1更换为PD-L1:2021年,发表在Thoracic Cancer的一项研究[2],回顾性的分析了38例NSCLC患者在使用PD-1抑制剂纳武利尤单抗或帕博利珠单抗耐药后,换用PD-L1抑制剂阿替利珠单抗进行治疗,结果显示,中位TTF为58天,ORR为2.6%,DCR为34.2%,获益有限但耐受性良好。
图1. PD-1耐药后患者接收阿替利珠单抗治疗疗效数据PD-L1更换为PD-1:另一项日本回顾性小样本研究[3],分析了15例NSCLC患者在使用PD-L1抑制剂耐药后,换用PD-1抑制剂纳武利尤单抗(N=7)和帕博利珠单抗 (N=8)进行治疗的疗效。结果显示,纳武利尤单抗和帕博利珠单抗再次治疗的PFS为1.9 个月和2.8个月,获益有限。因此,就以上两项小样本的回顾性分析研究而言,NSCLC患者在PD-1/PD-L1耐药后互换治疗疗效较为有限,有待进一步的大型研究去探索PD-1抑制剂和PD-L1抑制剂之间互换的疗效和安全性。② PD-(L)1无效后换用其它靶点ICI,如CTLA-4抑制剂
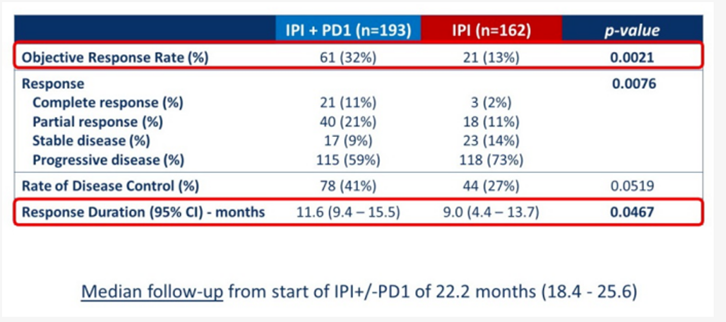
在PD-1耐药后尝试更换为CTLA-4抑制剂,也是目前解决PD-1耐药的一个策略。2020年 ASCO上报道了一项多中心的回顾性研究,将355名PD-1抑制剂单药治疗失败的患者分成2组,一组接受伊匹木单抗治疗(n=162),另一组患者接受双免疫治疗(n=193)。研究结果显示,接受单药和双免疫治疗的ORR分别是13%和32%,DCR为27%和41%。PD-1耐药后,更换或者联用CTLA-4均能取得获益,且联合治疗获益更显著。
(2)PD-(L)1再挑战:使用PD-1抑制剂治疗后进展,部分人群继续使用可能仍能达到一定的治疗效果。
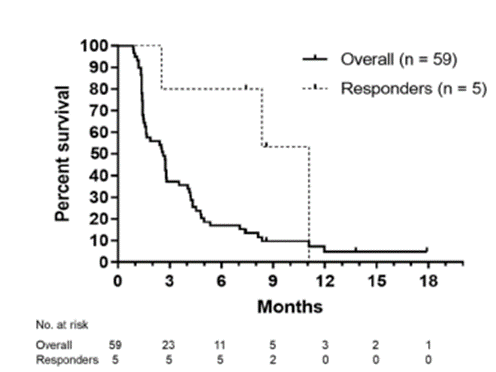
2020年,发表在Journalof Clinical Medicine上的一项研究[4],纳入了35例因疾病进展而中断初始免疫治疗之后“再挑战”的晚期NSCLC患者。结果显示,PD-1单抗“再挑战”后,ORR为2.9%,DCR达42.9%,中位PFS为81天,中位OS为225天,再挑战仍能起到一定的疗效。2021年ESMO上公布的一项Ⅱ期研究——日本西部肿瘤协作组(WestJapan Oncology Group)9616L(WJOG9616L)[5]也进行了再挑战的探索,该项单臂、前瞻性研究共纳入了61例先前经过ICI治疗有临床获益后出现进展的晚期 NSCLC 患者,应用纳武利尤单抗再挑战治疗。研究结果显示,中位PFS为2.6个月,中位OS为11.0个月,ORR为8.5%,DCR为50.9%(包括5例PR和25例SD),值得注意的是,5例对纳武利尤单抗治疗产生应答的患者中位PFS达11.1个月,提醒我们需要进一步探索再挑战治疗的疗效预测生物标志物,以明确真正获益的人群。
图3. PFS 的 Kaplan-Meiyer 曲线
(3)免疫联合模式
① PD-(L)1联合化疗:
化疗通过细胞毒性直接杀伤肿瘤细胞,并且可以破坏肿瘤细胞的逃逸能力,改变肿瘤微环境,使其更容易被免疫系统识别,因此免疫联合化疗可提高整体抗肿瘤疗效,有效防止肿瘤复发转移。部分临床研究表明,PD-1抑制剂在联合化疗使用后,客观缓解率明显提高且疾病无进展生存期显著延长。在BTCRC-LUN15-029研究[6]中,将帕博利珠单抗联合化疗用于既往抗PD-1/L1治疗失败的晚期NSCLC,研究结果显示,相比单纯化疗历史对照,帕博利珠单抗联合化疗能够延长既往接受过免疫治疗获益后进展的晚期NSCLC的PFS,中位PFS为5.2个月,中位OS为25.7个月。② PD-(L)1联合抗血管:
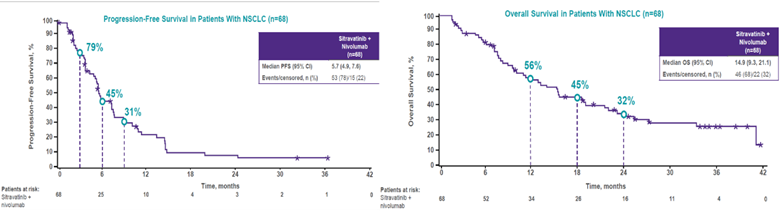
抗血管生成药物可以抑制肿瘤新生血管生成,改善肿瘤微环境,影响肿瘤生长和转移。在免疫治疗的基础上,联合抗血管生成靶向药,有望达到更好的控制肿瘤生长的协同增效作用。在COSMIC-021研究[7]队列7中,纳入了30例既往接受过ICIs治疗的非鳞NSCLC患者,既往治疗线数≤2,接受阿替利珠单抗联合卡博替尼治疗,研究结果显示,ORR为27%,DCR为83%,中位DoR为5.7个月,未出现3级以上的免疫相关不良事件。MRTX-500研究[8]同样探索了纳武利尤单抗与Sitravatinib(一种多靶点受体酪氨酸激酶抑制剂)联合用于既往ICIs治疗进展的非鳞NSCLC,主要终点为ORR,次要终点包括 OS、PFS和安全性。研究结果显示,在免疫耐药的非鳞 NSCLC 中,联合治疗的ORR为18%,包括2例 CR,DCR为78%,中位DoR 为12.8个月,中位OS 为14.9个月,中位PFS 为5.7个月,进一步验证了免疫联合抗血管治疗模式的疗效获益。③ 双免疫联合:
双免疫联合是目前针对PD-(L)1耐药问题的研究较多的方案,主要以联合CTAL-4单抗为主。多项研究已经取得了一定的成果,但从目前的研究来看,不良反应发生率高并且对不同类型患者效果差异大,希望后续研究的推进能找到更合适的剂量或用药方式来解决这些问题。此外,在2020年的ESMO上,也报道了一项将PD-1联合TIGIT治疗抗PD-1/L1难治(接受过≥2剂抗PD-1/L1治疗,最后一次给药后24周内疾病进展)的晚期转移性NSCLC的研究(NCT02964013)[9],联合治疗组ORR为5%,中位DoR为13个月,期待未来该联合模式的进一步探索。(1)抗体偶联药物(ADC)
SAR408701是一种靶向癌胚抗原相关细胞黏附分子5(CEACAM5)的DM4结合型ADC,2020年ASCO年会上,SAR408701治疗非鳞状NSCLC的研究(NCT02187848)[10]结果显示,SAR408701在之前已接受过多线治疗的CEACAM5高表达的晚期非鳞状NSCLC患者中具有良好的抗肿瘤活性,目前CARMEN-LC03研究也在探索其对于ICIs治疗后进展的非鳞状NSCLC的疗效,期待未来更多研究数据的公布。(2)肿瘤浸润淋巴细胞(TIL)疗法
肿瘤浸润淋巴细胞(Tumor Infiltrating Lymphocyte, TIL)疗法是一种新型的过继细胞免疫疗法,已经在多个瘤种的研究中取得了优异疗效,如宫颈癌、结肠癌、黑色素瘤、乳腺癌等。2021年8月,美国莫菲特癌症中心在Nature Medicine上发表了一项基于TIL疗法治疗PD-1耐药晚期NSCLC的单臂、开放标签的Ⅰ期临床研究(NCT03215810)[11],研究结果显示,在13例接受纳武利尤单药治疗进展的晚期NSCLC患者中,经TIL疗法治疗后,有11例患者肿瘤负荷减少,靶病灶中位最大缩小比例为-35.5%(变化范围为+20至-100%),2例患者在1.5年后取得了持续的CR,显示了TIL疗法对于PD-1耐药的NSCLC患者的治疗潜力。(3)双特异性抗体
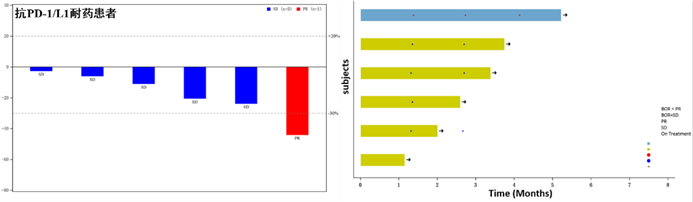
卡度尼利单抗(AK104)是由康方生物自主研发的新型、首创的PD-1/CTLA-4双特异性抗体,在宫颈癌、胃癌、肝癌等多种肿瘤的研究阶段性初步数据显示,相比PD-1联合CTLA-4的双免疫联合疗法,卡度尼利展现出了更好的疗效及安全性。卡度尼利作为一种双特异性抗体,在与安罗替尼联合治疗晚期NSCLC中展现出良好的疗效和突出的安全性,除了初治的NSCLC患者外,前线接受过PD-(L)1抑制剂治疗的患者,也能够从卡度尼利方案中显著获益。6例曾经接受过PD-1/L1抑制剂治疗的患者接受卡度尼利联合安罗替尼治疗,其中1例患者达到了部分缓解,ORR为16.7%,但所有患者的病灶都有不同程度的缩小,疾病控制率达到了100%,为PD-(L)1治疗后耐药的患者带来新的希望。图6.抗PD-1/L1耐药患者的肿瘤缩小瀑布图及治疗时间泳图
针对PD-(L)1耐药后患者,PD-(L)1再挑战、更换其它PD-(L)1或是在PD-(L)1的基础上联合都显示了不同程度的获益,未来仍需要更多大样本的前瞻性研究数据提供更多证据。并且进一步探索再挑战治疗的疗效预测性生物标志物,以明确真正获益的人群,也是未来值得关注的问题。
而随着ADC、双特异性抗体等新型治疗药物等不断探索,也为我们带来了新的治疗选择,希望未来更多研究数据的公布,为PD-(L)1耐药后患者带来更多获益。1.Lei Q, et al. Front CellDev Biol. 2020 Jul 21;8:672.2.Furuya N,et al. ThoracCancer. 2021 Mar;12(5):613-618.3.Fujita K, et al.Thorac Cancer. 2020Jan;11(1):15-18.4.Katayama Y, et al.J Clin Med. 2019 Dec 31;9(1):102.5.2021 ESMO Abstract #1291P.6.Nikhil Shukla, et al. 2021 ASCO abstarct #9073.7.Joel W. Neal, et al. WCLC2020,FP14.08.8.Ticiana A. Leal et al.2021 ESMO. abstract#1190O.9.2020 ESMO Abstract#1400P.10.Gazzah A,et al.J ClinOncol 38:2020(suppl;Abstr 9505).11.Creelan BC, et al.NatMed. 2021 Aug;27(8):1410-1418.版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。






发表评论
注册或登后即可发表评论
登录注册
全部评论(0)