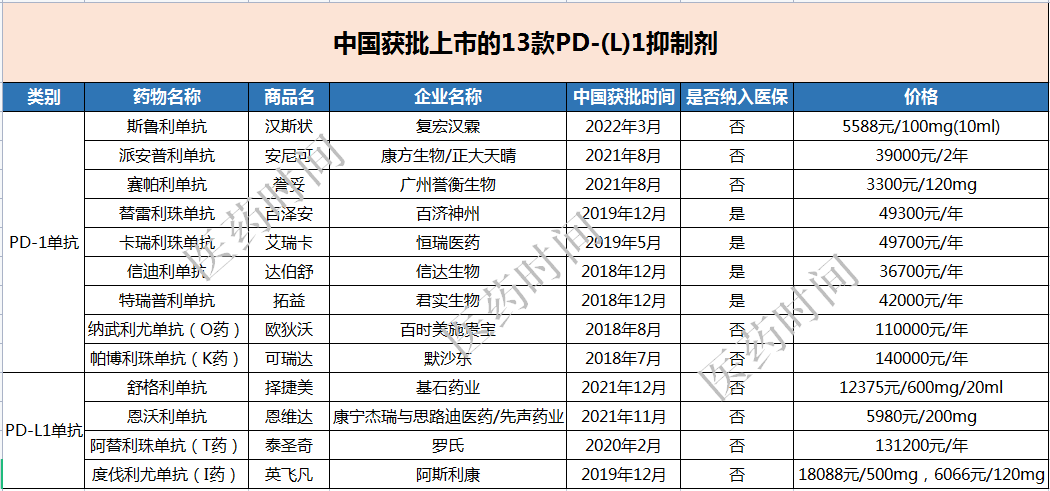
人人都说PD-(L)1是“内卷之王”,但仍然不乏药企前赴后继的进入这条赛道。当前,全球范围内共获批上市19款PD-1/PD-L1药物,其中已在中国获批上市的PD-1/PD-L1药物有13款,PD-1抑制剂9种(7种国产,2种进口),PD-L1抑制剂4种(2种国产,2种进口)。
尽管竞争激烈,但全球市场规模依旧快速增长,已经超过330亿美元。具体来看2021年的销售额,K药仍然一骑绝尘,全球销售额持续走高且增幅也最大,高达171.86亿美元;O药借助新获批适应症,销售额再度回归正增长,销售额达75.23亿美元;此外,T药销售额33.15亿美元,位列第三;I 药销售额24.12亿美元,位列第四。总的来说,进口PD-(L)1销售额总占比超过90%,竞争格局并未发生变动。然而,对于国内产品来说,则是喜忧参半。信迪利珠单抗和替雷利珠单抗实现了正增长,分别达到28亿元和16.58亿元的销售收入,但出海之途尚未破茧。君实生物的特瑞普利单抗大幅缩水,从2021年12亿销售额左右降至了4.12亿元,下滑近60%;而康方生物/正大天晴的派安普利单抗去年8月上市,仅三个月时间,销售额达2.12亿元。恒瑞医药的表现也不乐观,按2021年财报披露的医疗机构实际采购量计大约13亿元。誉衡药业的赛帕利单抗业绩暂未公布,而复宏汉霖的斯鲁利单抗刚刚获批上市,尚未产生销售额。两款PD-L1产品中,恩沃利单抗2021年上市1个月,实现销售收入440万元;另一款舒格利单抗销售业绩尚未公布。截至目前,FDA已经批准了7款PD-(L)1抑制剂上市,批准适应症超过85个,NMPA共批准了13款PD-1/PD-L1产品,涉及12个癌种,45个适应症,目前仍有2000多项临床试验进行中。目前,在中国进入临床阶段的PD-(L)1药品及候选药品有70个。据安信证券研报显示,预计至2022年底,将共计有17款PD-(L)1单抗、1款PD-1/CTLA-4双抗在国内上市,其中国产PD-(L)1共计14款(含双抗)。PD-(L)1赛道无疑已进入“红海”,一场场暗战或将汹涌而至。从价值上来看,各大药企之所以扎堆研发PD-(L)1产品,因为它不仅仅是广谱抗癌药,可以治疗很多种癌症,而且还是免疫疗法的基础药物,可以与多种药物联合使用发挥出1+1>2的潜力。目前已获批上市的13款 PD-(L)1产品的适应症和用药情况盘点,详见下文。
商品名:汉斯状
上市许可持有人:复宏汉霖
斯鲁利单抗于2017年在国内开启首项临床申请,为国产获批上市的第7款PD-1单抗。
2022年3月:批准适应症应为经标准治疗失败后、不可切除、转移性高度微卫星不稳定型(MSI-H)实体瘤患者,也是我国首个针对MSI-H/dMMR晚期实体瘤获批的抗PD-1单抗。赛帕利单抗是国内第一款经过转基因大鼠平台自然选择的全人抗PD-1单抗,也是获批的第6款国产PD-1单抗。2021年8月:获批用于二线及以上复发或难治性经典型霍奇金淋巴瘤(r/r cHL)。近期,CDE官网显示赛帕利单抗治疗复发或转移性宫颈癌的上市申请已获得受理,赛帕利单抗或将改变复发或转移性宫颈癌的治疗格局。派安普利单抗是目前唯一采用免疫球蛋白G1(IgG1)亚型并进行Fc段改造的新型PD-1单克隆抗体,为康方生物和正大天晴共同申报的抗PD-1抗体药物,同时也是国内批准的第5款国产PD-1单抗。2021年8月:获批用于治疗至少经过二线系统化疗复发或难治性经典型霍奇金淋巴瘤(r/r cHL)。替雷利珠单抗的Fc段经过基因工程的改构,其与巨噬细胞Fcγ受体结合时,能够消除抗体依赖的细胞介导的吞噬作用(ADCP效应),从而降低T细胞的耗竭,加强细胞免疫的功能。替雷利珠单抗于2019年底在我国上市,从批准上市至今,已获批八大适应症。2019年12月:获批用于治疗至少经二线系统化疗的经典型霍奇金淋巴瘤(cHL);2020年4月:获批用于治疗PD-L1 高表达的含铂化疗失败 12 个月内进展的局部晚期或转移性尿路上皮癌(UC)患者;2021年1月:获批用于联合化疗用于治疗一线晚期鳞状NSCLC,填补了国内治疗此癌症的空白;2021年6月:获批用于联合化疗治疗一线晚期非鳞状NSCLC,以及治疗既往接受过治疗的不可切除肝细胞癌(HCC)患者;2022年1月:获批用于接受铂类化疗后出现进展的二或三线局部晚期或转移性NSCLC;2022年3月:获批用于既往经治局部晚期不可切除或转移性高度微卫星不稳定型(MSI-H)或错配修复缺陷型(dMMR)实体瘤成人患者。2022年4月:批准用于治疗既往接受过一线标准化疗后进展或不可耐受的局部晚期或转移性食管鳞状细胞癌(ESCC)患者。
卡瑞利珠单抗2019年获批上市,是第三个国产的PD-1抑制剂,至今获批八项适应症,涵盖5大类型恶性肿瘤,为目前获批适应症数量最多、覆盖瘤种最广的国产PD-1产品。2019年5月:获批用于三线治疗复发/难治性霍奇金淋巴瘤(R/R-cHL);2020年3月:获批用于接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期肝细胞癌患者2020年6月:获批用于既往接受过一线化疗后疾病进展或不可耐受的局部晚期或转移性食管鳞癌患者的治疗;2020年6月:获批联合培美曲塞和卡铂用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)的一线治疗;2021年4月:获批用于既往接受过二线及以上化疗后疾病进展或不可耐受的晚期鼻咽癌患者治疗;2021年6月:获批联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗;2021年12月:获批联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌患者的一线治疗。2021年12月:获批联合紫杉醇和卡铂用于局部晚期或转移性鳞状非小细胞肺癌患者的一线治疗。
信迪利单抗于2018年在我国批准上市,是我国第2个国产肿瘤免疫治疗药物。信迪利单抗用于食管鳞癌一线治疗的上市申请和用于胃癌一线治疗的上市申请已获NMPA受理审评。
2018年12月:获批用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗;
2021年2月:获批联合培美曲塞和铂类化疗,用于未经系统治疗的表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的晚期或复发性非鳞状细胞非小细胞肺癌的治疗;
2021年6月:获批联合吉西他滨和铂类化疗,用于不可手术切除的晚期或复发性鳞状细胞非小细胞肺癌的一线治疗;
2021年6月:联合贝伐珠单抗,用于既往未接受过系统治疗的不可切除或转移性肝细胞癌的一线治疗,是全球目前唯一获批肝癌一线适应症的PD-1抑制剂。
特瑞普利单抗是我国批准的首个国产PD-L1单抗,已获批多个适应症,涵盖黑色素瘤、鼻咽癌、尿路上皮癌等多个瘤种,是全球首个获批鼻咽癌治疗的免疫检查点抑制剂,实现了鼻咽癌治疗领域免疫治疗零的突破。2018年12月:批准用于治疗既往标准治疗失败后的局部进展或转移性黑色素瘤;2021年2月:批准用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌(NPC)患者的治疗,成为全球首个获批鼻咽癌治疗的抗PD-1单抗;2021年4月:批准用于治疗既往接受过治疗的局部进展或转移性尿路上皮癌(UC);2021年12月:批准联合顺铂和吉西他滨,用于局部复发或转移性鼻咽癌患者的一线治疗。⑧ 纳武利尤单抗(O药)
商品名:欧狄沃
上市许可持有人:百时美施贵宝
2018年,纳武利尤单抗在我国获批上市,是我国第一个免疫治疗药物。
2018年6月:批准用于二线用药治疗驱动基因阴性、既往接受过含铂方案化疗后疾病进展或不可耐受的局部晚期或转移性NSCLC;
2019年10月:批准用于含铂类方案治疗期间或之后出现疾病进展且肿瘤PD-L1阳性的复发性或转移性头颈鳞癌(SCCHN);
2020年3月:批准用于既往接受过两种或两种以上全身性治疗方案的晚期或复发性胃或胃食管连接部腺癌患者;
2021年6月:批准O药(纳武利尤单抗 )和Y 药(伊匹木单抗 )联合,用于一线不可手术切除的非上皮样、恶性胸膜间皮瘤成人患者治疗;
2021年8月:批准联合含氟尿嘧啶和铂类药物化疗,用于一线治疗晚期或转移性胃癌、胃食管连接部癌或食管腺癌患者。
⑨ 帕博利珠单抗(K药)
商品名:可瑞达
上市许可持有人:默沙东
K药为免疫治疗领域与O药并肩的元老级药物,于2018年批准在中国上市,目前已经获批5大癌种,8大适应症。
2018年7月:批准用于经一线治疗失败的不可切除或转移性黑色素瘤;
2019年:批准联合培美曲塞、顺铂用于一线治疗EGFR和ALK阴性的转移性非鳞状NSCLC;
2019年:批准联合卡铂、紫杉醇或白蛋白紫杉醇用于一线治疗鳞状NSCLC;
2019年:批准单药一线治疗PD-L1表达阳性(TPS≥1%)的EGFR阴性、ALK阴性的局部晚期或转移性NSCLC;
2020年6月:批准用于治疗PD-L1阳性(CPS≥10)、既往一线全身治疗失败的局部晚期或转移性食管鳞癌(ESCC);2020年12月:批准用于PD-L1(CPS≥20)的转移性或不可切除的复发性头颈部鳞状细胞癌(HNSCC)患者的一线单药治疗;2021年6月:获批用于KRAS、NRAS和BRAF基因均为野生型的,转移性或不可切除MSI-H/dMMR结直肠癌的一线治疗;2021年9月:获批联合铂类和氟尿嘧啶类化疗药物用于局部晚期不可切除或转移性食管或胃食管结合部癌患者的一线治疗。舒格利单抗是国产第2款、国内获批的第4款PD-L1单抗。舒格利单抗为重组抗PD-L1全人源单克隆抗体,可阻断PD-L1与T细胞上PD-1和免疫细胞上CD80间的相互作用,通过消除PD-L1对细胞毒性T细胞的免疫抑制作用,发挥抗肿瘤作用。2021年12月:获批用于联合培美曲塞和卡铂用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非非小细胞肺癌(NSCLC)患者的一线治疗,以及联合紫杉醇和卡铂用于转移性鳞状非小细胞肺癌患者的一线治疗。恩沃利单抗是我国首款自主研发的PD-L1抗体,是我国乃至世界首个可皮下注射的PD-L1药物,可达到30秒快速完成给药。2021年11月:用于标准治疗失败的MSI-H/dMMR晚期结直肠癌、胃癌及其他实体瘤。阿替利珠单抗是一种人源化靶向程序性死亡配体1(PD-L1)的IgG1单克隆抗体,可与PD-L1结合,并允许PD-L1与其他配体(PD-L2)结合,而PD-L2可以在预防严重的免疫不良反应事件中起到重要作用。2020年2月:获批联合化疗用于广泛期小细胞肺癌的一线治疗;
2020年10月:获批用于治疗既往未接受过系统治疗的不可切除肝细胞癌(HCC)患者;
2021年6月:获批联合培美曲塞和铂类化疗用于无 EGFR 突变和无 ALK 突变的转移性非鳞非小细胞肺癌(NSCLC)患者的一线治疗;2022年3月:获批单药用于检测评估为≥1%肿瘤细胞(TC)PD-L1染色阳性、经手术切除、以铂类为基础化疗之后的II-IIIA期非小细胞肺癌(NSCLC)患者的辅助治疗,此次新适应症的获批令人振奋,意味着更多患者有了减少疾病复发及实现更长生存的希望。度伐利尤单抗为人源化的抗PD-L1单克隆抗体,能够阻断PD-L1跟PD-1和CD80的结合,从而阻断肿瘤免疫逃逸并释放被抑制的免疫反应。2019年12月:获批用于放化疗后未进展的不可切除、III期非小细胞肺癌的巩固治疗;2021年7月:获批用于联合依托泊苷和卡铂或顺铂,作为广泛期小细胞肺癌(ES-SCLC)成人患者的一线治疗方案。版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)