胰腺导管腺癌(PDAC)发病率不断上升,5年总生存率一直较低,亟待新的系统治疗手段的出现。免疫治疗在实体肿瘤中显示出良好的优势,但迄今为止,免疫治疗,在PDAC的应用一直令人失望。已有几项有希望的临床前研究,但将其转化为临床研究仍然具有较大挑战性。这可能与PDAC复杂的免疫抑制肿瘤微环境的密切相关。在此文献中,研究团队总结了PDAC肿瘤微环境中的免疫抑制机制,并归纳了已完成和正在进行的各种免疫治疗临床试验。
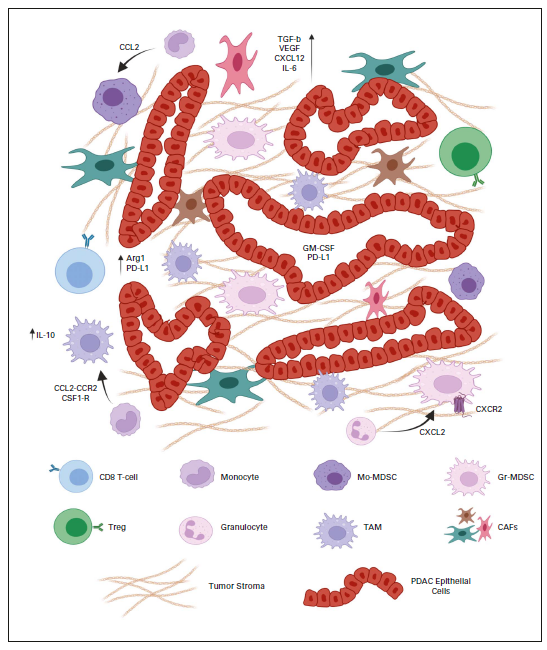
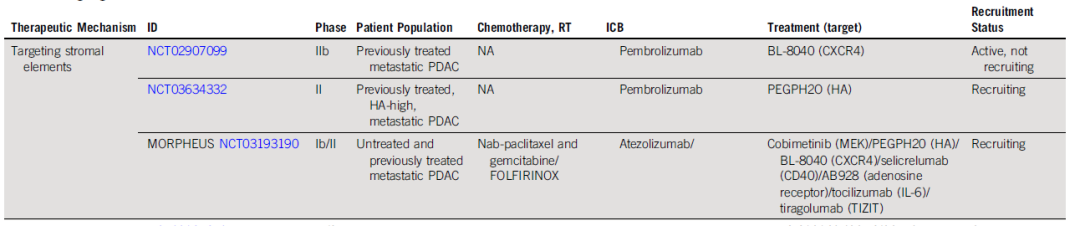
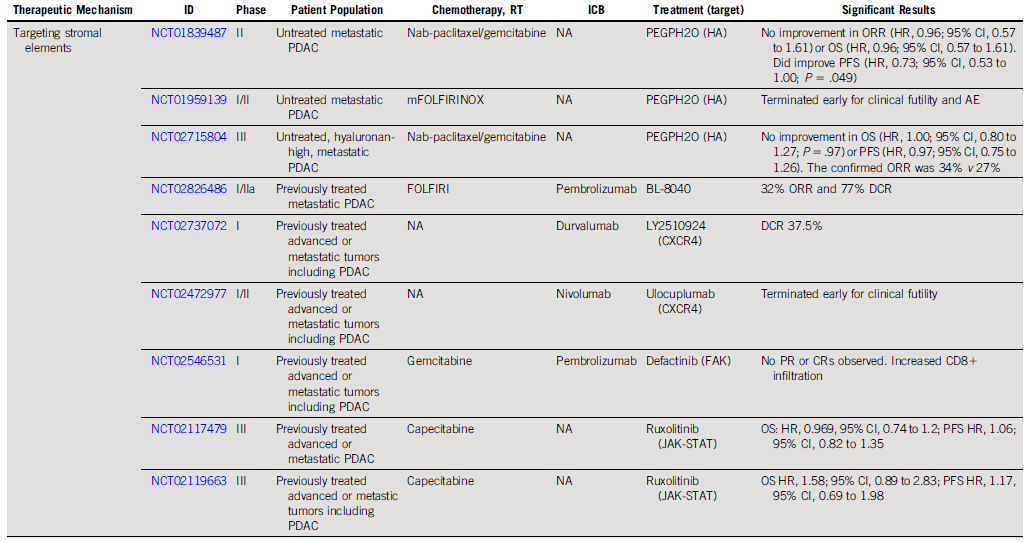
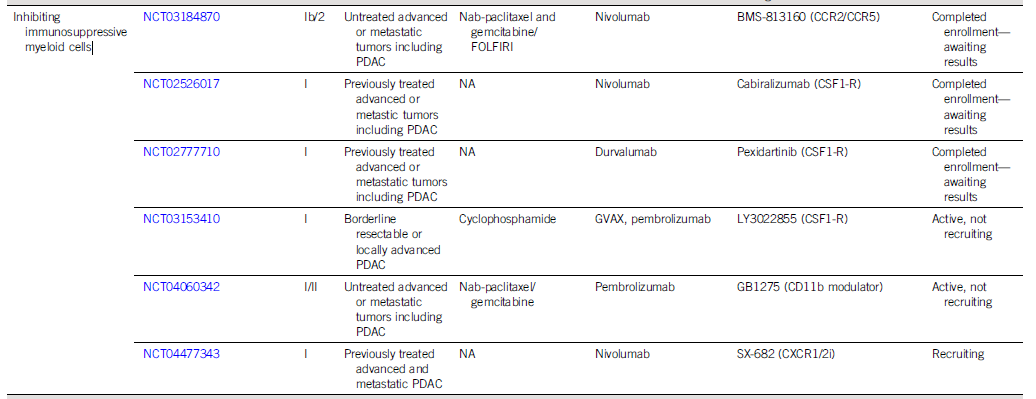
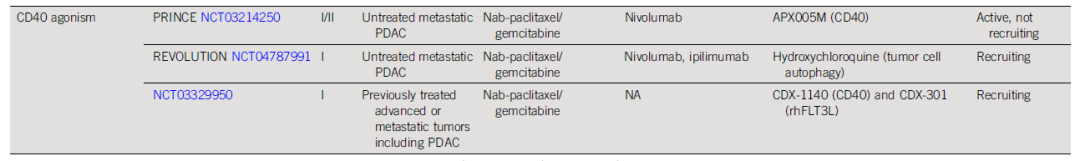
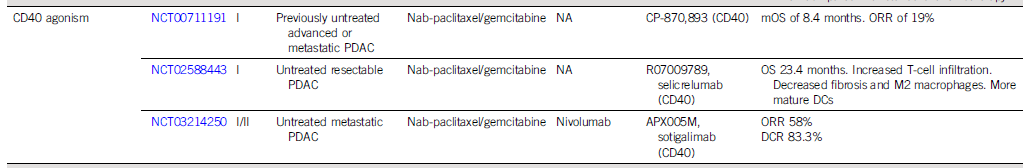
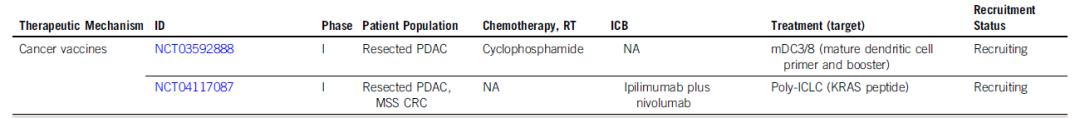
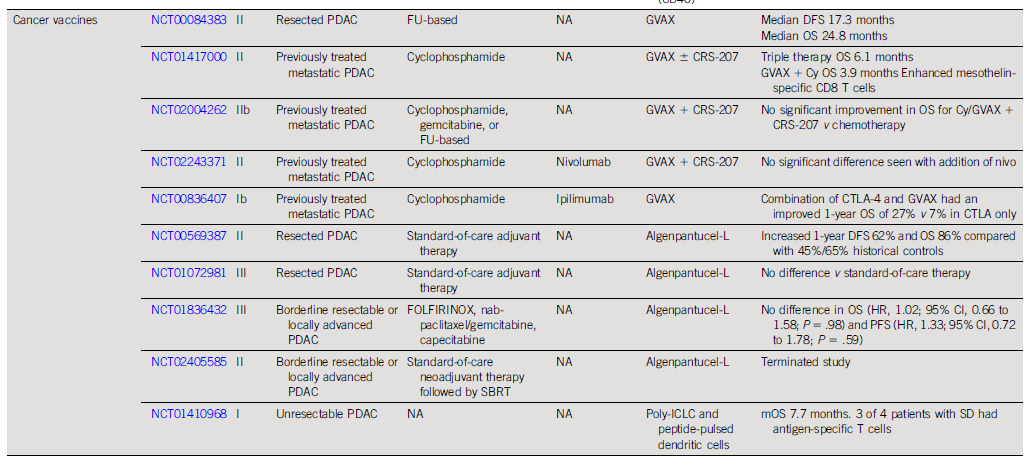
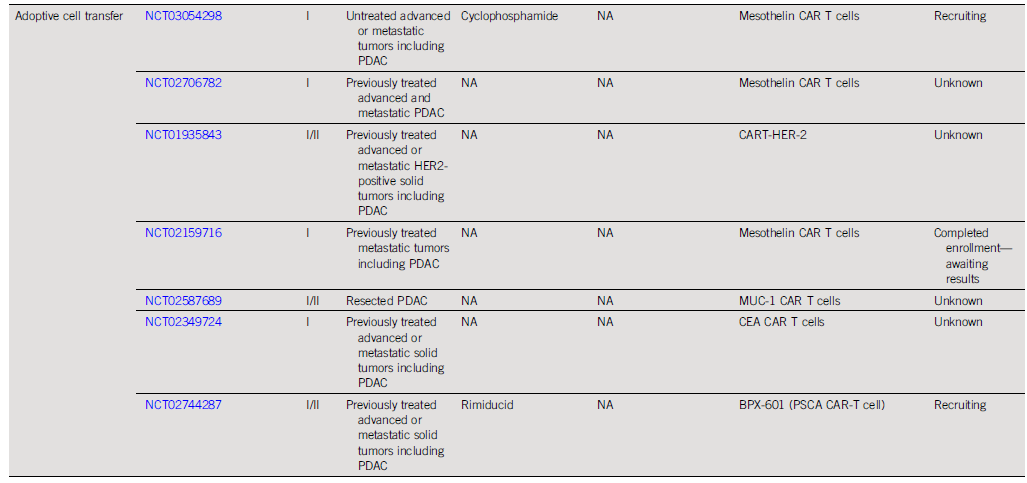
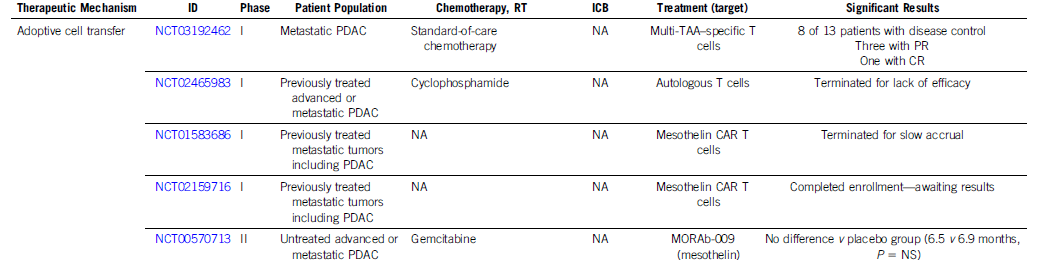
预计到2030年,胰腺导管腺癌(PDAC)将成为癌症相关死亡率的第二大原因。胰腺癌常规全身治疗进展不大,5年总生存率仍然低达11%,部分原因是就诊患者确诊时即处于晚期,无法进行根治性切除。即使切除的患者,复发率也很高,严重影响胰腺癌患者5年生存率的提高。传统的以氟尿嘧啶或吉西他滨为基础的化疗,加或不加放疗,是无法切除胰腺癌患者的标准治疗方法;然而,开发更有效的系统疗法,仍然是一个尚未满足的重要临床需求。免疫治疗的进展,特别是免疫检查点阻断(ICB),已经改写了一些既往化疗难治性恶性肿瘤的治疗标准。在过去10年中,ICB对转移性黑色素瘤、肾细胞癌、微卫星不稳定的结直肠癌、非小细胞肺癌、霍奇金淋巴瘤和各种其他癌症都有疗效。尽管ICB在部分实体瘤领域已经取得了一些成功,但ICB单一疗法对PDAC的治疗,很大程度上,不起作用:PD-1抗体单药治疗、PD-1抗体联合CTLA-4抗体疗法,总有效率(ORR)分别为0.10%-12%和3%。PDAC领域令人失望的结果与ICB在其他实体肿瘤中的显著有效性形成鲜明对比,也促进了有关基础机制的研究探索。PDAC具有几种固有特性,可阻碍有效的免疫治疗反应(图1)。一般来说,肿瘤特异性抗原(TSA)仅在恶性细胞上表达,因此,抗肿瘤T细胞的毒杀作用具有一定的特异识别性,且抗原强度与抗肿瘤免疫反应水平正相关。手术切除标本的回顾性数据表明,在少数肿瘤患者中,同时表现出高水平TSA和CD8+ T细胞浸润的患者中,生存优势明显。尽管存在这种关联性,但CD8+ T细胞显示干扰素-γ和其他激活标记物减少,表明其他免疫抑制因素在起作用。PDAC的癌基因及其下游途径有助于免疫抑制性TME的形成。92%的胰腺癌中发现了导致结构性激活的突变KRAS,并与多种下游效应途径相关,包括粒细胞-巨噬细胞结肠刺激因子(GM-CSF)的产生,导致免疫抑制髓样细胞(MDSC)的募集;纤维炎性基质的促进、形成和维持;PD-L1表达上调;CD73表达增加导致免疫抑制细胞外腺苷升高;MHC-1的下调和Treg的增加;免疫抑制Th17和γδT细胞的诱导生成。除了免疫抑制癌基因外,PDAC细胞具有损害抗原呈递的和细胞毒性淋巴细胞(CTL)功能多种机制。PDAC细胞通过自噬依赖性机制选择性靶向MHC-1分子,从而实现溶酶体降解。临床前研究表明,羟基氯喹对自噬的抑制导致肿瘤生长速度的减缓,并与双ICB方案,具有协同增强抗肿瘤作用。此外,PDAC细胞含有高比例的CD47,可阻止吞噬作用以及APC的抗原呈递。抗CD47抗体介导的巨噬细胞吞噬癌细胞作用,能导致初始CD8+ T细胞的数量增加和免疫抑制性Treg的数量减少。PDAC细胞还产生吲哚胺2,3-双加氧酶(IDO),以催化色氨酸的降解,色氨酸是细胞毒性T细胞存活和激活的必要成分,从而诱导T细胞凋亡和失能。此外,PDAC细胞下调人类白细胞抗原DR同种型和CD40的表达,从而导致未成熟树突状细胞(DC)直接抑制效应CD8+ T细胞。总的来说,PDAC固有的免疫抑制特性,通过多种途径破坏正常宿主免疫反应的机制,针对这种肿瘤类型的免疫治疗药物的开发,是极具挑战性的。虽然PDAC细胞具有导致免疫逃避的固有特性,但它们与周围TME的相互作用对有效的免疫治疗药物构成了更大、更复杂的障碍(图2)。PDAC的组织学特征表明,PDAC具有强促结缔组织增生的微环境。胰腺星状细胞(PSCs;活化的PSC被称为癌症相关成纤维细胞[CAF])产生这种纤维化环境,并表现出促进肿瘤发生和消除抗肿瘤免疫的多种因素。治疗胰腺癌,目前已出现多种免疫治疗策略,包括特异及非特异性免疫治疗、肿瘤疫苗、过继性免疫细胞疗法以及肿瘤因子治疗等。靶向促结缔组织增生PDAC基质的部分成分,不同的试验结果不一。尽管使用聚乙二醇透明质酸酶(PEGPH20)酶降解HA在临床前取得了成功,但在HA高PDAC患者的三期HALO 109-301试验中评估了其添加到吉西他滨/nab紫杉醇中的情况,结果表明ORR略有增加,分别为47%和36%(ORR比,1.29[95%CI,1.03至1.63]),但OS(风险比)没有变化。HA靶向治疗令人失望的结果导致PEGPH2O与其他免疫疗法联合试验正在进行中。PDAC微环境支持肿瘤生长,促进转移,并构成药物传递的物理屏障。对于ICB单药治疗不敏感,联合疗法在增强免疫反应以达到更好的治疗效果方面有着巨大的前景。除了靶向TME的免疫抑制成分外,也可以尝试增强适应性免疫系统的细胞毒性能力。CD8+T细胞同时表达共抑制和共刺激受体,针对这些共刺激受体的激动性抗体,即抗CD40,在PDAC中显示出前景。疫苗治疗是一种经典的免疫疗法,大多数肿瘤疫苗也是如同预防传染病的疫苗一样,通过接种疫苗刺激宿主免疫系统产生体液、细胞免疫反应,胰腺癌的疫苗治疗也不例外。现阶段治疗胰腺癌的疫苗中,临床应用较多的有肿瘤细胞疫苗及GVAX瘤苗。PDAC发病率的上升和持续5年的令人沮丧的OS试验结果,凸显了对新的有效系统治疗的需要。免疫治疗在诸多实体肿瘤中显示出显著的优势,但在PDAC的治疗中迄今为止一直令人失望。已有几项有希望的临床前研究,但将其转化为临床研究具有挑战性。这与PDAC固有的免疫抑制特性和TME的复杂性紧密相关。值得肯定的是,许多正在进行的临床试验正在评估组合疗法的可行性。我们相信,通过临床医生、科学家以及最重要的患者参与的多学科方法,免疫治疗将在未来的PDAC治疗中发挥关键作用。J Clin Oncol.2022 Jul 15;JCO2102616. doi: 10.1200/JCO.21.02616. 版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。







发表评论
注册或登后即可发表评论
登录注册
全部评论(0)