摘要:新冠疫苗作为防控疫情的重要手段,已在世界范围内广泛推广。常规疫苗开发可能需要15年以上,但新冠疫苗在创纪录的时间内获得批准。有研究称,多种新冠疫苗均能导致带状疱疹、荨麻疹和瘙痒等皮肤不良反应。最近,多个科研团队对海外接种科兴疫苗、辉瑞BNT162b2、Moderna mRNA-1273、牛津阿斯利康AZD1222新冠疫苗的皮肤不良反应进行了报道。
2022年7月2日,土耳其伊斯坦布尔医学大学研究团队在Journal of Cosmetic
Dermatology(JCD)发表题为“Cutaneous
reactions after COVID-19 vaccination in Turkey: A multicenter study”的研究结果(图1)[1]。研究发现在91.6%接种科兴疫苗(CoronaVac)的人群中,接种第一针和第二针后分别有2.9%、3.5%的人群出现荨麻疹/血管性水肿、玫瑰糠疹、带状疱疹和斑丘疹等皮肤反应;8%接种辉瑞/BioNTech的mRNA疫苗(BNT162b2)的人群中,接种第一针和第二针后分别有24.8%、5%的人群出现带状疱疹、玫瑰糠疹和荨麻疹/血管性水肿;2.1%接种CoronaVac和8.2%接种BioNTech的人群引发了自身免疫性疾病。

CoronaVac是土耳其预防新冠肺炎的首选疫苗,自2021年1月13日起进行全国接种。BNT162b2作为候选疫苗,自2021年4月2日起实施全国接种。BNT162b2的皮肤不良反应已在国际范围内进行研究,但CoronaVac的皮肤不良反应缺乏报道。因此,研究人员针对在土耳其境内接种CoronaVac和BNT162b2导致的皮肤不良反应进行了分析。
这是一项前瞻性、横断面研究,囊括了2021年4月15日至7月15日期间2290人接种新冠疫苗后到土耳其19个医疗中心的皮肤科或急诊就诊的个人数据。2290人中的2097人(91.6%)接种了CoronaVac,183人(8%)接种了BNT162b2。研究人员分析了疫苗接种后患者的全身性、局部注射部位和非局部皮肤反应,并确定了各自发生率(表1)。
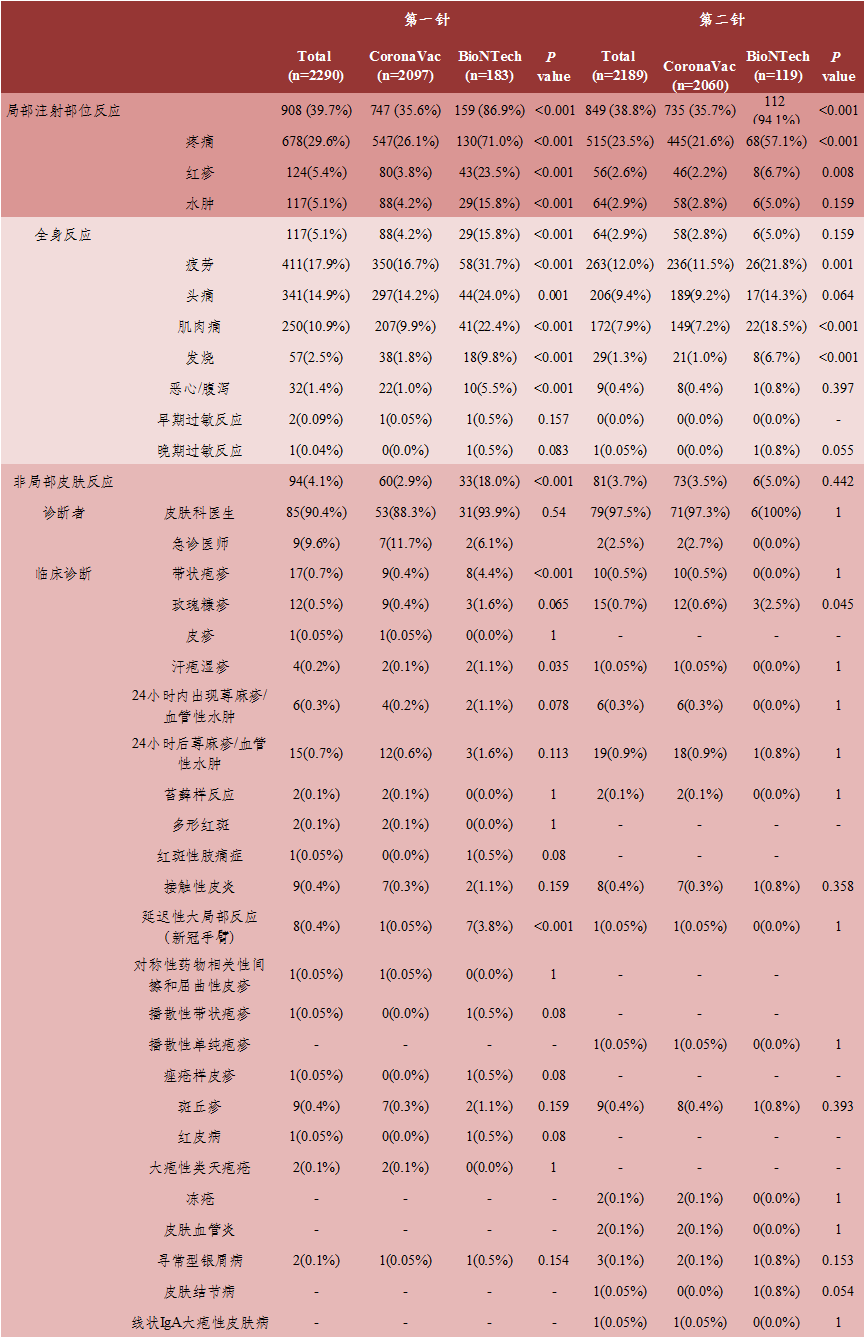
1 局部反应发生率:BNT162b2高于CoronaVac
接种一剂疫苗时,CoronaVac有35.6%的参与者存在至少一种局部注射部位反应,BNT162b2有86.9%的参与者存在至少一种局部注射部位反应;接种两剂疫苗时,CoronaVac有35.7%的参与者存在至少一种局部注射部位反应,BNT162b2有94.1%的参与者存在至少一种局部注射部位反应。
2 非局部皮肤反应发生率:BNT162b2高于CoronaVac
参与者接种CoronaVac后,共出现133例非局部皮肤反应:第一剂出现60例(2.9%),第二剂出现73例(3.5%)。最常见的皮肤反应是荨麻疹/血管性水肿(16,0.8%;24,1.2%)、玫瑰糠疹(9,0.4%;12,0.6%)、带状疱疹(9,0.4%;10,0.5%)、黄斑丘疹(7,0.3%;8,0.3%)、接触性皮炎(7,0.3%;7,0.3%);参与者接种BNT162b2后,共出现39例非局部皮肤反应:第一剂出现33例(4.8%),第二剂出现6例(5%)。最常见的皮肤反应是带状疱疹(8,4.4%)、延迟大局部反应(7,3.8%)、玫瑰糠疹(3,1.6%;3,2.5%)、荨麻疹/血管性水肿(5,2.7%;1,0.8%)。
3 皮肤过敏反应发生率:BNT162b2和CoronaVac差异不显著
当分别比较第一剂和第二剂接种时,BNT162b2和CoronaVac导致的过敏反应未呈现统计学上的显著差异;BNT162b2的疲劳、头痛、肌痛、两次给药后的发烧以及仅第一次给药后的恶心/腹泻在统计学上显著升高;当不考虑剂量比较二者早晚过敏反应发生率时,CoronaVac为0.05%,BNT162b2为1.6%,具有统计学意义;无论剂量如何,二者对早期过敏反应的发展没有显著差异,对晚期过敏反应的发展方面存在统计学差异;对于BNT162b2,第一剂和第二剂之间的全身反应率没有统计学上的显著差异;与第二剂相比,第一剂CoronaVac和BNT162b2疫苗接种后局部注射部位反应的发生率显著高于第二剂。
4 24小时内皮肤严重反应发生率:CoronaVac为0.5%,BNT162b2为2.72%
非局部皮肤反应发生时间:CoronaVac,第一剂为6.2±4.3天,第二剂为7.6±6天;BNT162b2第一剂为7.2±5.8天,第二剂为8.8±5.5天。接种第一剂,CoronaVac最早出现的非局部皮肤反应是瘀点皮疹、多汗性湿疹和荨麻疹/血管性水肿,BNT162b2为斑丘疹、红皮病和荨麻疹/血管性水肿;在24小时内出现的荨麻疹/血管性水肿病例中,有6例发生在第一剂接种后(CoronaVac有4例,BNT162b2有2例),6例发生在第二剂接种后(均为CoronaVac);接种24小时内严重反应(例如过敏反应和荨麻疹/血管性水肿)发生率:CoronaVac为0.5%,BNT162b2为2.72%。
5 自身免疫性疾病的发生率:CoronaVac为2.1%,BNT162b2为8.2%
预先存在的自身免疫性疾病发生率方面,CoronaVac为2.1%,BNT162b215为8.2%;接种CoronaVac后引发死亡最常见疾病是慢性荨麻疹(15,0.7%)和寻常型银屑病(13,0.6%),BNT162b215是寻常型银屑病(8,4.4%)和慢性荨麻疹(4,2.2%)。6 个体差异导致皮肤不良反应:CoronaVac显著升高,BNT162b2无影响
接种CoronaVac的女性、年龄小于55岁的患者、没有合并症的患者和有过敏性疾病史的患者的全身反应在统计学上显著升高;接种BNT162b215的参与者没有发现与任何可能的风险因素有关的显著差异。
此项研究确定了新冠疫苗不良反应发生率,并从药物治疗的预期中确定了其特征,揭示了个体特征之间的关系,例如年龄、性别和合并症以及不良反应。这将有助于临床医生更清楚地告知患者接种疫苗后发生不良反应的可能性。CoronaVac比BNT162b215产生的反应轻微,但仍会导致带状疱疹、过敏反应和引发自身免疫。大多数反应是自限性的,需要很少或不需要治疗干预即可恢复。
本研究有一定的局限性。土耳其新冠疫苗接种始于CoronaVac,并首先提供给医疗人员和老年人;由于数据收集期很短,而且在研究期间,参与者刚刚接种BNT162b215,因此对其研究结果有限;文献报道过许多关于疫苗接种后毛发受累的病例报告和研究,但此项研究侧重于皮肤反应,因此未单独检查疫苗接种后的毛发受累情况。
2022年1月,西班牙研究团队在British Journal of Dermatology(BJD)发表题为“Cutaneous
reactions after SARS-CoV-2 vaccination: a cross-sectional Spanish nationwide
study of 405 cases”的研究成果(图2)[2]。研究发现,接种BNT162b2、mRNA-1273和AZD1222疫苗造成的皮肤不良反应主要为延迟性大局部反应(32.1%,称为新冠手臂)、荨麻疹(14.6%)、水痘带状疱疹和单纯疱疹病毒再激活(13.8%)、麻疹(8.9%)、丘疹(6.4%)、玫瑰糠疹(4.9%)和紫癜(4%);患者平均年龄为50.7岁,80.2%为女性。

这是一项西班牙全国性的横断面研究。研究纳入了2021年2月16日至5月15日期间31家公立医院和私人诊所的新冠疫苗接种后21天内出现皮肤反应的419位患者的数据。14例不符合纳入标准和/或缺少数据的病例被排除在外。最终样本包括BNT162b2(n=163,40.2%)、mRNA-1273(n=147,36.3%)和AZD1222(n=95,23.5%)(图3)。研究人员通过与皮肤科医生进行面对面访问,在线专业调查收集患者皮肤反应信息,电子邮件收集患者临床照片分析研究结果。
所有患者均为白人,平均年龄为50.7岁,80.2%为女性。接受BNT162b2(49,30.1%)疫苗的男性皮肤不良反应比mRNA-1273(14,9.5%)和AZD1222(17,17.9%)多。几乎所有对Moderna疫苗有皮肤不良反应的患者都是女性(90.5%)。
无法评估重组蛋白疫苗AZD1222,因为在研究期间参与者未接种第二剂疫苗。皮肤不良反应在mRNA疫苗第一次接种后出现165例(53.2%),第二次接种后出现145例(46.8%)。14(14/165,8.5%)名出现首剂反应的患者在mRNA疫苗接种后发生了二剂反应,其中7人有相同反应,7人有不同反应。
3 皮肤不良反应主要有六种方式,新冠手臂和荨麻疹/血管水肿占68.4%
疫苗接种带来的皮肤不良反应有六种主要的临床形态学方式:(I)新冠手臂(130,32.1%,接种后≥4天时,注射部位出现红斑或肿胀斑块,其中53.8%延迟出现);(II)荨麻疹/血管性水肿(59,14.6%,主要分布在躯干或全身分布,93.2%在接种疫苗后24小时以上出现);(III)麻疹样(36,8.9%,一种类似于麻疹的红斑斑丘疹,主要累及躯干和四肢);(IV)丘疹水泡或假水泡(26,6.4%,周围有红斑的小丘疹/水泡,无疱疹状排列);(V)玫瑰糠疹样(20,4.9%,树干上呈“圣诞树”分布的红斑、有鳞的椭圆形斑块);(VI)紫癜性皮疹(16,4%,主要位于四肢)(图4)。
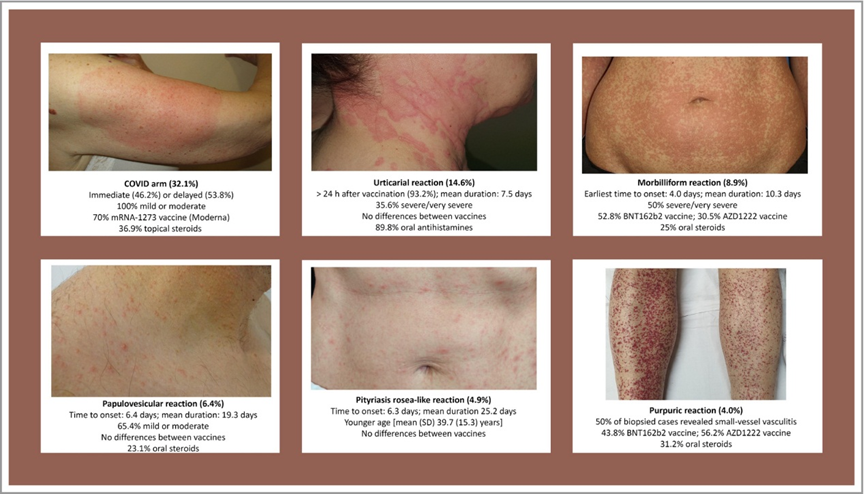
未包括在该分类中的皮肤不良反应被分组为:(I)潜在的预先存在的皮肤感染或病症的发作/重新激活(水痘带状疱疹和单纯疱疹病毒再激活(13.8%))、牛皮癣、扁平苔藓;(II)新发疾病(31,7.6%);(III)不可分类(22,5.4%)。
4 带状疱疹病毒再激活导致严重病例,其中81%需要进行治疗
严重/非常严重病例报告中,BNT162b2占27.6%,AZD1222占26.3%,主要为带状疱疹和荨麻疹,328例(81%)需要治疗。
新冠疫苗接种后的皮肤反应因人而异。尽管报告了严重/非常严重的反应,但大多数是轻度至中度和自限性的。了解大规模疫苗接种期间的这些反应可能有助于医疗人员为患者提供有效建议。该研究具有局限性。首先该设计不允许因果关联、风险或发生率的测量。研究无法按疫苗类型比较皮肤反应的发生率或严重程度,因为疫苗的分布取决于研究期间的可用性;其次,数据收集周期短,可能会限制对综合数据的研究,特别是在第二剂和AZD1222疫苗接种后;第三,只有12.3%的病例进行了活检,而组织病理学可能防止了错误分类;第四,对先前报告的或更严重的反应可能存在报告偏差;第五,不能排除接种疫苗后感染新冠是皮肤反应的可能原因。[1]Cebeci Kahraman F, Savaş Erdoğan S, Aktaş ND, et al. Cutaneous reactions after COVID-19 vaccination in Turkey: A multicenter study. J Cosmet Dermatol. 2022 Jul 2. doi: 10.1111/jocd.15209. Epub ahead of print. PMID: 35780311.[2]Català A, Muñoz-Santos C, Galván-Casas C, et al. Cutaneous reactions after SARS-CoV-2 vaccination: a cross-sectional Spanish nationwide study of 405 cases. Br J Dermatol. 2022 Jan;186(1):142-152. doi: 10.1111/bjd.20639. Epub 2021 Sep 21. PMID: 34254291; PMCID: PMC8444756. 版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。










发表评论
注册或登后即可发表评论
登录注册
全部评论(0)