随着高危人群的增加,侵袭性真菌感染继续增加。真菌疾病的高发病率和死亡率要求继续研究新型抗真菌药物和包括替代生物标记物在内的诊断策略。疾病的生物标志物是临床中有用的预后指标,使用它们代替传统的生存终点,可以更快地进行需要更少参与者的临床试验,降低试验费用,并限制对长期随访的需求。许多真菌生物标志物已经开发出来,并在前瞻性临床试验和小规模的系列中进行了广泛评估。我们在本综述中研究了这些替代生物标记物的证据,并为临床医生和监管机构提供了建议。
隐球菌病
隐球菌病的替代生物标志物可用于诊断、预后和治疗决策。标准诊断方法是印度墨水显微镜、隐球菌抗原(CrAg)和培养。培养和显微镜技术可追溯到1894年,至今仍在使用。用于胶囊可视化的印度墨水测试可在离心脑脊液(CSF)中检测到约103个CFU酵母/毫升,对HIV感染患者和非HIV隐球菌脑膜炎的敏感性分别为约60%-80%和约50%。脑脊液显微镜定量酵母计数的变化与定量培养的变化相关性很差,不能用作替代标记。
隐球菌抗原(CrAg)
使用乳胶凝集、酶免疫分析(EIA)或侧流分析(LFAs)的隐球菌抗原检测已被纳入临床实践,在脑脊液、血清、血浆和全血中的敏感性和特异性超过95%。IMMY(Norman,OK,USA)的CrAg LFA具有当前任何即时检测中最好的诊断性能,可检测新生隐球菌和隐球菌格蒂变种,但无法区分。在国际上,其他非食品和药物管理局(FDA)批准的CrAg LFA的诊断性能明显较差。血清或血浆CrAg LFA对检测HIV感染的脑膜炎患者的敏感性大于99.9%,然而,如果存在中枢神经系统症状,尽管血清检测阴性,CSF评估应继续进行。假阴性试验在CrAg乳胶凝集和HIV阴性人群中更为常见,其中约20%的人在播散性疾病的血清中可能有假阴性CrAg。由于通过连续稀释,CrAg滴度>1:100万时的前区效应可能导致CrAg LFA出现假阴性;但是,已经开发出一种新的半定量CrAg LFA,消除了前区。半定量CrAg滴度的能力提供了预后信息,因为高滴度与高疾病负担相关,并预测不良预后。可是,治疗后CSF滴度或血清CrAg滴度的连续变化与抗真菌活性、CSF定量培养的变化或生存率无关;因此,纵向CrAg滴度变化不是一个有用的替代生物标志物。
早期抗真菌的活性
连续CSF定量培养的隐球菌酵母清除率斜率,称为早期抗真菌活性(EFA),目前是临床试验中常用的工具,可作为抗真菌活性的直接标记和死亡率的替代标记。2020年,对接受相同背景诱导方案的两性霉素B脱氧胆酸盐和氟康唑的3个序贯试验的738名隐球菌性脑膜炎患者进行荟萃分析,与EFA>0.20的患者相比,EFA<0.20 log10 CFU/mL/d的患者18周死亡率增加(图1)。

图1:脑脊液隐球菌酵母菌清除率EFA与死亡率的关系。乌干达接受两性霉素B联合治疗时,EFA<0.20 log10 CFU/mL CSF/d的患者死亡率增加。超过这一EFA阈值可能是第二阶段试验的目标。经Pullen等人许可复制。缩写:CFU,菌落形成单位;CSF,脑脊液;EFA,早期抗真菌活性。
此外,EFA与HIV相关隐球菌性脑膜炎死亡率的关联是建立在先前单独的前瞻性研究基础上的。Bicanic及其同事使用了来自4项HIV相关隐球菌脑膜炎患者试验的汇总数据,这些患者接受两性霉素B联合疗法或氟康唑单药疗法诱导,发现清除率较慢与10周死亡率相关。存活10周以上的患者的平均EFA为0.41 log10 CFU/mL/d,而死亡患者的平均EFA为0.27 log10 CFU/mL/d。2016年对27项试验(包括2854名受试者)进行的系统回顾(采用不同的统计技术测量EFA)也发现平均EFA与10周生存率之间存在关联,尽管该分析排除了EFA较差的劣质方案,如氟康唑单药治疗。虽然隐球菌性脑膜炎的死亡率有很多影响因素,但EFA是人类抗真菌活性和全因死亡率的有效替代标志物,尤其是当EFA<0.20 log10 CFU/mL/d时。由于隐球菌定量培养需要3-7天才能在标准真菌培养基上生长,EFA是一种延迟指标,不能实时用于临床决策。定量脑脊液培养方法已经发表并交叉验证。
其他潜在的生物标志物
对于隐球菌性脑膜炎的其他替代标记物,数据不足。两个CSF(1,3) -β-D-葡聚糖(BDG)和薄膜阵列聚合酶链反应(PCR)检测(BioFire,Salt Lake City,UT,USA)是隐球菌病的潜在诊断标志物,但与CrAg相比,两者在诊断上都不理想。抗真菌治疗期间,脑脊液BDG的快速衰减和新生隐球菌DNA的PCR周期阈值(Ct)值的变化使这些有趣的潜在替代生物标记物成为可能。
隐球菌病替代生物标志物的总结与建议
CrAg是一种公认的诊断性生物标记物,比培养物更敏感。CrAg LFA最敏感。CrAg优于BDG或PCR检测用于诊断,但连续CSF CrAg滴度不应用于监测治疗反应。连续定量脑脊液培养(EFA)中隐球菌的脑脊液清除率是抗真菌活性的直接标志物和死亡率的替代生物标志物,目前常用于隐球菌脑膜炎临床试验中评估新的抗真菌策略(表1)。
表1 真菌生物标志物及其在诊断、预后或作为临床试验替代终点中的应用总结(替代终点,在特定疾病及特定研究干预下,可预测金标准终点(OS)临床获益情况的其他终点)

侵袭性念珠菌病
侵袭性念珠菌病包括念珠菌属(念珠菌血症)的血流感染,可并发血液播散引起的终末器官感染,以及器官或粘膜下组织的非念珠菌感染。血培养分析是鉴定念珠菌血症的金标准和最常见的方法。非侵袭性念珠菌病(深层念珠菌病)通常通过活组织检查或抽吸相关组织获得样品的培养,染色和/或组织病理学来诊断。较新的技术和商业上可用的方法已经开发出来,用于比培养物观察到的延迟更快的诊断。
基于培养的系统的平均检测时间为14至38小时,并且取决于所使用的培养条件(大多数念珠菌属在需氧瓶中比在厌氧瓶中生长更快)、念珠菌属种类和每毫升样品中循环酵母菌的数量而变化。此外,存在自动血培养方法的灵敏度、可靠性和及时性的限制。这些测定的灵敏度随着接种量降低而降低(1000个酵母细胞/瓶的灵敏度为79%,100个酵母细胞/瓶的灵敏度为73%,10个酵母细胞/瓶的灵敏度为70%)。白色念珠菌的平均检测时间为20-30小时,具体取决于瓶子类型和接种量。非白色念珠菌如光滑念珠菌可能需要相当长的时间才能生长(约80小时)。
通过使用基于培养的分子诊断分析,临床医生现在能够缩短鉴定微生物的时间,并改善抗菌药物的选择和患者预后。例如,基质辅助激光解吸/电离质谱(MALDI-TOF MS)是基于不同微生物特有的特征质谱指纹。这项技术要求评估前在固体培养基上生长生物体。其他最近开发的直接对阳性血培养样本进行的快速诊断包括直接从血培养中获得的Biofire Direct、GenMark酵母ID、Accelerate Pheno和PNA Fish。FilmArray血液培养鉴定试剂盒是一种能够辨识24种不同病原体(美国犹他州盐湖城BioFire Diagnostics)的复合分析方法,可在约1小时内提供结果,报告的灵敏度为96%-100%,特异性为88%-100%。
尽管检测性能、成本和效用仍存在不确定性,但培养技术的局限性刺激了侵袭性念珠菌病非培养诊断试验的发展。传统的以培养为基础的方法可能不如新方法敏感,从而导致错误的解读,即新方法不如传统的“金标准”更不具特异性,尽管检测到更多真实的阳性结果(表2)。3种非培养诊断试验的数据最可靠:(1→3) -β-D-葡聚糖、念珠菌聚合酶链反应(PCR)和血液样本的T2Candida分析。非培养诊断测试指导患者管理策略尚未在临床试验中得到验证。我们建议,表2中暗线范围内的患者群体可能是未来此类试验的目标人群,以确定具有“假阳性”培养非依赖性诊断试验(培养阴性)的患者是否受益于抗真菌治疗,是否为真阳性。下面我们将讨论如何利用现有知识将这些分析合理地纳入患者监护。
表2:念珠菌病非依赖培养诊断试验与不完善参考标准培养的性能特征比较

表2改编自Clancy和Nguyen。BDG诊断念珠菌病的敏感性/特异性来自本文引用的Meta分析。PCR和T2Candida诊断念珠菌血症的敏感性/特异性来自Meta分析以及DIRECT和DIRECT2临床试验。为了合理使用非培养独立诊断试验,临床医生必须熟悉当地各种类型侵袭性念珠菌病的检测和流行情况。非培养诊断测试指导患者管理策略尚未在临床试验中得到验证。我们建议PPV>15%的患者群体可以作为此类试验的目标人群,以更好地确定抗真菌治疗反应的临床效益。高危患者群体中的这些“假阳性”可能代表血液和其他培养阴性的深层侵袭性念珠菌病。
缩写:BDG:1,3-β-D-葡聚糖;ICU,重症监护室;NPV,阴性预测值;PCR,念珠菌聚合酶链反应;PPV,阳性预测值。
(1→3)-β-D-葡聚糖(BDG)
BDG是念珠菌和大多数致病真菌的细胞壁成分。没有确凿的证据表明由任何特定制造商的化验方法的优越性。大部分数据用于FDA批准的真菌试验(Cape Cod协会、Cape Cod、MA、USA)。阳性BDG结果不能识别念珠菌种类,也不能区分念珠菌和其他真菌。如果2个或更多连续样本对BDG呈阳性(>80 pg/mL),则性能会提高。静脉注射免疫球蛋白、白蛋白、β-内酰胺类抗生素或细菌感染可出现假阳性。
在Meta分析中,血清BDG对侵袭性念珠菌病(主要是念珠菌病)的敏感性和特异性分别为约75%-80%和约60%-80%。个别报告的表现差异很大,敏感性从27%到100%,特异性从0%到100%。在深部念珠菌病(主要是腹腔内念珠菌病)的研究中,敏感性和特异性(四分位差[IQR])分别为65%(60%-77%)和75%(64%-75%)(表3)。由于表现和研究设计的异质性,最近的Cochrane报告无法进行Meta分析或评估BDG对侵袭性念珠菌病的诊断准确性。虽然BDG水平的负斜率(如下降)与成功的治疗结果相关,但侵袭性念珠菌病患者的BDG连续测量通常不进行评估;需要更多关于BDG纵向变化的数据。
表3:BDG、PCR和T2Candida在不同腹腔内念珠菌病风险人群中的预期表现
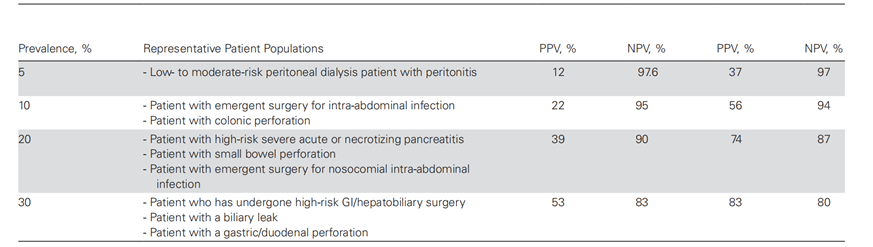
表3改编自Clancy和Nguyen。BDG诊断腹腔内念珠菌病(最常见的深层念珠菌病)的敏感性/特异性值是本文引用研究的中值。如文中所述,PCR和T2Candida诊断的敏感性和特异性是最近发表的研究的代表。为了合理使用非培养诊断试验,临床医生必须熟悉当地各种类型侵袭性念珠菌病的试验表现和流行情况。PPV和NPV分别>15–30%和>85%表示非培养试验可能具有最大临床效用的患者,假设抗真菌治疗在念珠菌感染≥15%-30%的阈值可能性是合理的。
缩写:BDG:1,3-β-D-葡聚糖;GI,胃肠道;NPV,阴性预测值;PCR,念珠菌聚合酶链反应;PPV,阳性预测值。
PCR
PCR与BDG相比具有潜在优势,它可以特异性地靶向念珠菌属,并允许在菌种水平上同时进行鉴定。大多数PCR检测的目标是白色念珠菌、光滑念珠菌、副硅藻菌复合体、热带念珠菌和克鲁氏念珠菌,它们占大多数中心侵袭性念珠菌病病例的95%以上。在一项Meta分析中,PCR对已证实/可能的侵袭性念珠菌病(主要是念珠菌病)的敏感性为95%,特异性为92%。对已证实/很可能的/可能的侵袭性念珠菌病的敏感性和特异性分别为73%和95%。全血(与血清相反)和念珠菌或真菌特异性检测的敏感性更高,而不是更广泛的多重检测。念珠菌定植患者的特异性有降低的趋势。另一项Meta分析调查了LightCycler SeptiFast(德国曼海姆罗氏诊断公司),这是一种实时多重PCR检测法,用于检测5种最常见的念珠菌属和20种其他细菌病原体,这些病原体均为拟诊的脓毒症患者。本研究中,念珠菌血症的敏感性和特异性分别为61%和99%。在深部念珠菌病(主要是腹腔内念珠菌病)的研究中,PCR的敏感性和特异性分别为25%-91%和33%-97%。
T2Candida
T2Candida(T2 Biosystems,Lexington,MA,USA)是美国食品和药物管理局批准的念珠菌血症诊断方法,通过T2磁共振检测扩增DNA靶点的自动化过程,检测全血中5种最常见的念珠菌。在多中心研究中,目标念珠菌对T2Candida的敏感性为89%–91%,特异性为98%。念珠菌检测和菌种鉴定的平均时间为4.4±1.0小时。临床实践中T2Candida的数据显示,该方法对念珠菌血症的敏感性为65%-83%,特异性为93%-96%。对于深部念珠菌病(主要是腹腔内念珠菌病)的诊断,研究发现该系统的敏感性为33%-45%,特异性为93%-96%。
在对有侵袭性念珠菌病风险的重症监护病房患者进行的小型研究中,基于血清BDG和T2Candida结果的治疗策略可有效缩短侵袭性念珠菌病的适当治疗时间,安全地减少不必要的经验性抗真菌药物使用,并降低成本。在西班牙的一项针对接受念珠菌血症治疗的患者的多中心研究中,在念珠菌血培养阳性后的前5天内,T2Candida阳性(而非BDG)是导致致死或发展为深部念珠菌病的独立危险因素。在一项多中心配对研究中,经验性治疗后T2Candida阳性是死亡或已证实念珠菌病的独立预测因子,而BDG结果不能预测死亡率。需要进行非培养诊断试验的临床试验-指导治疗策略,以验证对患者预后、抗真菌药物使用和医疗成本的影响。CandiSep试验(NCT02734550,下文讨论)的结果有望增加我们对这些试验及其对抗真菌处方的影响的理解。
非培养诊断试验有可能成为念珠菌病试验的纳入标准。很明显,单纯培养只能检测临床疾病的一部分。在临床试验中,培养阳性应该是一个重要的先验亚组,但将登记范围限制在培养阳性病例会导致登记延迟,并且人工筛选人群不能反映当前的临床实践。CandiSep前瞻性随机多中心试验正在评估与标准监护相比,在(1,3)-β-D-葡聚糖指导下开抗真菌药的决定是否缩短了抗真菌治疗的时间并降低了死亡率。该试验的结果应为今后的念珠菌病试验提供纳入标准。最有可能的是,在未来的临床试验中,培养阳性/阴性应该是先验亚组分析的标准,而不是作为纳入标准的限制。
还需要验证替代标记物(如BDG或PCR Ct值)或T2Candida阴性时间的系列变化的临床作用。除1项BDG研究外,替代标记物的快速减少与临床生存率之间缺乏相关性。替代标记物动力学的验证将允许对新药物或联合疗法进行较小的II期试验。一个出发点是利用现有的储存标本队列来研究生物标志物的纵向变化。
念珠菌病替代生物标志物的总结和建议
培养仍然是念珠菌病诊断的支柱,但不应成为侵袭性念珠菌病试验的限制性纳入标准。有记录的念珠菌清除率是成功抗真菌治疗的标志。我们建议对阳性培养物进行分子诊断性分析,以准确、快速地鉴定菌种水平。在选定的临床方案中,非培养诊断测试可能有助于启动或降低抗真菌治疗。对有念珠菌病危险因素的患者进行PCR或T2Candida检测阳性证明了参与临床试验的必要性。存在多种可能的生物标记物,可用于II期试验以量化抗真菌活性,但这些生物标记物尚未得到验证。
曲霉病
曲霉在环境中普遍存在,经常被吸入呼吸道。当气道培养物呈阳性时,诊断侵袭性曲菌病需要合适的宿主和相容的临床综合征,以区分定植和感染。只有从无菌部位培养该菌,或在组织病理学上证明该菌具有菌丝入侵,才能证实已证实的曲霉病。曲霉细胞壁含有多糖、BDG、几丁质和其他可用于检测患者样本的成分。半乳甘露聚糖和BDG是这些细胞壁成分中研究最充分的。
半乳甘露聚糖动力学
血清半乳甘露聚糖的动力学特征复杂,取决于多种因素,包括生产和分泌、真菌负荷、中性粒细胞的存在和功能、患者的肾功能和肝功能,接触具有抗曲霉属半乳甘露聚糖活性的抗真菌药物,循环中半乳甘露聚糖的存在与曲霉通过肺毛细血管的侵袭性生长相关,血管侵袭与真菌负荷和半乳甘露聚糖的产生相关。这些发现有助于解释血清半乳甘露聚糖在不同患者群体中的不同表现(表4)。例如,在血液系统恶性肿瘤患者和疾病负担较高的异基因造血干细胞移植受者中可检测到血清半乳甘露聚糖。相比之下,在实体器官移植患者中,血清半乳甘露聚糖在诊断侵袭性曲霉菌病(IA)方面的表现相对较差,这些患者的疾病负担通常较低。
表4。使用ODI截止值为1.0的血清或血浆中半乳甘露聚糖性能特征总结

表由Scott等人修改。
缩写:ODI,光密度指数。
研究人员还关注起始血清半乳甘露聚糖值是否与患者预后相关,以及连续半乳甘露聚糖光密度指数读数的斜率是否与生存率相关。多项研究评估了起始血清半乳甘露聚糖作为曲霉病治疗反应和预后指标的作用。在最近对这些研究的综述中,Mercier等人发现血清半乳甘露聚糖阳性(定义为临界值>0.5光密度指数)的患者在治疗42天和180天时血清半乳甘露聚糖水平与生存率之间存在相关性,≥2.0起始光密度指数与预后不良有关。在最近一项比较阿尼芬净联合伏立康唑与单用伏立康唑的随机对照试验中,起始血清半乳甘露聚糖也是6周生存率的独立预测因子。
在几项研究中已经评估了连续测量半乳甘露聚糖在IA患者中的作用。尽管这些研究在结果定义和半乳甘露聚糖评估时间点方面存在异质性,但数据表明血清半乳甘露聚糖值下降是生存率的预测因子,而血清半乳甘露聚糖持续升高与死亡相关。一项研究报告说,从起始到第2周,半乳甘露聚糖光密度指数每增加0.1个单位,相当于不满意的临床应答率高21%。
关于特定抗真菌药物对血清半乳甘露聚糖动力学影响的数据是相互矛盾的,仍然是一个研究的主题。一些研究显示了取决于抗真菌药物的不同动力学特征,而另一些则没有显示出影响。
支气管肺泡灌洗(BAL)液中的半乳甘露聚糖动力学知之甚少,应谨慎解读,因为该试验受到包括取样误差、非标准化BAL液收集和感染部位在内的困扰。
根据现有数据,目前美国传染病学会指南建议,仅在血液系统恶性肿瘤患者和起始半乳甘露聚糖升高的造血干细胞移植受者中使用连续血清半乳甘露聚糖,以监测疾病进展、治疗反馈和预测IA患者的预后。
横向流动分析的发展有助于曲霉病的诊断,尽管它们在连续取样中的作用迄今尚未确定。
(1→3)-β-D-葡聚糖(BDG)
BDG检测在IA患者的治疗监测中的实用性表现不佳。Pazos等人首先在40例高危中性粒细胞减少患者的回顾性队列中评估BDG与半乳甘露聚糖检测的比较(5例证实,3例极有可能,3例可能)。半乳甘露聚糖和BDG检测的敏感性、特异性以及阳性和阴性预测值几乎相同;然而,BDG阳性时间早于半乳甘露聚糖。在评估BDG检测作为预后工具时,血浆浓度在临床和微生物学证据显示疾病之前持续增加,但是在抗真菌治疗反应之后降低并变为阴性。相反,对抗真菌治疗无反应的患者表现出BDG阳性的持续存在。其他类似的研究也观察到在治疗反应后BDG值下降。
还有人将BDG和半乳甘露聚糖直接用于IA的预后。在一项对51名可评估患者的研究中,当BDG和半乳甘露聚糖被总结时,从起始到第12周的变化之间存在关联;然而,单独使用BDG没有统计学意义。其他人也描述了类似的发现,大多数患者在6-12周内的BDG值持续>80 pg/mL,并且轨迹不能预测6或12周的结果。BDG动力学缓慢,可能需要在治疗开始后>4-6周才能明显改变。这些限制以及BDG检测的患者内变异性促使作者不推荐连续BDG。
PCR
美国曲霉PCR检测的可用性仍然有限;PCR仅在基准实验室进行(尽管欧洲市场上有曲霉PCR检测)。鉴于不同的技术、阳性的周期阈值、微生物靶点和已评估的研究人群,报告的PCR性能特征有所不同。一项Meta分析评估了25项研究,发现综合敏感性和特异性分别为84%和76%。在2例PCR结果阳性的患者中,灵敏度为64%,但特异性提高到95%。
很少有研究评估连续PCR检测的预后;然而,已发现诊断时以血清复制数/毫升为单位的定量PCR可预测90天死亡率。持续阳性或出现阴性检测可预测30天或90天的死亡率。在第14天到第20天之间PCR呈阴性的患者在第30天全部存活,而持续PCR的患者在第30天的死亡率为80%。以每周采样为终点的PCR阴性时间可能是未来的研究领域。
来自BAL的烟曲霉定量PCR已被用于侵袭性和非侵袭性曲霉菌病的诊断和预后评估。在一项评估613名高危患者的4年回顾性研究中,诊断时的真菌负荷(复制数/毫升)可预测90天死亡率,500复制数/毫升以下患者的死亡率为23%,而500复制数/毫升以上患者的死亡率为68%(P<0.05)。
曲霉菌病替代生物标志物的总结和建议
半乳甘露聚糖、BDG和PCR是临床实践中使用的标准诊断方法,一些PCR试验还具有检测抗真菌耐药性突变的优势。BDG的特异性最低,不足以作为患者进入临床试验的诊断生物标志物。对于抗真菌药物反应的预后标志物,血液半乳甘露聚糖值随时间的变化是一个有前途的连续替代标志物。随着时间的推移,PCR阴性也有望用作患者预后的替代标记。
其他霉菌
由毛霉菌、镰刀菌、丝孢菌属等引起的非曲霉菌侵袭性感染在日益增多的严重免疫抑制患者中越来越多见,在尸检研究中占侵袭性霉菌感染的10%-25%,且在接受抗真菌预防的患者中更为常见。这些霉菌的特点是对多种抗真菌药物耐药,组织入侵的可能性高,早期传播效果差。虽然宿主相关因素(基础疾病的活动性、合并症)对死亡率很重要,但早期诊断可以防止感染演变为多灶性或播散性感染。
由于非曲霉菌侵袭性感染的症状、体征和影像学表现缺乏敏感性和特异性,诊断往往延误,导致治疗延迟和不良结果。对这些霉菌感染早期有效治疗的重要性知之甚少,但毛霉菌病除外,已证明早期使用抗毛霉菌治疗可提高生存率。传统的诊断确认需要有创性的操作,如活检或BAL,这在严重全血细胞减少的患者中通常是不可行的。
这些病原体的商用生物标记物的性能也存在问题。除曲霉菌外,半乳甘露聚糖由几种非曲霉菌产生,尤其是其他透明丝孢菌,如镰刀菌属。毛霉菌病患者的半乳甘露聚糖呈阴性。大多数非曲霉侵入性霉菌感染的高危患者是已经接受抗曲霉抗真菌药物的突破性感染。最后,虽然BDG不能在物种水平上识别生物体,但阳性BDG可以表明存在霉菌。关于非曲霉霉菌的纵向预后数据还需要更多的数据。
开发不依赖培养物的生物标志物来早期诊断这些重要的生物体是至关重要的。以毛霉为靶点的血清和/或BAL中基于PCR的诊断领域最为发达。一些小型研究表明,尽管缺乏与标准微生物学方法的详细比较,但有希望实现早期诊断的高灵敏度和特异性。在一项小型研究中,通过实时定量PCR对重症烧伤患者的循环毛霉DNA进行靶向筛查,以识别侵袭性伤口毛霉菌病,提出了降低死亡率的方法。还需要其他创新方法,可能包括血清学评估、挥发性有机化合物或其他代谢组学检测,以及在选定的非曲霉菌侵袭性感染病例中验证抗原测试、免疫组织化学、PCR和宏基因组测序。
迄今为止,诊断和预后应用的最佳例子是在刺突嗜血杆菌脑膜炎暴发中,PCR和BDG用于CSF诊断,CSF BDG水平可用于监测抗真菌治疗的反应。我们仍需要更多的数据来研究对其他霉菌治疗的反应。
非曲霉菌中替代生物标记物的总结和建议
非曲霉菌的诊断需要进一步发展,这些微生物的特定生物标记物将有助于疾病管理。关于在临床试验中使用任何替代终点的效用,数据不足。
芽生菌病
典型的芽生菌病治疗成功的终点是临床改善以及皮损或放射学检查结果的解决。诊断可能的芽生菌病的标准方法是芽生菌抗原,该抗原测量尿液、血清或体液中皮炎芽生菌(美国印第安纳波利斯米拉维斯塔实验室)的细胞壁多糖(半乳甘露聚糖)(表5)。然而,跟踪感染过程进行纵向抗原测量的报道并不多见。三名芽生菌病儿童在治疗期间进行了一系列尿抗原检测。2名治愈患者的抗原水平下降至无法检测,但第三名患者对抗真菌治疗无反应,抗原阳性持续存在。
一种更系统的方法是使用芽生菌抗原检测来跟踪病程,包括19名患者进行了一系列尿液抗原检测。抗原水平下降,但在16名成功治疗的患者中,出现阴性结果的时间差别很大。在3名治疗失败的患者中,尿抗原水平升高。



芽生菌病替代生物标志物的总结和建议
目前还没有足够的数据推荐芽生菌病预后的生物标志物或作为临床试验的替代终点。血清芽生菌抗原的纵向变化需要进一步研究。对于芽生菌病致急性呼吸窘迫综合征的更严重疾病表现的预后需要替代标志物。
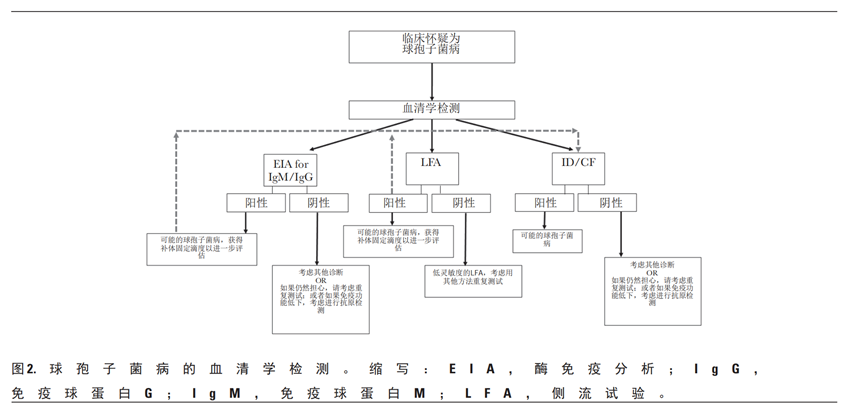
球孢子菌病
过去对球孢子菌病的研究使用了综合临床评分、放射学结果和血清学结果来确定临床严重程度的综合评分。可以使用多种方法进行血清学检测(图2)。EIA似乎具有最高的灵敏度,尽管它容易出现假阳性,并且结果应通过免疫扩散试验进行确认。一种新开发的横向流动分析显示灵敏度较低(31%)。球虫补体结合(CF)试验用于定量检测免疫球蛋白G在血清和脑脊液样本中具有预后效用(表5)。连续血清样本与患者症状相关,有助于监测治疗过程。必须认识到球孢子菌病感染类型的差异及其在血清学动力学中对确定治疗反应的影响,因为与原发性肺球孢子菌病相比,慢性肺球孢子菌病或播散性球孢子菌病患者的血清学下降较慢。
球孢子菌性脑膜炎患者CSF的连续血清学检测显示与其他CSF指标相关,包括细胞计数、蛋白质和葡萄糖;然而,血清学和常规脑脊液参数的反应比疾病的临床症状和体征慢,临床决策应基于症状、脑脊液参数和血清学结果。
建立了一种实时PCR检测下呼吸道标本中球孢子菌的方法。球孢子菌抗原检测也可以在市场上买到,对于血清阴性的免疫功能高度低下的患者可能有用。BDG对球孢子菌病的敏感性为44% ,特异性为91%。由于缺乏支持这种方法的数据,血清、尿液或脑脊液的系列抗原和BDG检测没有常规进行。
球孢子菌病替代生物标志物的总结和建议
血清学检测有助于球孢子菌病的诊断,EIA结果应通过免疫扩散得到证实。使用CF血清学进行纵向评估有助于监测抗真菌治疗的反应。然而,关于其作为临床试验中使用的替代终点的效用的数据不足。
组织胞浆菌病
历史上,组织胞浆菌病的第一个预后标志是接受抗真菌治疗的HIV患者血培养阳性的持续时间。在艾滋病早期进行的研究中,疾病复发与阳性或持续阳性血培养有关。血液培养在HIV阴性患者中很少呈阳性,并且呈阳性的时间(平均>2周)限制了其在临床实践中治疗患者或进行临床试验期间的适用性。
组织胞浆菌病诊断最广泛使用的替代标记物是组织胞浆菌多糖半乳甘露聚糖抗原,可在尿液或血清中检测到(图3)。MiraVista(美国印第安纳波利斯)和IMMY(美国俄勒冈州诺曼)等开发了组织胞浆抗原检测。只有1项研究对391份HIV感染者尿液样本(n=104份经证实的播散性组织胞浆菌病)进行了MiraVista侧流法和IMMY半乳甘露聚糖酶免疫法的比较;它报告了相似的敏感性(90%-91%)和特异性(91%-92%)(表5)。在成功的抗真菌治疗过程中,组织胞浆抗原降低。在成功治疗的HIV患者中,抗原血症的下降速度比抗原尿更快,尽管在治疗的前2周抗原下降失败并不预示治疗失败。在临床复发的患者中,86%的患者的纵向抗原水平显著升高。
抗体检测对患有慢性或亚急性肺组织胞浆菌病的非免疫抑制患者最有用,对于患有严重免疫抑制的患者可能为阴性(图4)。如果怀疑较高,应在1-2个月内重复进行阴性检测。虽然抗体在急性疾病后确实出现衰退,但没有证据表明抗体滴度的变化或缺乏可以预测死亡率、治疗成功率或复发。
组织胞浆菌病替代生物标志物的总结和建议
对HIV患者的尿液组织胞浆抗原进行了深入研究,有助于诊断、患者管理,并作为临床试验的潜在终点。在其他人群中,应进行进一步研究,以确定纵向抗原检测对判断预后的有效性。

图3.标本类型对组织胞浆菌病抗原的诊断重叠。数据来自113例病例,包括56例播散性组织胞浆菌病,32例急性肺组织胞浆菌病,1例亚急性肺组织胞浆菌病,6例慢性肺组织胞浆菌病,1例肉芽肿性纵隔炎,15例未知,5例未检出。在播散性组织胞浆菌病和/或免疫功能低下的宿主中,抗原敏感性高于急性肺组织胞浆菌病或免疫正常宿主。

副球孢子菌病
血清学检测常用于副球孢子菌病的诊断,具有高度特异性(>95%)和敏感性(~80%)。已经研究了许多方法,包括内部分析,尽管现在可以进行商业免疫扩散试验。先前的一项研究发现纵向血清学评估有助于监测治疗反应。对43例急性或慢性副球孢子菌样真菌病患者的分析发现,在2年的随访期内,使用反向免疫电泳、补体固定或酶联免疫吸附试验检测抗体水平下降,与患者临床症状改善一致。抗体清除仅发生在随访超过12个月的单部位疾病患者中。复发性疾病患者的血清滴度水平升高,表明了连续监测的效用。然而,在某些情况下,抗真菌治疗开始后,血清学抗体滴度可能会增加,从而使血清学作为实用替代标记物的使用变得复杂。
抗原检测也已作为副球孢子菌病诊断的辅助手段(表5)。在23例随访8-12个月的患者中,伊曲康唑治疗期间抗原降低,治疗12个月后所有患者均未检测到抗原。不幸的是,这个测试不是商业上可用的。
副球孢子菌病中替代生物标志物的总结和建议
血清学检测可用于副球孢子菌病的诊断,可用于监测对抗真菌治疗的反应。然而,关于血清学作为用于临床试验的替代终点的数据不足。
孢子丝菌病
血清学检测不常用于孢子丝菌病的诊断,尽管有商业分析方法。过去评估乳胶凝集测定以帮助诊断脑膜孢子丝菌病;但是,该测定法不再适用,血清学检测通常对其他形式的孢子丝菌病一般没有帮助。已经研究了更新的测定法并且表现出合理的灵敏度和特异性,但是受到可用性的限制。血清学用于评估对抗真菌治疗反应的效用与临床反应有不同的相关性,该测试不是常规推荐的或可商购的。
孢子丝菌病中替代生物标志物的总结和建议
目前正在开发几种可能为孢子丝菌病诊断提供前景的检测方法,并且在验证后的未来临床试验中它们可能是有用的生物标志物。目前,没有生物标志物可用作临床试验的替代终点。
篮状菌病
由于潜伏期长(3-14天)和感染早期的低产量(表5),目前基于培养的篮状菌病诊断并不理想。在血液中进行的几种实时PCR测定在小型临床研究中显示出有希望的诊断性能。针对马尔尼菲篮状菌特异性细胞壁甘露糖蛋白Mp1p的抗原检测EIA与血培养相比具有高度敏感性(86%)和特异性(98%)(分别为73%和86%)。商业Mp1p EIA获得批准中国于2019年,IMMY(诺曼,俄克拉荷马州,美国)正在开发Mp1p LFA。
历史上评估篮状菌病的治疗反应一直基于解决发热、皮肤损伤和/或真菌血症缓解的综合临床和微生物学终点。在抗真菌治疗中,Mp1p浓度已显示在12至16周内下降至无法检测的水平(Thuy Le,未发表),Mp1p在治疗监测和预后中的作用是一项积极的研究课题。
最近开发了一种新的简单的真菌培养技术,用于连续定量血液中的马尔尼菲篮状菌菌落数,以测量早期杀真菌活性(EFA)。EFA量化了前14天血液CFU/mL/天的减少。在伊曲康唑与两性霉素B治疗狼疮的多中心试验中,两性霉素B组的EFA下降速度比伊曲康唑组快4倍,相当于24周死亡率从21.0%降至11.3%(P=0.006)。基线真菌菌落数是24周死亡率的独立预测因子。这些数据表明,血液中的EFA是死亡率的有力替代指标,并且是评估治疗反应的有用终点。
篮状菌病替代生物标志物的总结和建议
培养仍然是篮状菌病的主要诊断方法。抗原检测可能在验证后的未来临床试验中有用,但目前不能推荐作为临床试验的替代终点。在最近的一项临床试验中,定量血液菌落数的纵向变化被发现对定量EFA有用,并应成为未来临床试验的标准指标。
未来的发展方向
利用真菌感染的替代标志物来预测患者预后已经取得了重大进展。这些测试是一个可喜的进步;但是,仍然存在许多挑战。负担得起、现成且快速的内部诊断测试的开发至关重要。隐球菌病和篮状菌病是唯一具有确定的替代终点的真菌感染,迫切需要进一步研究其他侵袭性真菌感染的替代标志物,以帮助诊断和预后。侵袭性念珠菌病和曲霉病的负担要求紧急关注这些疾病。最后,通过测试记录良好的临床样本,共同努力评估有希望的诊断测试作为衡量治疗反应的替代指标,对于推动这一领域的发展和优化患者治疗至关重要。
[object Object]





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)