2022年8月9日,百济神州宣布,替雷利珠单抗(中文商品名:百泽安®)全球3期临床试验RATIONALE
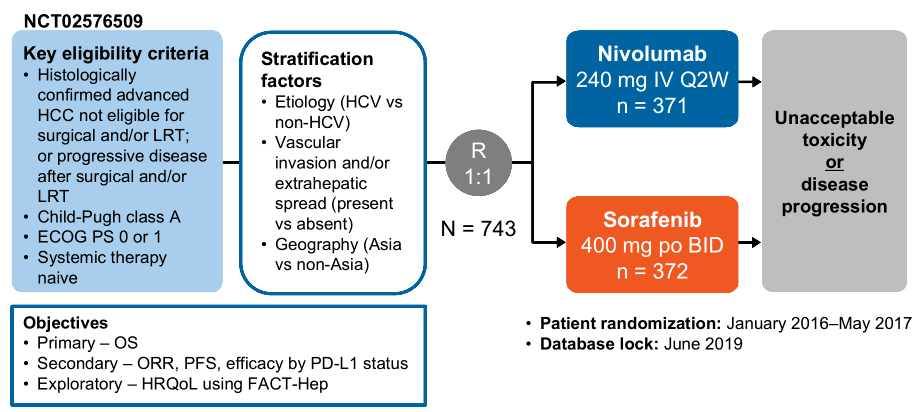
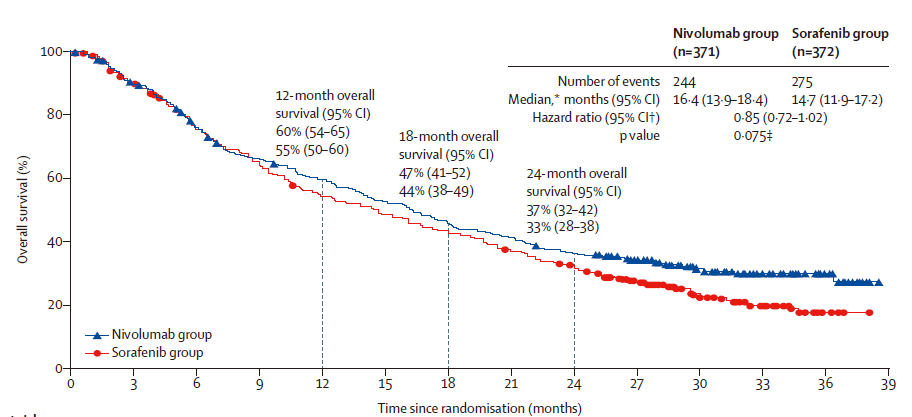
301研究达到主要终点,在治疗一线不可切除的肝细胞癌(HCC)成人患者中,替雷利珠单抗与索拉非尼相比,展示出在总生存期(OS)上的非劣效性,其安全性特征与既往研究一致,未报告新的安全性警示。该研究入组了来自美国、欧洲和亚洲的600余名患者。高度异质性的肝癌领域的竞争,最近这段时间,着实有些热闹。虽然早在Leap002的肝癌研究结果最终公布以前,在较早时候就已经知晓其失败的命运。最近在开会,正好有探讨到Leap002研究失利的结果,是否会导致目前临床常用的PD-1抗体联合帕博利珠单抗方案的应用,我的观点是不会。仑伐替尼的加持,短期患者的缩瘤效果是非常明显的,患者和医生之间的矛盾能够得到缓和。且仑伐替尼进入集采,价格大范围降低,且在肝癌领域,为了完成健康中国2030发展规划纲要的任务目标,转化治疗成为研究的热点。仑伐替尼的高ORR,是目前靶向TKI中最突出的。想要临床取代仑伐替尼联合PD-1抗体的方案,着实是有难度的。但肝癌庞大的患者人群数量让不少企业争相布局,百济神州的替雷利珠单抗的研究阳性结果,以非劣效设计,让我想起了被FDA否决掉的O药的CM-459研究。由于RATIONALE 301研究具体细节未披露,单药PD-单抗对比索拉非尼,从现有的临床治疗方案上来说,获得批准的可能性有危险存在。但采用的非劣效试验,相较于CM-459的优效设计,应该是吸取了教训。CheckMate-459肝癌一线,纳武利尤单抗对比索拉非尼的研究,虽然2019年就已经宣布结果失败(OS和PFS都没有达到优效性的统计学假设),直到今年,最终的具体细节才发表在Lancet上。很可惜的试验,也令人思考很多。
期待CDE如何看待百济神州的全球III期试验的结果,对比索拉非尼非劣结果。我个人感觉,应该可以获批吧。但肝癌,人群太大了,就看怎样考量医保支付和产品并非完胜的结果了。 版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。







发表评论
注册或登后即可发表评论
登录注册
全部评论(0)