2022-09-08 来源 : 医药地理PRO ,作者小秋秋
近日,复宏汉霖CEO张文杰在接受外媒采访时表示,在阐明斯鲁利单抗与与FDA监管路径后,复宏汉霖将寻找新的合作伙伴,助力斯鲁利单抗进入美国市场。这预示着又一款来自中国的PD-1即将向美国发起了挑战。
斯鲁利单抗是中国第13个获批的PD-1/L1抑制剂。据中国医药工业信息中心CPM新药研发监测数据库显示,斯鲁利单抗获批的适应症为MSI-H/dMMR肿瘤,正在研发阶段的适应症包括小细胞肺癌、非小细胞肺癌、胃癌、食管癌等等。
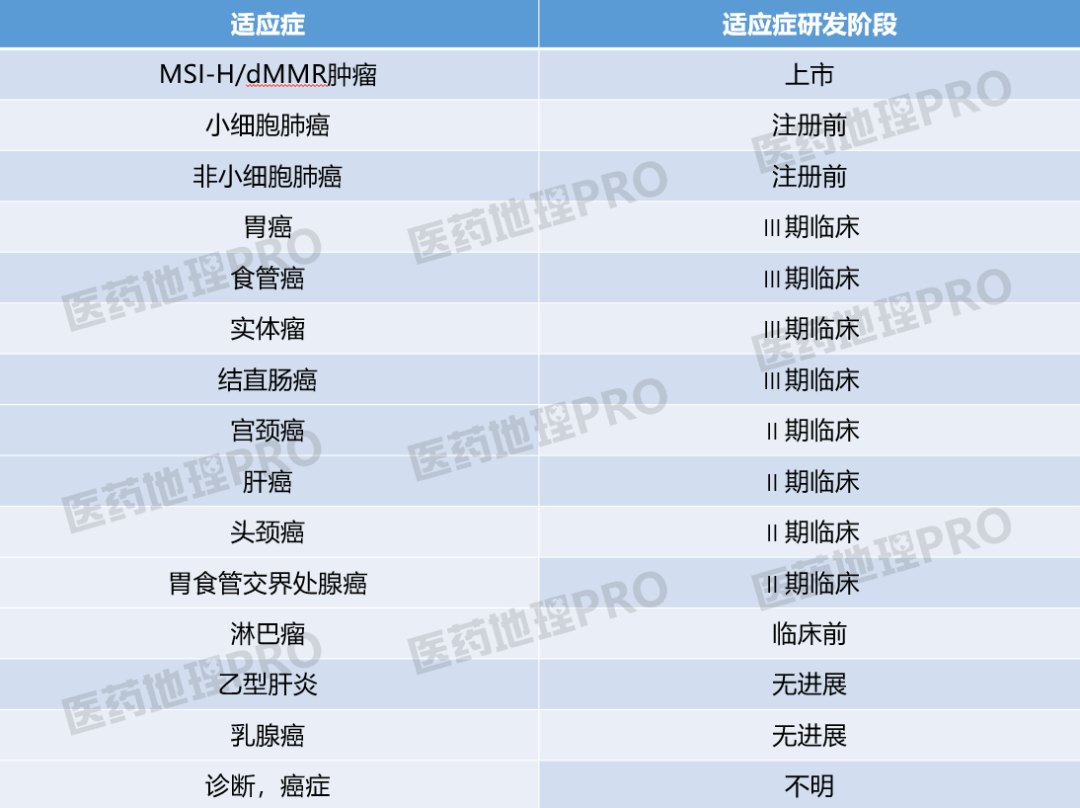
其中,对小细胞肺癌适应症的研发是本次斯鲁利单抗突破美国市场的关键。斯鲁利单抗是全球首款在一线小细胞肺癌治疗上突破三期临床OS改善的PD-1单抗。今年6月,复宏汉霖将此临床试验结果在ASCO大会上作出了分享。
在此之前,PD-1治疗小细胞癌适应症在全球范围一直难以攻克。K药与O药都曾试图开发小细胞肺癌适应症,在临床三期双双折戟。而后,默沙东与百时美施贵宝也都撤回了其PD-1治疗小细胞肺癌的适应症。
目前,斯鲁利单抗已经依靠小细胞肺癌适应症的研究进展获得FDA孤儿药称号,这也为其突破美国市场奠定了基础。唯一的问题是,这项临床三期试验的入组患者未包含美国人群,可能会因此无法得到上市支持。
对此,复宏汉霖表示,将对美国患者进行一项桥接试验,包括黑人与西班牙裔,分别接受斯鲁利单抗与罗氏T药的治疗。张文杰在接受采访时提到,FDA希望看到肿瘤反应率方面的数据而非患者生存情况,所以这项试验能很快完成,预计2年内获得FDA批准。
基于目前国内的内卷环境,多款国产PD-1对美国市场觊觎已久。今年2月,首次中国PD-1药企与FDA的正面交锋围绕信达生物信迪利单抗能否在美国获批上市展开。由于FDA在评审会议召开之前就披露了对信迪利单抗的若干质疑,因此其审批未通过的结果并不令人意外。
FDA认为,信迪利单抗的试验对照组不是美国目前的标准疗法;研究终点没有选择总生存期(OS);且单一中国数据并不能证明适用于美国患者。且FDA在会前资料中明确表示,将不会考虑市场价格因素,也就是说国产PD-1的价格优势并不能撬动美国市场的大门。
随后,君实生物、百济神州、恒瑞医药也纷纷拿出自家PD-1争先恐后的挑战FDA上市许可。虽然策略略有不同,如君实主攻鼻咽癌适应症,恒瑞进行了卡瑞利珠单抗联合阿帕替尼的国际多中心临床试验,但都前路未卜。
前人栽树,后人乘凉,有了兄弟企业的“前浪”经验,复宏汉霖能否抓住本次机会,我们将持续跟进。但在目前的全球市场环境下,国产药物对国际市场的冲击将不会停止,更多“后浪”生生不息。相信未来,终有企业能通过FDA的“全球最严”审批,惠及更多患者。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)