2023-01-10 来源 : 医药速览
01
3CLp和RdRp是当前新冠小分子药物开发主流靶点
新冠病毒为β属单链RNA病毒,有包膜,颗粒呈圆形或椭圆形。其基因组可分为六个部分,分别编码包膜蛋白(E)、刺突蛋白(S)、膜(M)蛋白、核衣壳蛋白(N)和复制酶多聚蛋白pp1a和pp1ab,pp1a和pp1ab合成后被切割成16种参与病毒复制组装的非结构蛋白。
新冠病毒的感染过程与一般病毒一致,首先通过与细胞表面ACE2受体结合融合后进入细胞,释放编码RNA,复制翻译后再组装为新的病毒颗粒,这一系列过程中参与的蛋白质包括新冠病毒的S蛋白、人体细胞的ACE2受体、催化RNA合成的RNA依赖性RNA聚合酶(RdRp)、切割前体蛋白的3-胰凝乳蛋白酶样蛋白酶(3CLp)以及其他的非结构蛋白如NSP13、NSP14、NSP16等,阻断其中任意蛋白均可起到抑制病毒复制的作用。
除了阻止病毒复制对人体组织的直接破坏以外,缓解炎症细胞浸润和细胞因子风暴也是十分重要的对症治疗,尤其是对重症患者来说。因此,各种细胞因子信号通路蛋白也是重要的新冠肺炎治疗靶点,包括BTK、JAK、IL-1、IL-6等,通过阻断相关炎症信号通路,可以减轻炎症和器官衰竭水平,挽救重症患者生命。
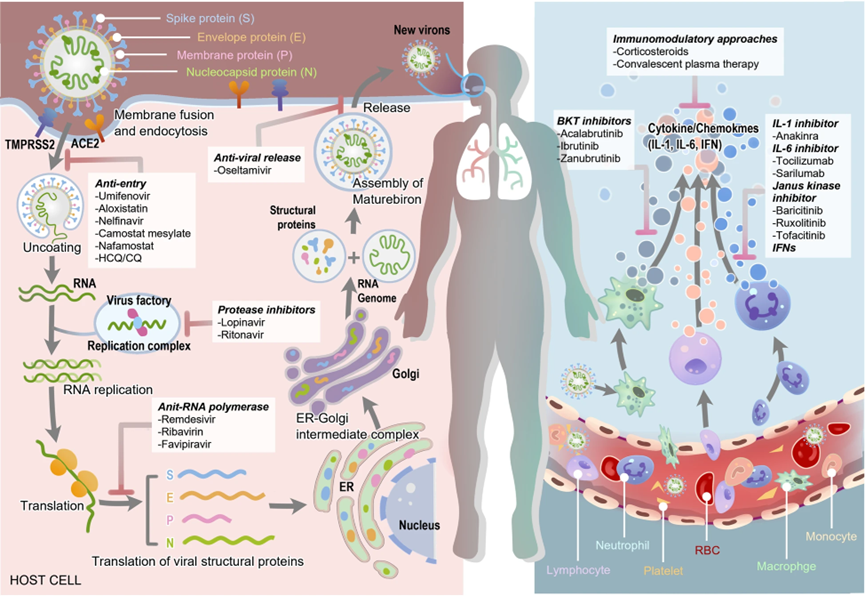
新冠病毒感染潜在治疗靶点[1]
从临床试验来看,目前新冠小分子开发热点主要集中在3CLp和RdRp,二者均是新冠病毒复制必须的关键蛋白酶,且结构和功能较为保守,对应抑制剂物具有效果好、广谱、安全性好的优点。其中3CLp靶点已有2款药物获批,1款申请上市中,RdRp靶点则有高达5款药物获批,此外还有超过20款针对3CLp和RdRp的药物处于临床试验中[2]。
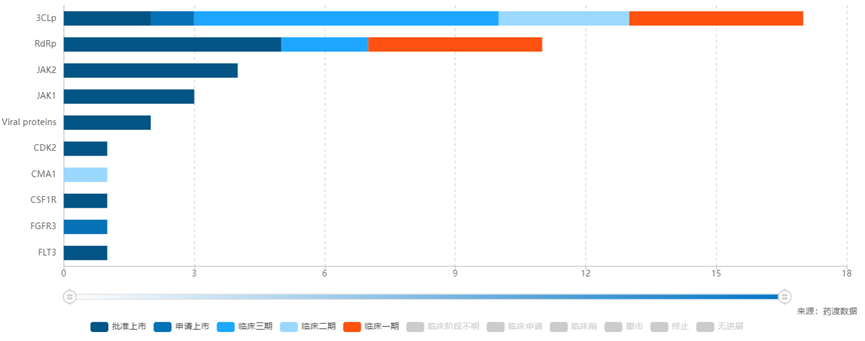
新冠病毒肺炎靶点情况[2]
02
全球已有10款小分子药物获批,辉瑞的Paxlovid最为畅销
据不完全统计,截至目前全球范围内已经有10款新冠小分子药物获得各国监管机构批准,除上面提到的7款RdRp/3CLp抑制剂外,还包括用于FDA批准的用于重症患者的JAK抑制剂巴瑞替尼(Baricitinib)、印度药监局批准的2-去氧-d-葡萄糖以及获巴拉圭EUA许可的普克鲁胺[3]。
NMPA目前仅批准了海正药业的法匹拉韦、辉瑞的奈玛特韦/利托那韦(Paxlovid)、默沙东的莫诺拉韦(Molnupiravir)以及真实生物的阿兹夫定用于新冠病毒感染患者的治疗,盐野义的Ensitrelvir已递交NDA,此外还有先声药业、前沿生物、众生药业、广生堂等国内药企也已推进到III期临床,靶点均为3CLp,而根据先声药业公告,其III期临床已完成,最快可于今年2月上市。
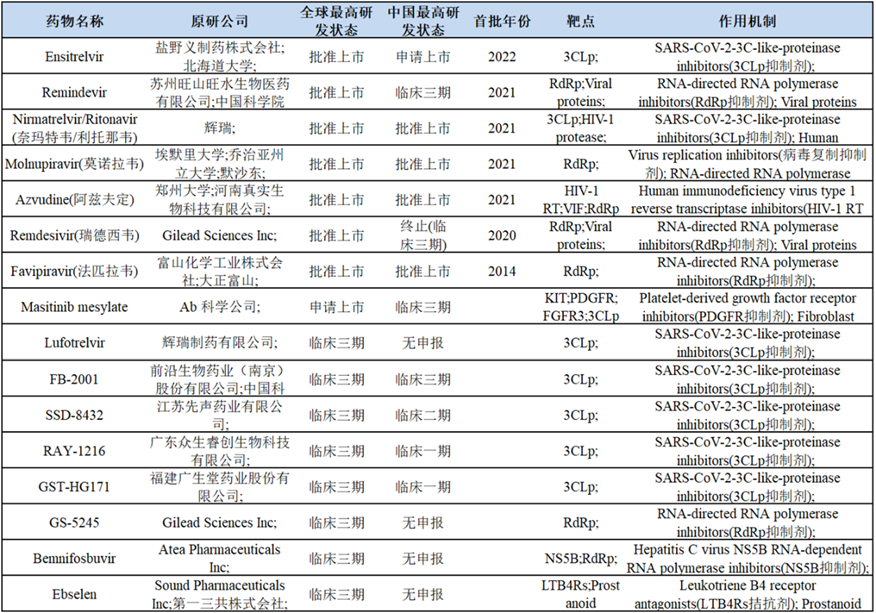
新冠小分子药物研发情况[2]
03
部分新冠小分子药化学结构
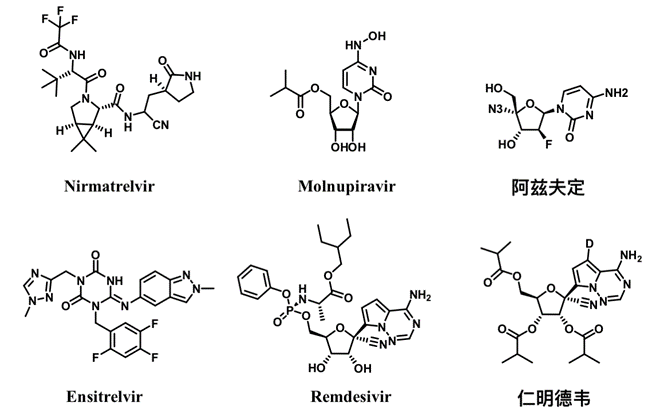
奈玛特韦/利托那韦(Paxlovid)
由辉瑞研发,于2021年12月22日获得FDA批准,2022年2月12日获NMPA批准,用于发病5天内的轻型和普通型且伴有进展为重症高风险因素的成人新冠肺炎患者。Paxlovid为3CLp抑制剂奈玛特韦和HIV-1蛋白酶抑制剂利托那韦的复方制剂,利托那韦主要用于抑制肝药酶CYP3A4对奈玛特韦的代谢,提升血药浓度增强药效,但这同时也增加了使用其他药物(如洛伐他丁、夫西地酸等)的风险,患者用药时需严格遵循医嘱。
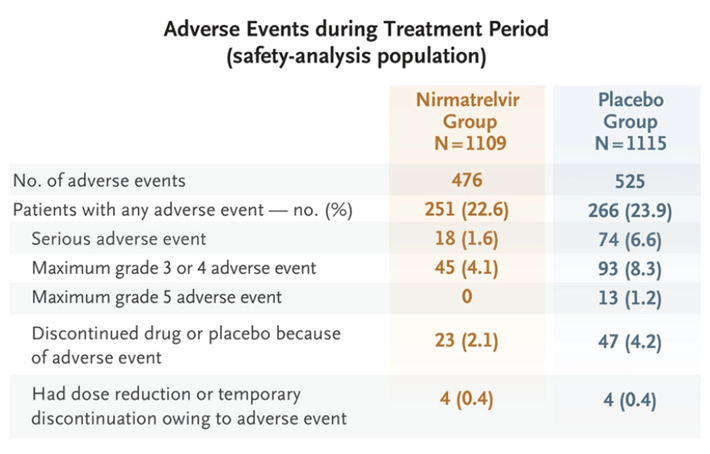
根据辉瑞发表在NEJM上的数据[5],在有症状、未接种疫苗、未住院、有进展为重症风险的患者群体中,Paxlovid给药组697例患者仅有5例发生住院,0例死亡,而安慰剂对照组682名患者共44例发生住院,其中9例死亡,给药组重症发生率较对照组低5.81%(P<0.001),证实Paxlovid可将有进展为重症风险的患者的死亡或住院风险降低89%且不良反应事件与安慰剂相似。而对无重症风险因素的成人患者或接种过疫苗的重症风险患者,Paxlovid可将重症风险减低51%,但并未表现出统计学意义[6],意味着该药对无重症风险的患者基本无效。但这并不妨碍Paxlovid成为最畅销的新冠治疗药物,根据辉瑞财报数据,Paxlovid在2022年一至三季度销售额分别为15亿、81亿、75亿美元,预计全年销售额可达220亿美元,而左手疫苗右手口服药的组合也预计将为辉瑞创造近540亿美元的年营收。
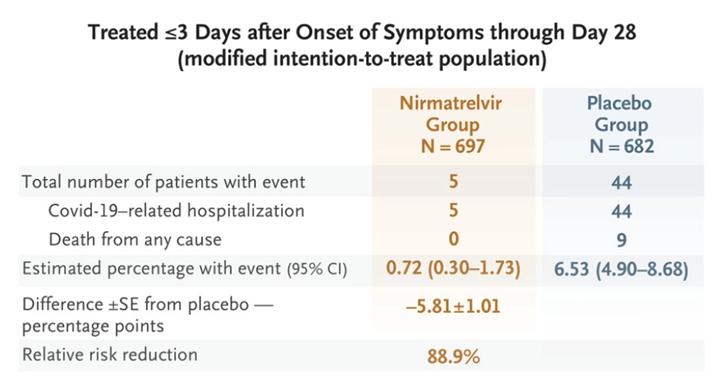
辉瑞EPIC-HR临床试验数据[5]
莫诺拉韦(Molnupiravir)
由默沙东和Ridgeback Biotherapeutics开发,是全球首个获批的口服抗新冠病毒药物,于2021年11月4日获英国药品和保健产品监管局批准、2021年12月23日获FDA批准、2022年12月30日获NMPA批准,用于轻度和中度伴有进展为高风险因素的成人新冠患者。该药为核苷类似物,可抑制RdRp,通过诱导病毒RNA发生突变来阻断病毒复制和传播。
根据默沙东发表在NEJM上的数据[7],在有症状、未接种疫苗、未住院、有至少一个重症风险因素的患者群体中,Molnupiravir给药组709例患者有48例住院其中1例死亡,安慰剂对照组699例患者有68例住院其中9例死亡,Molnupiravir组住院或死亡发生率较对照组低3.0%(P=0.001),说明Molnupiravir可将患者的住院风险降低31%,死亡风险降低92%。此外,给药组的不良反应事件也与安慰剂组相似,但其诱导RNA突变的抗病毒机制存在潜在致畸风险,所以该药被FDA添加了黑框警告。
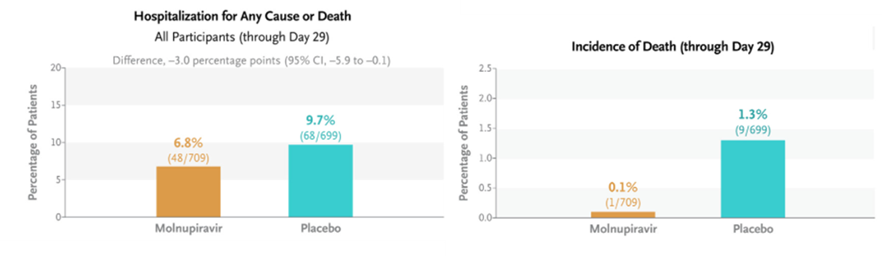
默沙东MOVe-OUT临床试验数据[7]

Molnupiravir黑框警告
虽然不是头对头试验,但Paxlovid对Molnupiravir的疗效优势还是十分明显(重症风险降低89% vs 31%),因而在Paxlovid上市后,Molnupiravir的市场也是受到明显挤压,根据默沙东财报,Molnupiravir在2022年一至三季度销售收入分别为32亿、12亿、4亿美元,全年预计仅52-54亿美元。
阿兹夫定(Azvudine)
由郑州大学和真实生物合作开发,于2021年7月获NMPA批准用于成年HIV-1感染患者,2022年7月获NMPA批准用于普通型新型冠状病毒肺炎成年患者。该药为核苷类似物,是一种VIF抑制剂、HIV-1 RT抑制剂和RdRp抑制剂。
根据真实生物招股书[8],阿兹夫定于2022年3月完成III期临床试验,共招募348名患者,该试验的主要疗效指标为治疗第7天和第14天的病毒载量变化。次要疗效指标包括新型冠状病毒核酸转阴率、新型冠状病毒核酸转阴时间、肺部影像改善、体温正常化、呼吸道体征及症状改善以及其他症状改善。结果显示给药组病毒载量下降快于对照组,且有显著性差异,但呼吸道体征、症状改善、肺部影像等次要疗效指标均无显著性差异。

阿兹夫定中国III期临床数据[8]
此外,阿兹夫定作为核苷类似物的RdRp抑制剂,与Molnupiravir一样具有遗传和生殖毒性的安全性风险,使用时需谨慎衡量风险和临床获益。
恩赛特韦(Ensitrelvir)
由日本盐野义制药株式会社和北海道大学合作研发的3CLp抑制剂,于2022年11月22日获得PMDA批准用于治疗新冠病毒感染。作用机制与Paxlovid相同,抑制3CLp后使新冠病毒无法复制增殖,但该分子药动学数据更佳,清除率低,无需联用肝药酶抑制剂来提升药效,故理论上来讲安全性将优于Paxlovid。
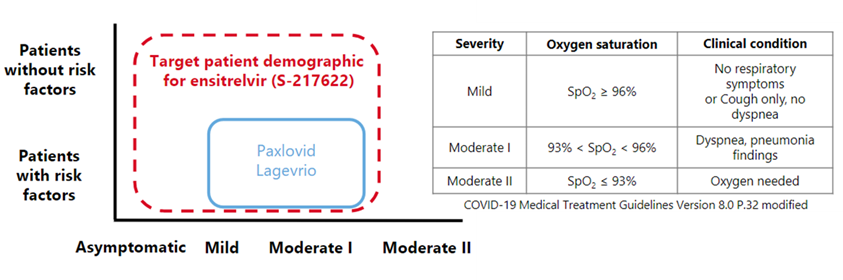
Ensitrelvir的目标患者群体[9]
根据盐野义公布的数据[9],其III期临床试验共招募1821名轻/中度症状患者,90%以上患者接种过疫苗,有重症风险因素和无重症风险因素的患者均囊括在内,试验发现Ensitrelvir给药组五种Omicron感染症状(鼻塞或流鼻涕、喉咙痛、咳嗽、发热或发烧、精力不足或疲倦)的缓解中位时间相比安慰剂组可缩短24小时(167.9 vs 192.2,p=0.04)。病毒RNA载量也较安慰剂组显著减少,三次给药后即降低至给药前的1/300,而安慰剂只降低至给药前的1/10。临床试验中未发现严重不良事件及副作用。
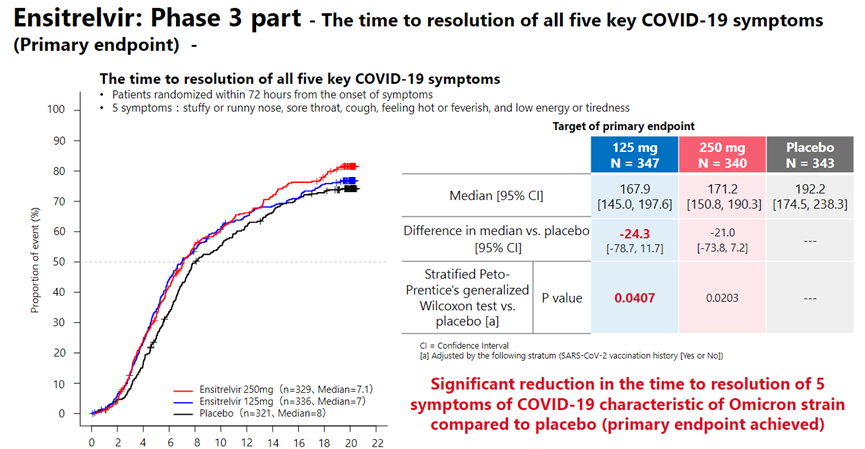
Ensitrelvir症状缓解效果[9]
仁明德韦(VV116,Remindevir)
由上海药物研究所、武汉病毒研究所以及旺山旺水生物医药公司合作开发的一款RdRp核苷类小分子抑制剂,于2021年12月31日在乌兹别克斯坦获批,成为全球第三款获批用于口服治疗新冠的小分子药物。仁明德韦在瑞德西韦结构基础上改造而来,提高了口服生物利用度和组织渗透性,在体内外都表现出显著的抗新冠病毒作用。
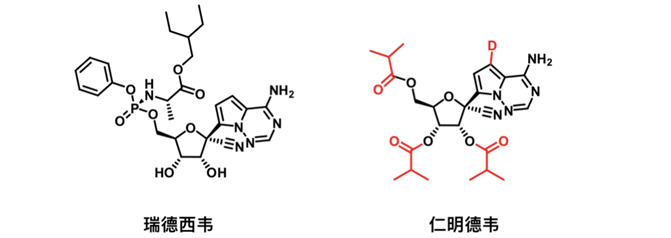
Remindevir及Remdesivir结构
根据君实发表在NEJM上的数据[10],在和Paxlovid的头对头III期临床研究中,共入组了822名有症状且有重症风险因素的轻至中度患者,75%已接种至少2剂疫苗。试验发现VV116组和Paxlovid组持续临床恢复的中位时间分别为4天和5天,两组均未出现重症或死亡,第7天、第28天的症状缓解率也基本一致,表明了VV116较Paxlovid的非劣性以及在加速轻中症患者恢复上的有效性。此外,VV116的任何不良事件和严重不良事件的发生率均低于Paxlovid。
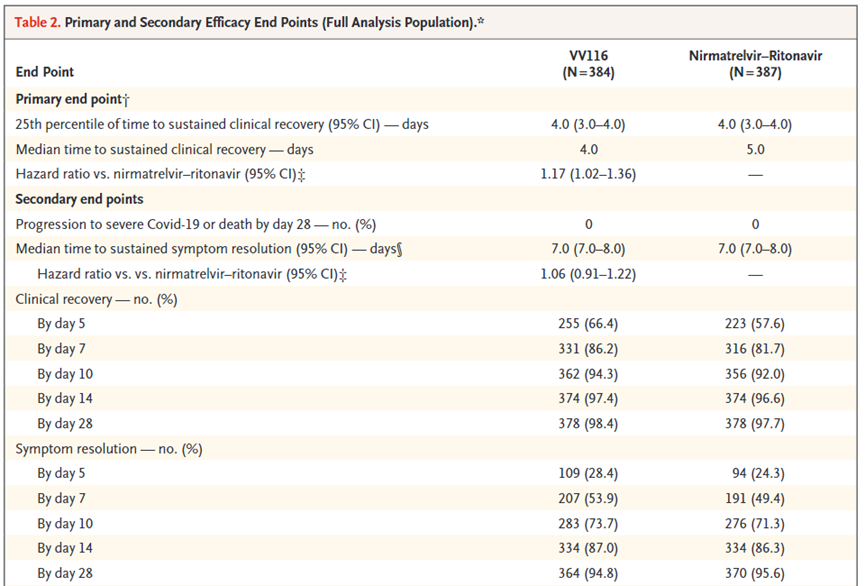
仁明德韦III期临床数据[10]
但与此同时,文章的作者也指出了该临床试验的不足之处,由于未来得及制备Paxlovid安慰剂,该临床试验仅为观察者单盲,也没有空白对照,暂时无法证明VV116在降低重症风险方面的作用。不过,君实已于2022年10月启动JT001-015研究[11],一项在轻中度伴或不伴有高危风险COVID-19受试者中评价VV116有效性和安全性的多中心、双盲、随机、安慰剂对照、III 期临床试验,期待能够读出优秀数据,加快VV116上市步伐。
先诺欣(SIM0417)
由先声药业宣布、上海药物所、武汉病毒所合作开发,是一款3CLp抑制剂,2022 年3月30日首次在国内获批临床,目前,该项目已启动7项NCT临床试验,针对轻中症成年患者的随机、双盲、安慰剂对照II/III期临床研究全部1208 例患者也已入组完成[2],是国内进度最快的3CLp抑制剂,据江苏省药监局预计, SIM0417最快可于今年2月获批上市。
RAY1216
由众生药业开发,同样为3CLp抑制剂,该药用于治疗轻型和普通型患者的随机、双盲、安慰剂对照 III 期临床研究已入组完成,共1360例。
HY3000
由中科院微生物研究所和深圳翰宇药业合作开发,是一种膜融合抑制剂多肽,作用于新冠病毒刺突蛋白的HR1区域,通过与HR1区域结合,阻止病毒六螺旋束结构形成,阻断病毒侵染细胞的路径。该项目开发剂型为鼻喷剂,经鼻给药,能够在病毒入侵人体的首要路径上建立抗病毒防线,起到阻断新冠病毒感染的作用,目前正处于临床II期试验中。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)