2023-03-27 来源 : Biotech前瞻
低级的欲望放纵即可,高级的追求源于自律。今晚想看之前买的有关女性健康的工作细胞系列书籍,正好又看见Cell上一篇有关乳腺癌的综述文章,今晚那就开始吧。

摘要
乳腺癌仍然是女性癌症相关死亡率的主要原因,也反映出乳腺癌患者存在的巨大异质性、转移性和治疗耐药率。在过去的十年里,基因组和转录基因组数据正在通过前所未有的规模进行整合,并揭示了不同的肿瘤亚型、关键分子驱动因素、克隆进化轨迹以及预后特征。另外,高分辨率单细胞多维技术和空间技术揭示了整个乳腺癌症生态系统的重要性以及独特的细胞“neighborhoods”的存在。在临床上,出现了大量新的靶向疗法,现在正迅速被纳入常规治疗标准中。然而,对现有治疗手段的耐药性,仍然是乳腺癌治疗领域面临的关键挑战。
介绍
癌症是一个全球性问题:乳腺癌是女性最常见的癌症,据估计,2020年新增230万例,死亡人数超过68.5万。尽管在过去二十年中,存活率显著提高,但乳腺癌的发病率在全球范围内继续上升。乳腺癌治疗结果的改善在很大程度上归因于乳房X光检查和辅助治疗;然而,针对晚期乳腺癌患者的高效系统疗法正在产生重要影响。遗传和非遗传因素共同影响乳腺癌发病率。非遗传因素包括年龄、生殖风险因素(如初潮早期和绝经晚期)、外源性女性激素、生活方式因素(如绝经后肥胖和饮酒)、辐射暴露、高乳腺 X 线摄影密度,以及组织学病变(如非典型增生)的存在,尽管其中一些因素也可能受到遗传易感性的影响。癌症由多个生物实体组成,其特征是病理、基因组改变、基因表达和肿瘤微环境(TME)的异质性,共同影响临床行为和治疗反应。然而,目前用于指导治疗决策的组织病理学、肿瘤大小和分级、淋巴结受累和标志物表达等经典参数并不完善,尤其是在晚期癌症的情况下,这些癌症最终会产生耐药性。因此,迫切需要更好地预测患者对治疗的反应,并需要改进优化治疗的选择。在过去的十年中,乳腺癌症的固有分子亚型和预测特征得到了进一步完善,而基因组学革命使大量乳腺肿瘤的测序以前所未有的速度和分辨率得以实现。深入的基因组分析也为疾病进展和转移过程中的肿瘤内异质性和克隆进化提供了实质性的见解。此外,越来越清楚的是,在解剖乳腺癌症生物学和改进治疗策略时,必须考虑整个肿瘤生态系统。在这篇综述中,研究者重点关注人类疾病,并强调近期在乳腺肿瘤的异质性、遗传驱动因素和整个肿瘤内的细胞复杂性方面的研究进展,其中大部分成果是通过新的多模式平台推动的。
传统乳腺癌分类
人类乳腺癌是根据多维度进行分层的,包含组织病理学分类、临床特征和分子分析。在诊断时,根据恶性细胞从乳腺小叶或导管扩散到周围基质的情况,根据组织学将肿瘤大致分为原位癌或浸润癌(图1)(参见世界卫生组织肿瘤分类)。除了形态学分类外,乳腺肿瘤在临床上根据雌激素受体(ER)、孕激素受体(PR)和人类上皮生长因子受体2(HER2/ERBB2)的表达将其分为三大临床组:ER+、HER2+和三阴性乳腺癌症(TNBC)(图1)。

图1. 乳腺癌的乳腺结构和组织病理学分类
人类乳房的示意图,描绘了末端导管小叶单元(TDLU),这是大多数肿瘤发生的乳房功能单元,以及分支上皮导管树的横截面图。乳腺导管由管腔和肌上皮细胞的双层上皮组成,周围是免疫、成纤维细胞和富含脂肪细胞的基质,影响正常的乳腺生理和致癌作用。
乳腺癌症发病机制的简化模型。导管或小叶上皮的异常细胞增殖可导致浸润前病变,称为原位癌。一旦肿瘤细胞突破基底膜并浸润周围基质,癌症就被归类为浸润性癌。
浸润前病变和浸润性乳腺癌的主要组织学亚型。浸润性导管癌“无特殊类型”(NST)占乳腺肿瘤的绝大多数。大约15%-25%的浸润性癌症具有独特的生长模式和细胞学特征。
主要基于雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER2)和增殖标记物Ki67的组织学特征和免疫组织化学表达,对癌症的主要临床亚型进行比较。ER+癌症约占所有乳腺癌的70%,其中ER+被定义为≥1% ER阳性肿瘤细胞(尽管≥10%的表达被认为具有更大的临床相关性),而HER2+肿瘤可以进一步细分为HER2+ER+(70%)和HER2+ER-(30%)亚组。HER2状态通过免疫组化,并通过显色或荧光原位杂交(分别为CISH和FISH)进一步评估,以确定基因扩增状态。HER2+肿瘤(定义为>10%细胞中的环向3+染色或HER2/ERBB2扩增)约占15%的乳腺癌,并表现出广泛的生物学异质性。HER2低表达乳腺癌受到越来越多的关注,通过免疫组化可以检测到低(1+)到中等(2+)HER2表达,但ERBB2扩增缺失。TNBC(15%的乳腺癌)缺乏ER、PR和HER2的表达,包括多种亚型,其特征通常是EGFR和细胞角蛋白CK5和CK14的表达。TNBC很容易早期复发和转移,尤其是肺和脑,在癌症死亡率中所占比例过高。总的来说,这些临床病理变量,尽管不是决定性的生物学变量参数,在考虑预后、治疗选择和临床试验设计方面继续发挥着至关重要的作用。
乳腺癌的内在分子亚型
过去二十年来,基于RNA的分子分析的出现深刻影响了我们对乳腺癌症异质性的理解,并影响了患者分层和治疗选择。
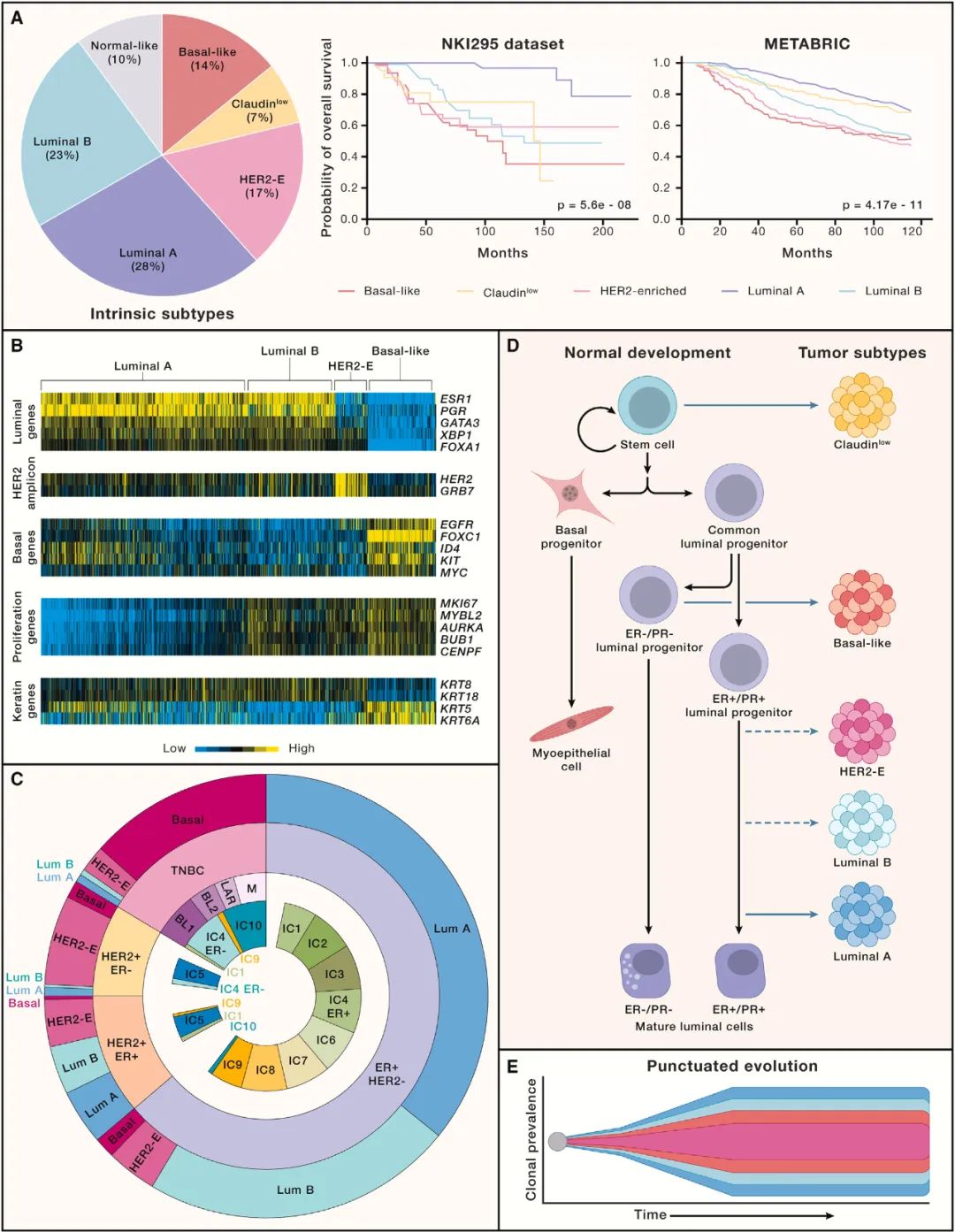
图2. 利用分子图谱鉴定癌症的固有亚型
描述乳腺癌症固有亚型的频率和预后的图表。每种亚型的预后结果显示为总生存率。
与乳腺癌症固有亚型相关的关键基因的基因表达数据。根据所选基因的4种主要内在亚型,对来自TCGA的乳腺肿瘤样本(n=792)进行排序。黄色,高于基因表达中位数;黑色,中位数;蓝色,低于中位数。经Hoadley等人许可复制(2014)。
通过组织病理学和分子分析定义的乳腺癌症亚型分布示意图。
描述正常乳腺分化层次结构和固有亚型之间关系的示意图模型。
克隆进化的标点模型。在肿瘤发展的早期,通过短暂的进化,伴随着优势克隆的稳定扩展,发生了大量的基因改变。

图3. 癌症异常信号通路网络
总结乳腺癌症的主要信号通路,强调通路串扰和关键信号通路上常见基因改变的交叉节点。显示了每个肿瘤亚型中20个显著突变基因的平均突变率。数据取自使用cBioPortal对PanCancer数据集(n=1066个肿瘤)的分析。

图4. 乳腺肿瘤微环境的解剖
乳腺肿瘤微环境(TME)内复杂性和多样性的示意图,通过整合先进的转录组学、高分辨率成像平台和临床前模型。下面的面板突出了在乳腺肿瘤的免疫和基质室中确定的关键亚群,每个亚群都与不同的细胞功能、肿瘤亚型和临床结果有关。成纤维细胞标志物aSMA、FAP、FSP1、PDGFR-B和CD29的表达定义了四个不同的CAF亚群(CAF-S1–S4)。CAF-S1成纤维细胞通过CD4+FOXP3+Tregs刺激免疫抑制,并可进一步细化为八个亚组,这些亚组被广泛表征为肌成纤维细胞或炎症性。TIL主要包括细胞毒性CD8+T细胞、CD4+辅助性T细胞、免疫抑制性FOXP3+CD4+调节性T细胞(Treg)和CD19+B细胞。另外两种T细胞亚群,组织驻留记忆T细胞(TRM)和表达Vδ1的γδ T细胞与TNBC的阳性临床结果相关。乳腺TME内的免疫抑制环境,主要归因于免疫检查点受体和抑制性细胞因子,损害抗肿瘤T细胞免疫。
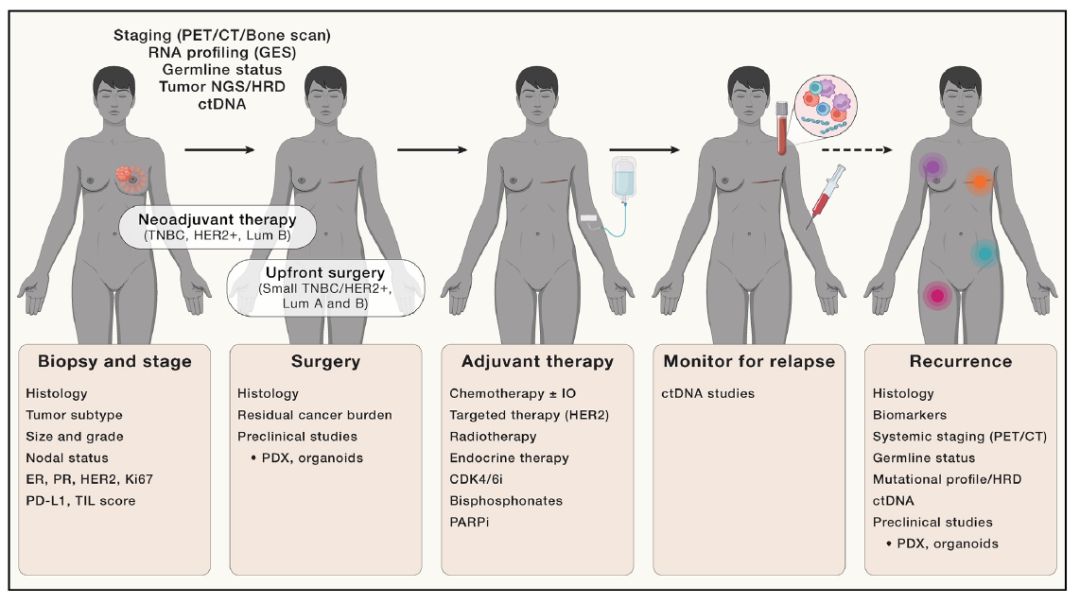
图5. 乳腺癌症的临床管理和当前治疗
描述临床中或临床试验中部署的治疗途径的示意图。活检和分期对于治疗选择和全面的临床病理评估至关重要。基因组研究可以包括RNA图谱、种系和体细胞肿瘤测序。对低风险疾病进行前期手术,而新辅助化疗通常用于TNBC和HER2+肿瘤,目的是实现病理完全缓解(pCR)或降低残余癌症负担(RCB)评分,并降低肿瘤分期。可以使用患者来源的异种移植物(PDX)或肿瘤类器官进行ctDNA评估和临床前建模。辅助治疗是根据肿瘤表型、基因型和手术选择的。复发的监测通常仅限于临床检查和乳腺成像,但在研究环境中,可以包括系列成像和ctDNA检测。如果复发,重新记录和评估肿瘤的组织病理学和突变特征是很重要的。功能分析(PDX和类器官)可能会指导治疗方案。PET,正电子发射断层扫描;CT、计算机断层扫描;GES,基因表达特征;NGS,下一代测序;HRD,同源重组缺陷;循环肿瘤DNA;TIL、肿瘤浸润性淋巴细胞。

图6. 针对乳腺癌症的关键信号节点,以及当前和新兴疗法的示例
显示已成功靶向的关键细胞表面受体的示意图,包括:
抗HER2单克隆抗体(曲妥珠单抗、帕妥珠单抗和玛格妥昔单抗);
ADC、T-DM1和T-DXd, Trop2 ADC;
针对PD-L1的单克隆免疫检查点抑制剂(atezolizumab、durvalumab和avelumab)或免疫细胞上的同源配体,如PD1(pembrolizumab和nivolumab)或CTLA-4(ipilimumab和tremlimumab);
酪氨酸激酶抑制剂,如拉帕替尼、来那替尼、图卡替尼,靶向HER2以阻断通过RAS/RAF/MEK/ERK和PI3K/AKT/mTOR途径的下游信号传导;
MEK、PI3K和AKT抑制剂正在研究中;
PIK3CA抑制剂alpelisib和mTORC1抑制剂依维莫司获得批准;
对于ER+乳腺癌症,选择性ER调节剂(SERMS)或芳香化酶抑制剂(AIs)阻止雌二醇的产生已经改变了临床实践;
选择性ER降解剂氟维司群和新兴的口服SERDS对复发性疾病有效;
以CDK4/6为靶点的联合治疗已被证明对ER+乳腺癌症有益,并有望治疗HER2+疾病。
总结
在过去的十年中,我们对乳腺癌症分子结构和肿瘤异质性的理解发生了革命性的飞跃。新出现的共识是,少数显性基因驱动因素与个别罕见突变和拷贝数改变协同作用,从而加速肿瘤的发生。考虑到迄今为止对1000个乳腺肿瘤进行的大规模平行测序,似乎大多数驱动基因都已被阐明。在TNBC中,似乎明显缺乏复发性突变和靶向性途径。
延申阅读:TNBC的治疗
布局潜在的临床未满足需求的适应症,无意是值得鼓励的。相较于自己关注的肝胆胰领域研究进展,三阴乳腺癌(TNBC)作为难治性癌种,也逐步迎来免疫治疗的曙光。
——快 讯——
2023年2月20日,君实生物(1877.HK,688180.SH)宣布,由公司自主研发的抗PD-1单抗药物特瑞普利单抗联合注射用紫杉醇(白蛋白结合型)治疗首诊IV期或复发转移性三阴性乳腺癌(TNBC)的随机、双盲、安慰剂对照、多中心III期临床研究(TORCHLIGHT研究)已完成方案预设的期中分析,独立数据监查委员会(IDMC)判定研究的主要终点达到方案预设的优效界值。君实生物将于近期与监管部门沟通递交该新适应症上市申请事宜。
TORCHLIGHT研究(NCT04085276)是国内首个在晚期TNBC免疫治疗领域取得阳性结果的III期注册研究。这项随机、双盲、安慰剂对照、多中心的III期临床研究,旨在首诊IV期或复发转移性TNBC患者中比较特瑞普利单抗联合注射用紫杉醇(白蛋白结合型)与安慰剂联合注射用紫杉醇(白蛋白结合型)的疗效和安全性。
根据本研究期中分析结果,与注射用紫杉醇(白蛋白结合型)相比,特瑞普利单抗联合注射用紫杉醇(白蛋白结合型)用于首诊IV期或复发转移性TNBC患者可显著延长PD-L1阳性人群的无进展生存期(PFS),同时,全人群和PD-L1阳性人群的次要终点——总生存期(OS)也显示出明显获益趋势。特瑞普利单抗安全性数据与已知风险相符,未发现新的安全性信号。关于详细的研究数据,君实生物将在近期的国际学术大会上公布。
——高危早期TNBC免疫研究进展——
2021年,ASCO发表了乳腺癌新辅助化疗、内分泌治疗和靶向治疗指南。免疫治疗方面,2022年04月13日,Journal of clinical oncology发表了“免疫检查点抑制剂帕博利珠单抗在高危早期三阴性乳腺癌治疗中的应用:ASCO指南快速建议更新”。


来自文献1
2022 ASCO大会上也口头报告了KEYNOTE-522研究的探索性分析结果。

来自文献2
背景
2021年,ASCO发表了乳腺癌新辅助化疗、内分泌治疗和靶向治疗指南。免疫治疗,则是KEYNOTE-522研究结果公布,鉴于KEYNOTE-522试验无事件生存期(EFS)的显著统计学差异结果,构成了ASCO指南关于帕博利珠单抗在高危早期TNBC治疗中更新的强烈证据。
2022年ASCO指南更新建议:对于T1cN1-2或T2-4N0(II期或III期)TNBC患者,专家组建议新辅助治疗使用帕博利珠单抗(200 mg 每3周一次或400 mg 每6周一次)联合化疗,术后继续接受帕博利珠单抗辅助治疗。帕博利珠单抗辅助治疗可与放疗同时或在放疗完成后给药。鉴于与帕博利珠单抗治疗相关的irAE可能为重度和永久性,因此需要仔细筛选并管理常见毒性。
先前的研究表明,残余癌症负担(RCB)在量化新辅助化疗后残余疾病的程度方面具有预后价值。在这一探索性分析中,研究者在KEYNOTE-522中评估了RCB的EFS。我们再来回顾下2022 ASCO大会上公布的该研究数据。
研究设计
KEYNOTE-522随机(2:1)、双盲、安慰剂对照试验数据的第四次中期分析结果发表。1174例早期(Ⅱ期或Ⅲ期)三阴性乳腺癌患者以2:1随机分为两组,两组分别接受:4个周期的帕博利珠单抗(Q3W,200 mg)或安慰剂+紫杉醇和卡铂新辅助治疗,之后序贯接受4个周期的帕博利珠单抗或安慰剂+多柔比星-环磷酰胺或表柔比星-环磷酰胺治疗。确定手术后,患者接受最多9个周期、每3周一次的帕博利珠单抗(帕博利珠单抗-化疗组)或安慰剂(安慰剂-化疗组)辅助治疗;或直到复发或出现不可接受的毒性。
双主要终点是pCR和EFS。手术时由当地病理学家评估RCB。以治疗为协变量,基于Cox回归模型评估RCB类别(RCB-0、-1、-2、-3,对应于越来越大的残留癌)与EFS之间的相关性。

研究设计

基线数据,ITT人群
结果
数据截止时(2021年3月23日),中位随访时间为39.1个月。EFS分别为RCB-0的HR为0.70(0.38-1.31),RCB-1的HR为0.92(0.39-2.20),RCB-2的HR为0.52(0.32-0.82),RCB-3的HR为1.24(0.69-2.23)。
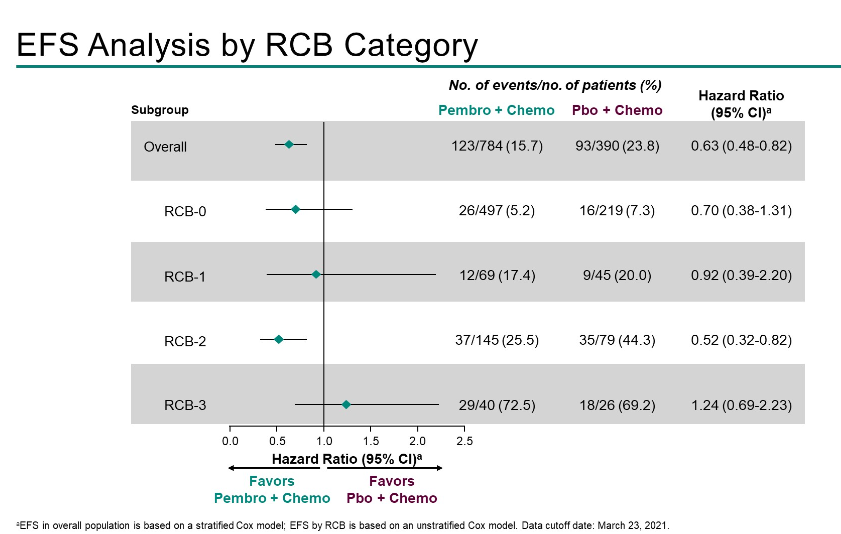
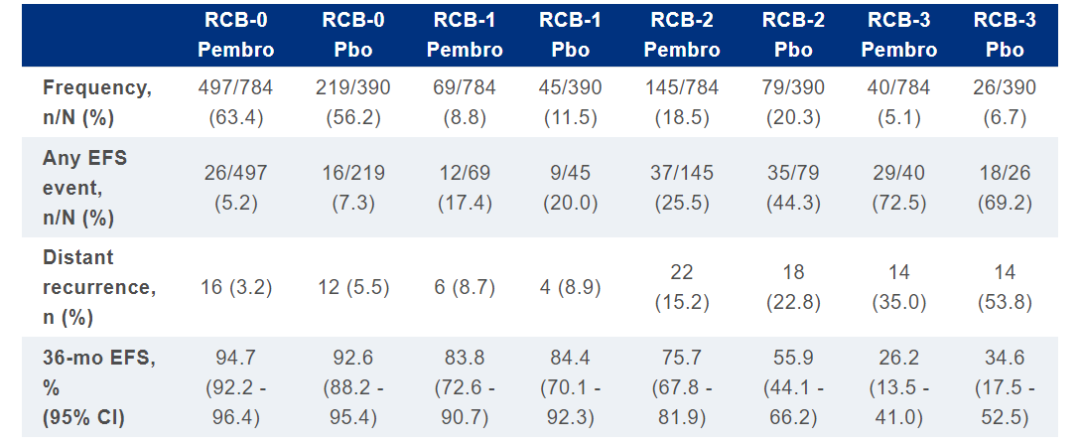
两组患者中最常见的EFS事件是远处复发,在所有RCB类别中,帕博利珠单抗组较少发生。
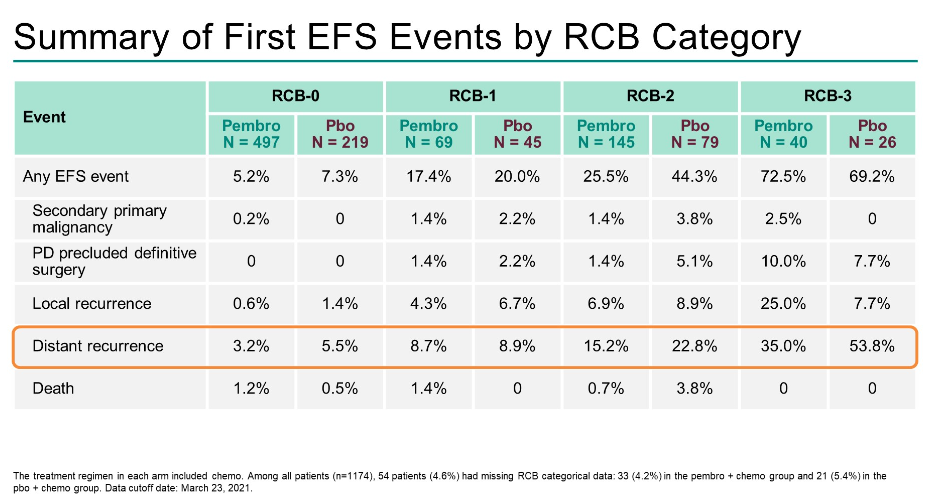
结论
RCB评分增加与EFS恶化相关。帕博利珠单抗组中残留疾病患者的RCB值较低,包括RCB-3患者较少。在RCB-0、-1和-2类中,与单纯化疗相比,帕博利珠单抗+化疗延长了EFS;小样本量限制了RCB-3类别的进一步解释。双臂广泛残留疾病(RCB-3)的小部分患者预后不良,分别为5.1%和6.7%。这些结果强调了帕博利珠单抗新辅助治疗对提高早期TNBC患者生存率的重要性。
个人观点
无论是胰腺癌、胆管癌,还是本次介绍的TNBC,系统性治疗药物进展是非常艰难的。惯常采用的突破性疗法的选择必然是在较少治疗进展的后线,或顽疾。而后线治疗想要获得阳性结果,可谓是艰难的。
而鉴于免疫已经拓展到其他实体瘤围手术期的当下,联合标准化疗方案在新辅助和辅助阶段进行TNBC拓展,从现有理论来讲,能够发挥免疫长期获益的优势,也能保证成功的可能性,虽然一定会有些胜之不武的争议,但进步惯常都是从跬步积累开始的。像DS-8201的划时代产品,还是难。但DS-8201在药物进展迅速的Her2阳性乳腺癌领域的探索,也是从后线向一线进行的拓展,同时,也有值得借鉴之处:
——TNBC 中国市场规模——
三阴性乳腺癌(TNBC)在乳腺癌中的占比为 15%,全球TNBC发病人数由 2015 年的29.4万人增加至2019年的32.0万人,年复合增长率为 2.1%。
中国TNBC发病人数在 2015 年到 2019 年以 1.8%的年复合增长率由 4.6 万人增加至 4.9 万人。预计到 2024 年新发人数将达到 5.3 万,其复合年增长率为1.5%。新发人数将以 1.0%的复合年增长率持续增长,并于 2030 年达到 5.6 万。
整体而言,发病率并不高。以此小适应症为主要的临床试验选择,也是期望通过突破性研究获得快速审批。
中国三阴性乳腺癌新发病人数,2015-2030E

让我们接下来看下中国TNBC市场规模,在 2015 年的市场规模为 32 亿元人民币,并在 2019 年增长至 46 亿元人民币。目前中国有 PARP 抑制剂(在卵巢癌的治疗方面,PARP 抑制剂令人期待)、 PD-1/L1 等靶向治疗和免疫治疗产品正处于临床阶段,预计随着新型疗法的不断获批,未来三阴性乳腺癌药物市场在2024 年达 63 亿元人民币, 2030 年达 103 亿元人民币,期间年复合增长率为 8.7%。

目前,TNBC侵袭性强,易转移,预后极差,确诊后的生存期通常不超过20个月,5年生存率不足15%。TNBC对激素疗法和靶向治疗都不敏感,一般按照预后较差的乳腺癌进行常规治疗,标准疗法是术后使用含有蒽环类或紫杉醇类的新辅助化疗。由于TNBC患者的ER受体、PR受体或HER2受体存在多种亚型,即便是同一治疗方案,不同患者的应答水平也有很大差异大,而且多数患者很快会产生耐药性。
所以,针对于TNBC的治疗,仍然任重道远。
参考文献
1、Cell 186, April 13, 2023
2、Larissa A. Korde, Mark R. Somerfield, Dawn L. Hershman, et al. Use of Immune Checkpoint Inhibitor Pembrolizumab in the Treatment of High-Risk, Early-Stage Triple-Negative Breast Cancer: ASCO Guideline Rapid Recommendation Update. DOI: 10.1200/JCO.22.00503 Journal of Clinical Oncology
3、Lajos Pusztai, Carsten Denkert, Joyce O'Shaughnessy, et al. Event-free survival by residual cancer burden after neoadjuvant pembrolizumab + chemotherapy versus placebo + chemotherapy for early TNBC: Exploratory analysis from KEYNOTE-522. J Clin Oncol 40, 2022 (suppl 16; abstr 503). DOI: 10.1200/JCO.2022.40.16_suppl.503
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)