2023-05-09 来源 : VIP说
前 言
卵巢癌是全球第三常见和最致命的妇科恶性肿瘤,2020年全球有313959例新诊断和207252例死亡[1]。上皮性卵巢癌是卵巢癌最常见的亚型,可分为高级别卵巢癌(HGSOC)、子宫内膜样癌、透明细胞癌、黏液癌和低级别浆液性癌。其中,HGSOC是最常见的,已被证明与70% ~ 80%的卵巢癌患者死亡相关,平均5年生存率低于50%,中位总生存期(OS)为40.7个月[2, 3]。
卵巢癌一线治疗的反应率为75% - 80%。然而,70%的肿瘤会复发并最终成为铂类耐药。此外,约20%的患者对一线铂类治疗无应答,被认为是原发性铂类难治性。目前,铂类耐药卵巢癌(PROC)的标准治疗是序贯非铂类单药化疗或纳入临床试验。非铂类化疗的客观缓解率低(ORRs, <12%),较短的无进展生存期(PFS, <4mo)和总生存期(OS, <4mo),以及显著的不良反应[4, 5]。
PROC治疗的演变和最新进展
近年来针对铂耐药卵巢癌的III期临床试验疗效有限,需要解决PROC患者的迫切和未满足的需求。AURELIA研究排除了接受过2次以上全身治疗的患者。本试验中的大多数患者(58%)之前接受过一线治疗,只有7% ~ 8%的入组患者之前接受过抗血管生成治疗,贝伐珠单抗联合化疗的ORR为30.9%(化疗组为12.6%),达到主要终点的中位PFS为6.7个月(化疗组为3.4个月)[6]。
最初,PARP抑制剂基于可接受的缓解率(33% ~ 41%)被批准用于PROC,近期的分析提示,接受PARP抑制剂单药治疗的复发性卵巢癌患者与接受化疗的患者相比,有潜在的OS损害。这促使奥拉帕利、鲁卡帕利和尼拉帕利单药治疗二线以上复发性卵巢癌的适应证自愿退出。总之,近期PARP抑制剂治疗适应证在复发性PROC患者中的撤药,以及PARP抑制剂在一线维持治疗中取得的较大成功,进一步限制了PROC患者的可选方案[7, 8]。
在一项随机临床试验(RCT)中,与化疗相比,DNA RNA合成结合剂Lurbinectedin也不具有临床优势。Lurbinectedin抑制致癌转录,其活性在精通核苷酸切除修复的癌细胞中增强,而这些癌细胞通常对铂类药物更有耐药性。III期CORAIL试验是基于II期中有前景的临床前证据和令人鼓舞的疗效结果(lurbinectedin vs. 拓扑替康)进行的。不幸的是,与拓扑替康或PLD相比,中位PFS(3.5 vs 3.6mo)和中位OS(11.4 vs 10.9mo)均未显示lurbinectedin改善。并且有较高比例的患者在之前的铂类治疗后不久未出现缓解或癌症进展[5, 9]。
免疫疗法虽然对许多其他实体恶性肿瘤有效,但迄今在卵巢癌中的前景较差。JAVELIN在铂类耐药或铂类难治性卵巢癌患者中评估了PD-L1抑制剂阿维鲁单抗(avelumab)单药治疗或与PLD联合治疗,结果表明与PLD单独治疗相比,阿维鲁单抗与PLD联合治疗未改善PFS(中位数3.7个月vs 3.5个月)或OS(中位数15.7个月vs 13.1个月)。与任一PLD治疗组相比,阿维鲁单抗单药治疗导致较差的PFS(中位1.9个月)和OS(中位11.8个月)[10]。在NINJA试验中,与吉西他滨或PLD相比,纳武利尤单抗(nivolumab)单药治疗的结果同样令人失望,PFS(中位数2.0个月对3.8个月)或OS(中位数10.1个月对12.1个月)无改善[11]。
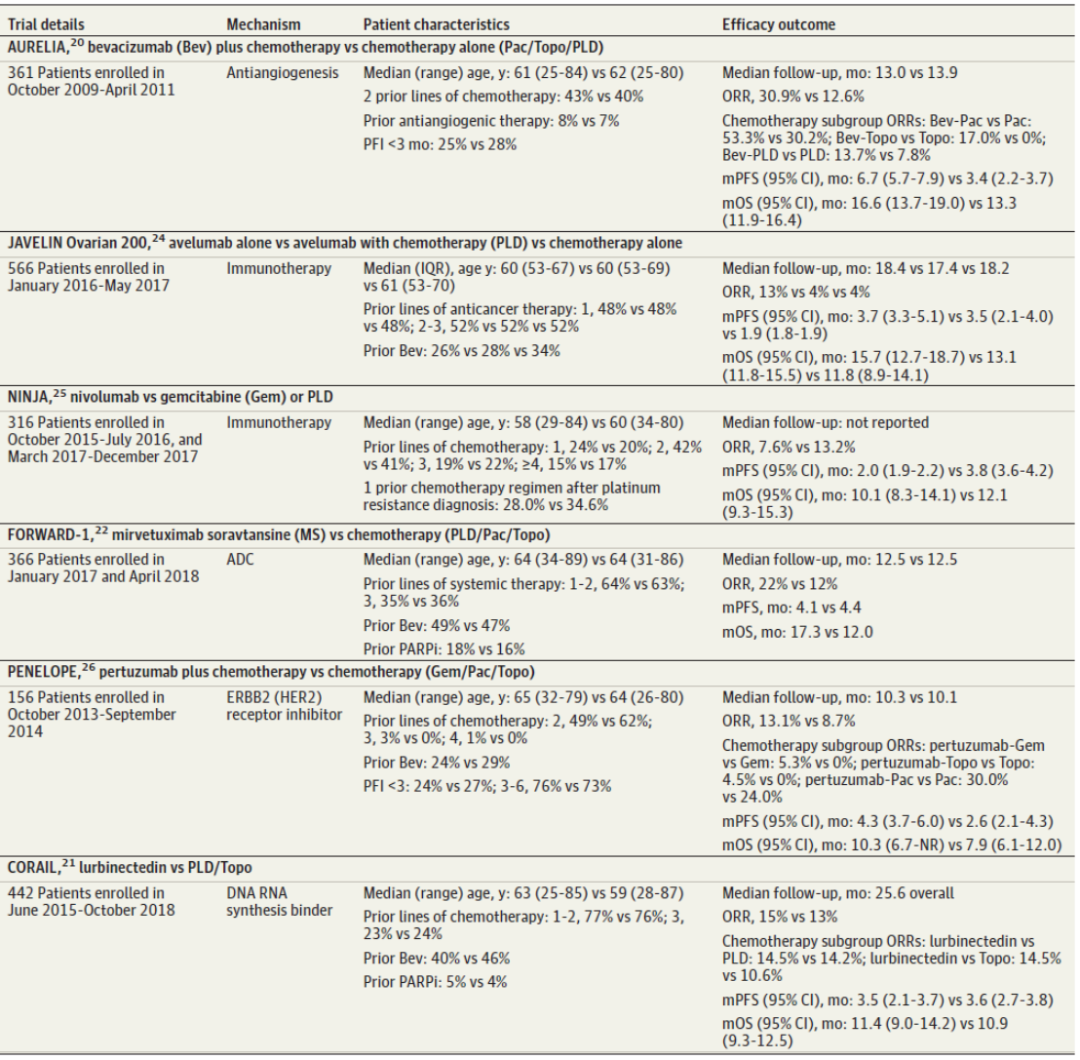
表1. 铂耐药卵巢癌的III期随机临床试验(RCT)
PROC潜力治疗策略-抗体药物偶联物(ADC)
抗体药物偶联物是治疗卵巢癌的一类新兴药物,因其能够识别生物标志物定义的治疗应答概率较高的患者亚组而受到特别关注。鉴于ADC使用与有效载荷偶联的单克隆抗体,因此它们可向肿瘤细胞递送强效的细胞毒性药物。与传统化疗药物相比,这种优化的靶向给药可以扩大治疗指数[12]。此外,ADC的结构(包含抗体、连接子和药物部分)为我们提供了创新的机会,我们可以通过优化每个成分来提高疗效,同时降低毒性作用。
Mirvetuximab soravtansine获得批准的依据是在FRα高表达(免疫组化比例评分≥2)的PROC患者中进行的单臂III期SORAYA RCT。在SORAYA试验中,mirvetuximab soravtansine达到了32.4%的ORR(完全缓解率)、4.3个月的PFS和13.8个月的OS[13]。MIRASOL确证性III期RCT (NCT04209855)目前正在评估mirvetuximab soravtansine对FRα高表达PROC患者的疗效。 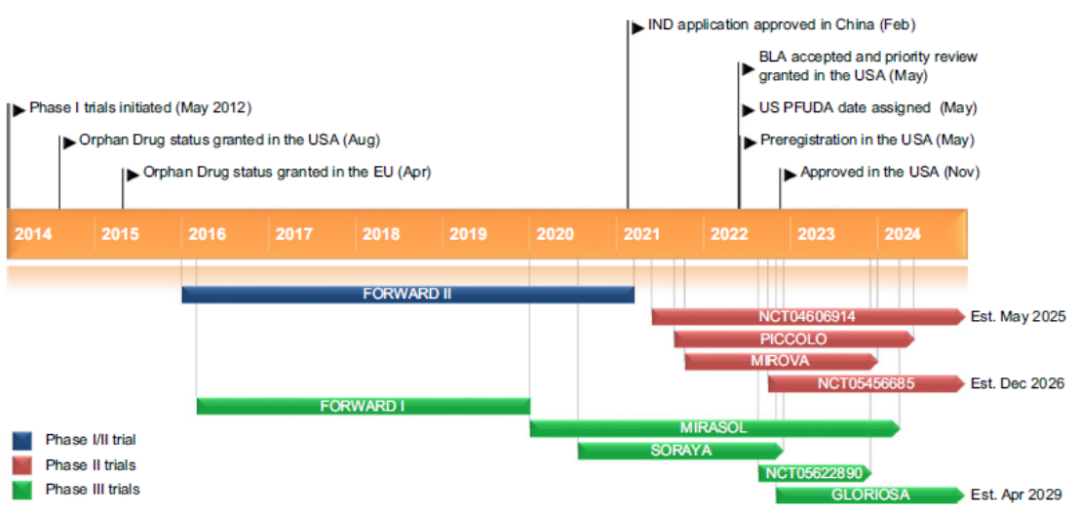
图1. Mirvetuximab Soravtansine治疗既往接受过1 ~ 3种全身性治疗方案的FRα阳性、铂类耐药上皮性卵巢癌、输卵管癌或原发性腹膜癌的关键里程碑
表2. Mirvetuximab Soravtansine的临床研究布局
STRO-002在FolRα选择的患者中观察到有意义的临床益处(TPS > 25%,约占晚期卵巢癌患者的 80%),总缓解率 (ORR) 为37.5%,中位缓解持续时间(mDOR)为5.5个月,中位无进展生存期(mPFS)为6.1个月。同时5.2mg/kg的较高起始剂量比4.3mg/kg的剂量可提供更大的患者益处,接受较高剂量的患者对治疗的反应更快,平均为6.3周,低剂量组平均为11.4周。[14]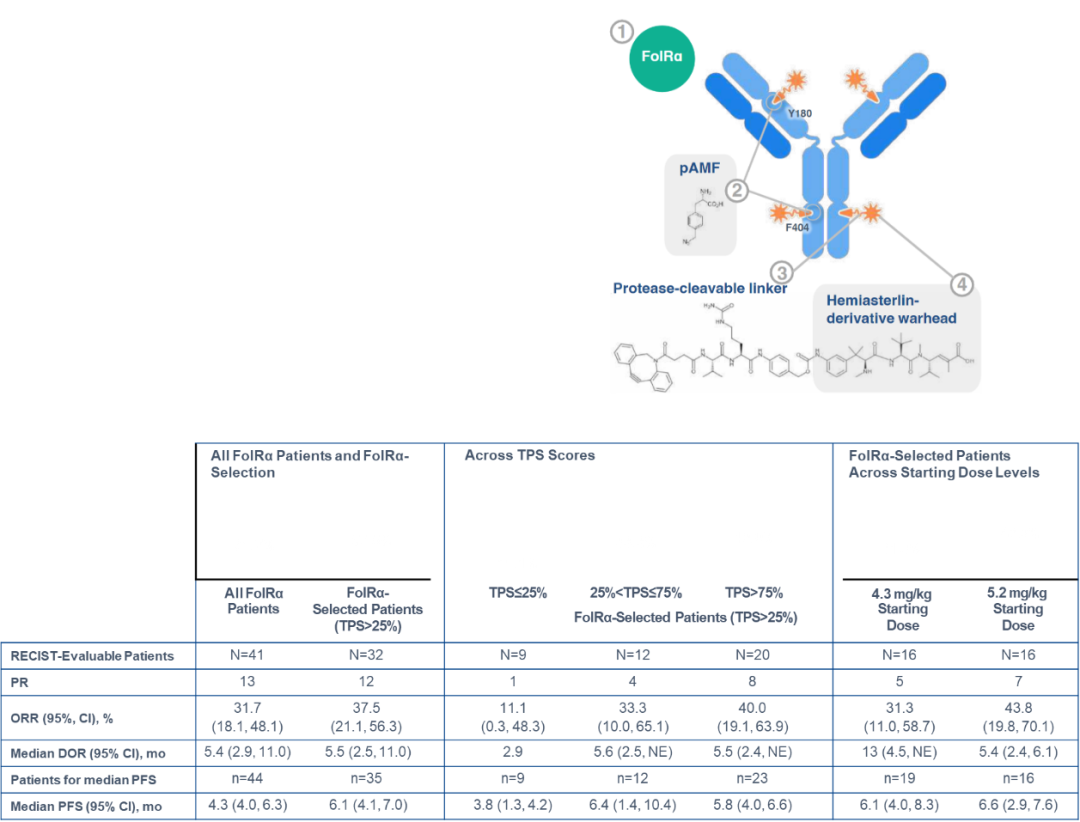
MORAb-202在PROC人群中,0.9 mg/kg和1.2 mg/kg剂量均显示出抗肿瘤活性。虽然患者数量较少,但无论FRα表达水平如何,均观察到疗效。第1组和第2组的ORR分别为25.0%和52.4%。[15]
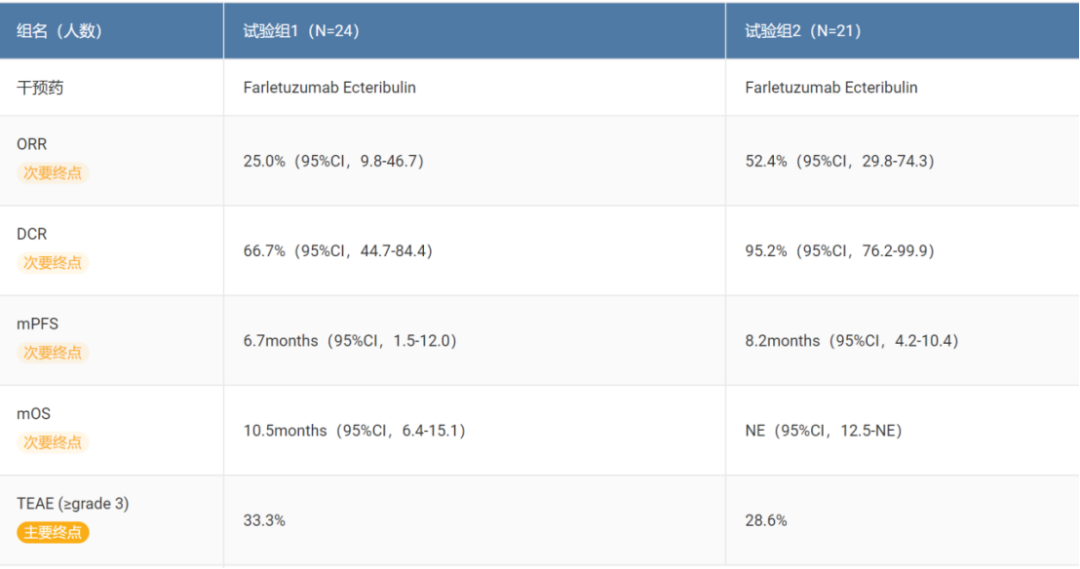
表4. Farletuzumab Ecteribulin(MORAb-202)I期数据
尽管在确定PROC的新治疗方案方面存在困难,但对于新型靶向治疗可能带来有临床意义的获益,仍然保持乐观态度。改善患者选择和个性化治疗的策略是一个重要的关注领域,这将取决于识别有效的生物标志物,这些标志物在卵巢癌和正常组织中有差异表达。如前所述,生物标志物导向的ADC正在研究中,并在确定的PROC患者亚组中获得令人鼓舞的结果,识别更多的生物标志物和开发用于生物标志物检测的优化诊断方法是未来PROC研究的重要焦点。
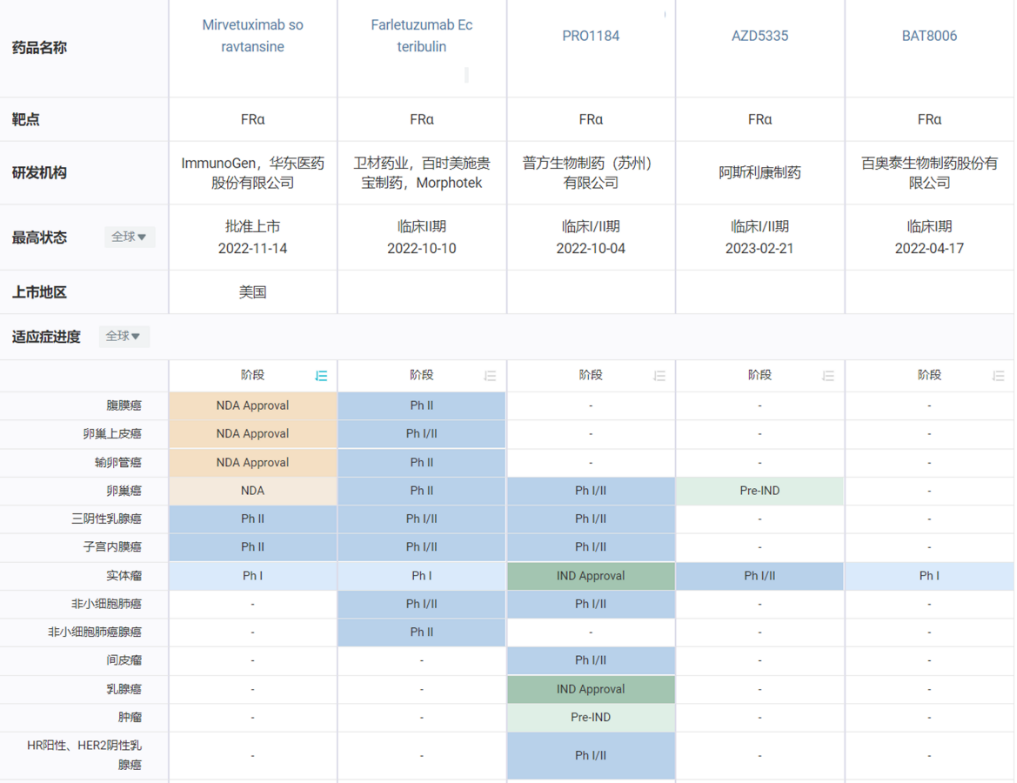 表5. FRα-ADC药物研究对比
表5. FRα-ADC药物研究对比
关于FRα作为癌症患者的治疗靶点
迄今为止,FRα靶向治疗的研究结果不一。研发抗体(如farletuzumab)的早期尝试导致了令人失望的结果,这可能反映出FRα在癌症组织中缺乏必要的生理作用。然而,我们从这些研究中吸取了重要教训,包括使用抗体靶向FRα是安全的,并且这些药物能够优先定位于肿瘤组织。目前基于抗体的方法令人兴奋,并推动了ADC(如mirvetuximab soravtansine)的开发上市,另外一些药物也正在接近预期的试验终点,并且根据之前失败的试验,利用优化的免疫组化生物标志物临界值很可能实现这一目标。迄今设计用于研究FRα表达的预测性生物标志物主要集中于影像学和免疫组化,但FRα也可以从肿瘤细胞脱落,并在循环中检测到[16]。在血液样本中检测和测量FRα在技术上是可行的,但在将这一方法应用于临床之前,还需要进行大量研究来了解循环中这一生物标志物水平与肿瘤体积和/或肿瘤FRα表达程度的相关性。
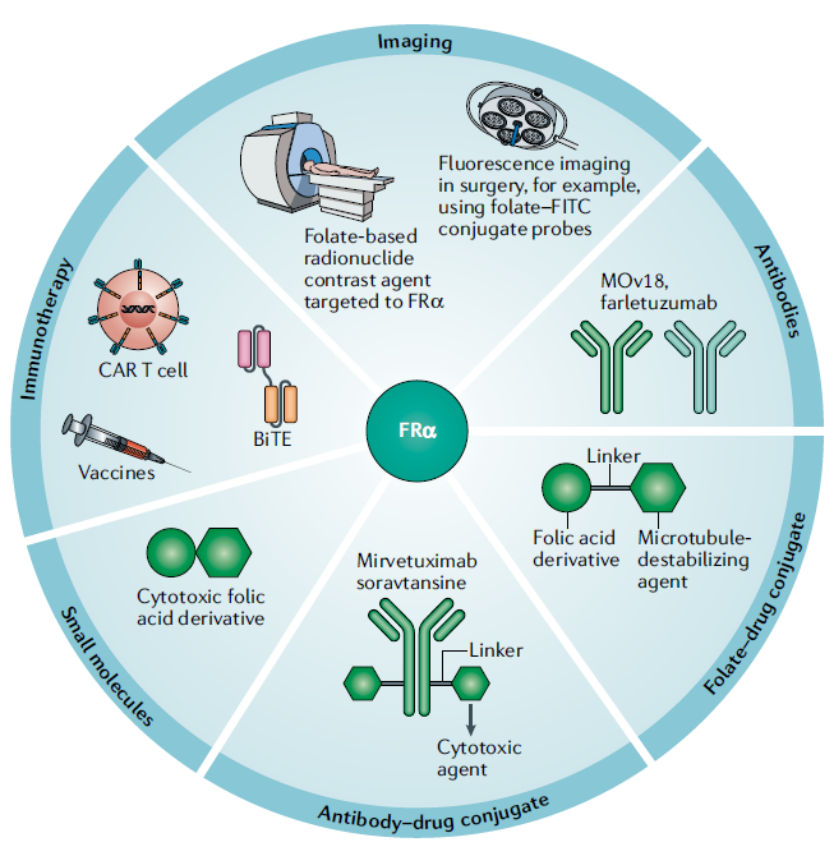 图2. FRα-靶向药物在肿瘤诊疗中的临床应用
图2. FRα-靶向药物在肿瘤诊疗中的临床应用
参考文献
1. Huang J, Chan WC, Ngai CH, Lok V, Zhang L, Lucero-Prisno DE, 3rd, et al. Worldwide Burden, Risk Factors, and Temporal Trends of Ovarian Cancer: A Global Study. Cancers (Basel) 2022; 14(9).
2. Peres LC, Cushing-Haugen KL, Kobel M, Harris HR, Berchuck A, Rossing MA, et al. Invasive Epithelial Ovarian Cancer Survival by Histotype and Disease Stage. J Natl Cancer Inst 2019; 111(1):60-68.
3. Matulonis UA, Sood AK, Fallowfield L, Howitt BE, Sehouli J, Karlan BY. Ovarian cancer. Nat Rev Dis Primers 2016; 2:16061.
4. Colombo N, Sessa C, du Bois A, Ledermann J, McCluggage WG, McNeish I, et al. ESMO-ESGO consensus conference recommendations on ovarian cancer: pathology and molecular biology, early and advanced stages, borderline tumours and recurrent diseasedagger. Ann Oncol 2019; 30(5):672-705.
5. Gaillard S, Oaknin A, Ray-Coquard I, Vergote I, Scambia G, Colombo N, et al. Lurbinectedin versus pegylated liposomal doxorubicin or topotecan in patients with platinum-resistant ovarian cancer: A multicenter, randomized, controlled, open-label phase 3 study (CORAIL). Gynecol Oncol 2021; 163(2):237-245.
6. Pujade-Lauraine E, Hilpert F, Weber B, Reuss A, Poveda A, Kristensen G, et al. Bevacizumab combined with chemotherapy for platinum-resistant recurrent ovarian cancer: The AURELIA open-label randomized phase III trial. J Clin Oncol 2014; 32(13):1302-1308.
7. Moore KN, Secord AA, Geller MA, Miller DS, Cloven N, Fleming GF, et al. Niraparib monotherapy for late-line treatment of ovarian cancer (QUADRA): a multicentre, open-label, single-arm, phase 2 trial. Lancet Oncol 2019; 20(5):636-648.
8. Tew WP, Lacchetti C, Kohn EC, Panel PIitMoOCGE. Poly(ADP-Ribose) Polymerase Inhibitors in the Management of Ovarian Cancer: ASCO Guideline Rapid Recommendation Update. J Clin Oncol 2022; 40(33):3878-3881.
9. Poveda A, Del Campo JM, Ray-Coquard I, Alexandre J, Provansal M, Guerra Alia EM, et al. Phase II randomized study of PM01183 versus topotecan in patients with platinum-resistant/refractory advanced ovarian cancer. Ann Oncol 2017; 28(6):1280-1287.
10. Pujade-Lauraine E, Fujiwara K, Ledermann JA, Oza AM, Kristeleit R, Ray-Coquard IL, et al. Avelumab alone or in combination with chemotherapy versus chemotherapy alone in platinum-resistant or platinum-refractory ovarian cancer (JAVELIN Ovarian 200): an open-label, three-arm, randomised, phase 3 study. Lancet Oncol 2021; 22(7):1034-1046.
11. Hamanishi J, Takeshima N, Katsumata N, Ushijima K, Kimura T, Takeuchi S, et al. Nivolumab Versus Gemcitabine or Pegylated Liposomal Doxorubicin for Patients With Platinum-Resistant Ovarian Cancer: Open-Label, Randomized Trial in Japan (NINJA). J Clin Oncol 2021; 39(33):3671-3681.
12. Khongorzul P, Ling CJ, Khan FU, Ihsan AU, Zhang J. Antibody-Drug Conjugates: A Comprehensive Review. Mol Cancer Res 2020; 18(1):3-19.
13. Matulonis UA, Lorusso D, Oaknin A, Pignata S, Dean A, Denys H, et al. Efficacy and Safety of Mirvetuximab Soravtansine in Patients With Platinum-Resistant Ovarian Cancer With High Folate Receptor Alpha Expression: Results From the SORAYA Study. J Clin Oncol 2023:JCO2201900.
14. Li X, Zhou S, Abrahams CL, Krimm S, Smith J, Bajjuri K, et al. Discovery of STRO-002, a Novel Homogeneous ADC Targeting Folate Receptor Alpha, for the Treatment of Ovarian and Endometrial Cancers. Mol Cancer Ther 2023; 22(2):155-167.
15. Shimizu T, Fujiwara Y, Yonemori K, Koyama T, Sato J, Tamura K, et al. First-in-Human Phase 1 Study of MORAb-202, an Antibody-Drug Conjugate Comprising Farletuzumab Linked to Eribulin Mesylate, in Patients with Folate Receptor-alpha-Positive Advanced Solid Tumors. Clin Cancer Res 2021; 27(14):3905-3915.
16. Kurosaki A, Hasegawa K, Kato T, Abe K, Hanaoka T, Miyara A, et al. Serum folate receptor alpha as a biomarker for ovarian cancer: Implications for diagnosis, prognosis and predicting its local tumor expression. Int J Cancer 2016; 138(8):1994-2002.
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)