2023-05-09 来源 : VIP说
前 言
早期可切除的胰腺癌,首选手术治疗,然而,只有15%-20%的患者有资格接受手术。因此,化疗仍然是局部进展期/转移性胰腺癌患者的主要治疗方式,目前主要一线标准治疗方案为:
AG方案:白蛋白紫杉醇+吉西他滨
但其生存获益远不能满足临床治疗需求。总体而言,需要由患者表现,有效靶点的存在及临床试验的可行性综合评估。与此同时,在化疗领域也取得了一定进展和突破。
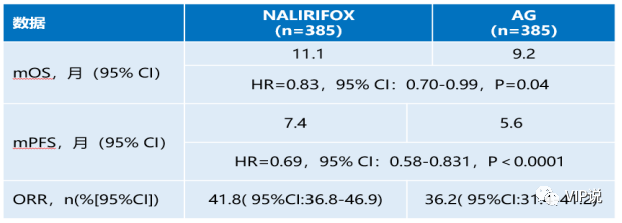
靶向治疗领域不断有新突破
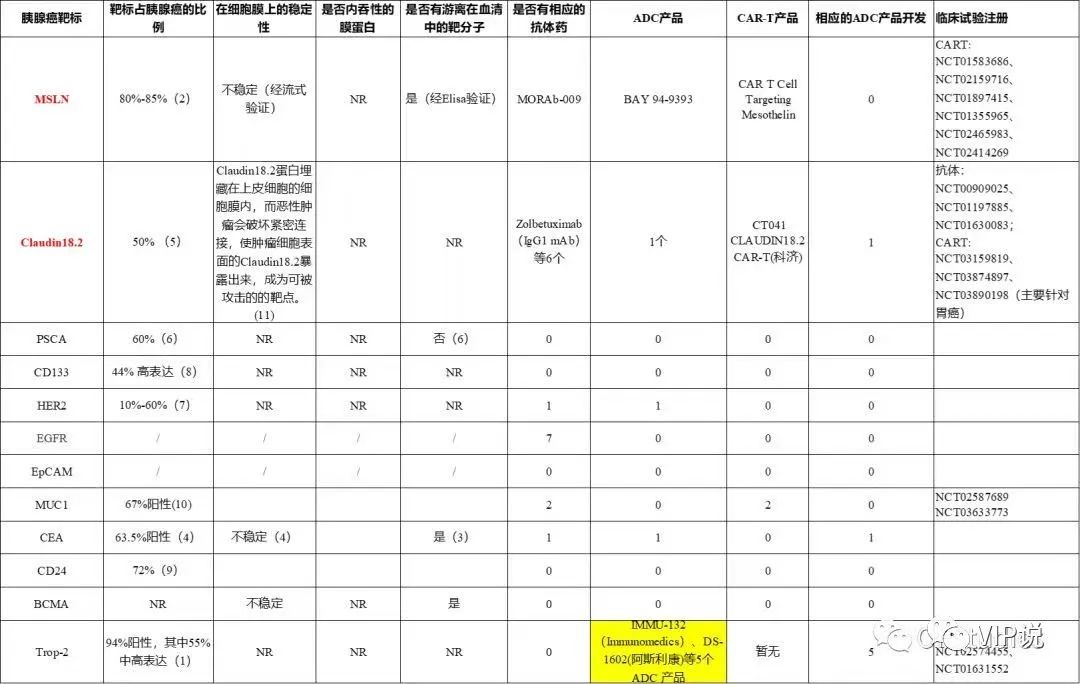
近年来,胰腺癌的精准治疗靶点不断挖掘,KRAS、TP53、CDKN2A和Smad4是四种主要基因突变,另外参与癌细胞中稳定染色质、重塑染色质或编辑点突变的基因,如BRCA、APOBEC和KDM6A也值得研究[3]。目前PARP抑制剂单药治疗胰腺癌已取得一定疗效,虽然BRCA突变概率仅为4%~7%,但有所突破已实属不易,奥拉帕利(Olaparib)和芦卡帕尼(rucaparib)在2022 NCCN指南中都有所提及。BRAFV600E突变和RET基因融合比例较少,仍有待于更高质量的临床研究进行疗效证实。
2022年ASCO GI中公布了一项Ⅰ/Ⅱ期CodeBreak 100研究,针对至少接受一种全身治疗的KRAS G12C突变的晚期胰腺癌患者 [4]。客观有效率(ORR):21.1%,疾病控制率(DCR):84.2%,中位缓解持续时间(DoR):5.7个月,中位PFS:4.0个月,中位OS:6.9个月
Sotorasib打破了KRAS不可成药的困境,对胰腺癌靶向治疗产生了重大意义,未来针对KRAS的研究仍将是研究热点。
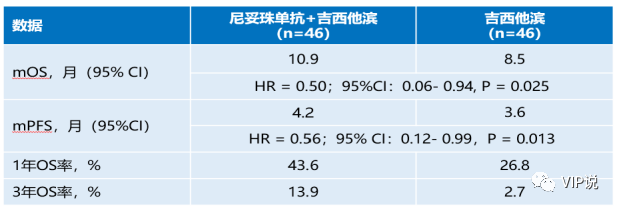
另外,2022 ASCO上公布了一项NOTABLE Ⅲ期研究—尼妥珠单抗联合吉西他滨对比吉西他滨单药一线治疗KRAS野生型的局部晚期或转移性胰腺癌[5]。
免疫联合治疗逐渐成为新方向
免疫治疗已经在许多瘤种中取得了较好的效果,然而胰腺癌患者尚未从中明显获益。鉴于单药治疗效果有限,免疫联合方案或新型免疫治疗药物,有可能成为未来胰腺癌的突破方向。然而免疫联合靶向效果甚微,但免疫联合化疗相较于化疗能够显著延长患者生存期。
2022ASCO公布了一项双抗(KN046)联合化疗(nab紫杉醇+吉西他滨)一线治疗晚期胰腺癌的II期临床研究(NCT04324307):ORR达到45.2%,DCR为93.5%,取得了良好的初步结果。
基于此,中国目前正在进行一项三期关键研究(ENREACH-PDAC-01),以验证KN046联合nab紫杉醇和吉西他滨作为晚期胰腺癌一线治疗的有效性和安全性(NCT05149326)。

炎症和免疫抑制能否带来新希望?
近年来,胰腺癌在多种治疗方式上都取得了不错的成绩,但仍存在着巨大的未被满足的临床需求。胰腺癌属于冷肿瘤,因此可以通过深入研究胰腺癌微环境(TME)特征、改善免疫抑制状态等方式,将肿瘤由‘冷’转‘热’,进一步提高免疫疗效。
胰腺癌TME本质上是由结缔组织增生性间质包围形成的致密基质。间质主要由癌相关的成纤维细胞和细胞外基质组成。基质细胞主要包括胰腺星状细胞、调节性T细胞、髓系抑制细胞(MDSCs)和肿瘤相关巨噬细胞(TAMs)。这些细胞和癌细胞可以分泌细胞外成分,如细胞外基质、基质金属蛋白酶、生长因子和转化生长因子-β以维持微环境。胰腺癌TME有两个主要特征:密集的结缔组织增生和广泛的免疫抑制。这两个特征可以促进胰腺癌细胞的增殖,通过直接抑制抗肿瘤免疫或诱导免疫抑制细胞增殖来逃避免疫监视,在肿瘤进展种起关键作用[6]。因此,研究TME中各成分的作用和改变抑制性免疫微环境对胰腺癌未来的治疗非常重要。

胰腺癌的肿瘤微环境
4月20日,在《Frontiers in Genetics》上发表了一篇Case report: A case study on the treatment using icaritin soft capsules in combination with lenvatinib achieving impressive PR and stage reduction in unresectable locally progressive pancreatic cancer and a literature review. IF=4.772[7]。
01、基本信息
该患者为女性,79岁,入院CT: 胰头部见一软组织肿块影,约57*32mm, CA考虑,SMV受累过度生长,诊断为不可切除的局部进展期胰腺癌。

02、检查及治疗
由于患者拒绝放化疗,并且未进行基因检测,不明确BRAC基因状态,靶向治疗药物不可用;同时,阿可拉定在机制上为广谱类实体瘤免疫调节剂,且既往使用经验良好,安全性佳;同时仑伐替尼在治疗胰腺癌上也有一定数据。因此,推荐仑伐替尼联合阿可拉定。
在两个月的治疗过程中,CA19-9指标数值减半,肿瘤病灶显著缓解,整体明显减少57.5%,血管受累程度降低,患者取得了PR和分期降期的显著疗效。并且治疗期间生命体征平稳,生活质量佳,唯独两次急性胰腺炎发作引起注意。这个病例的治疗使用了一种新型小分子免疫调节剂联合抗血管生成药物,为胰腺癌的治疗提供了新思路。
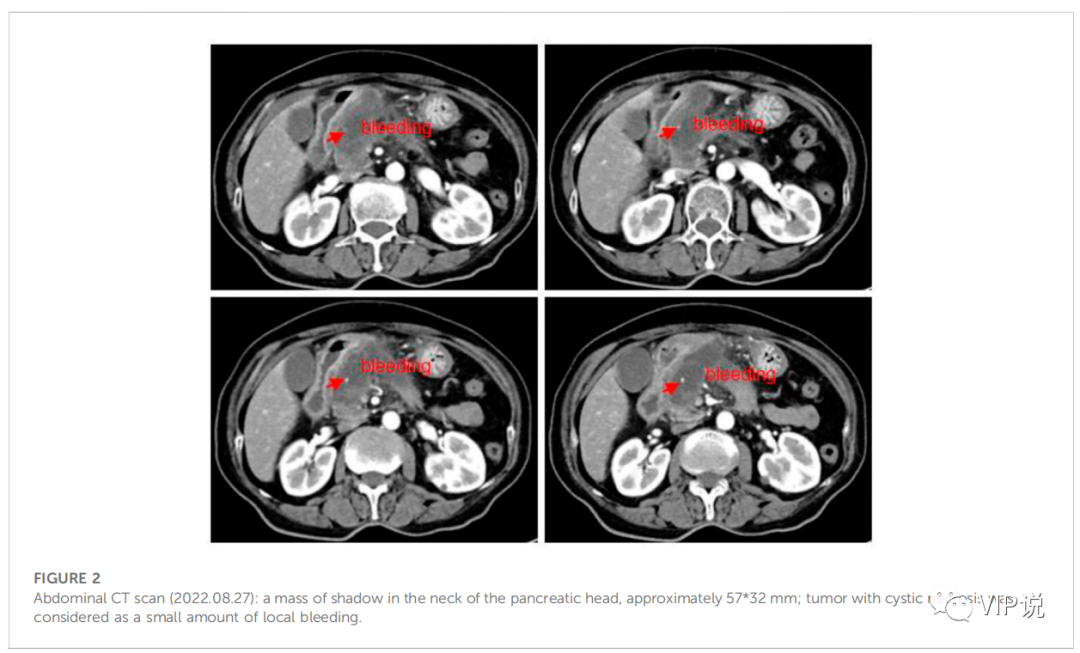


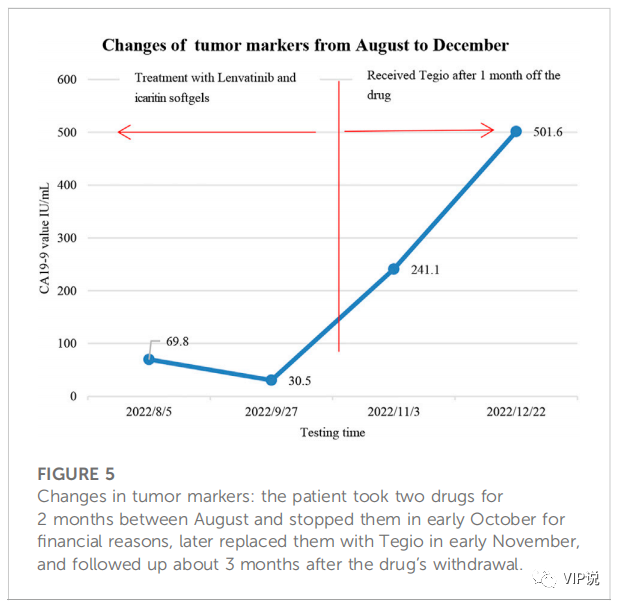
治疗后CT及肿瘤标志物
胰腺癌预后极差,5年生存率极低,其根本原因与特殊的肿瘤微环境密不可分:富含胶原基质并呈免疫抑制性;活化的胰腺星状细胞和成纤维细胞分泌IL-6,IL-1,TGF-β与多种生长因子,作用于自身和肿瘤细胞,促进肿瘤血管生成,促进胰腺增殖、侵袭,加速胰腺癌转移。胰腺癌肿瘤细胞分泌一些分子,比如CCL2和GMCSF,将免疫抑制细胞(TAMs和MDSCs)招募至肿瘤微环境中。此外,成纤维细胞分泌的纤维活化蛋白-a具有免疫抑制作用[8]。因此,减少炎性因子释放,改善免疫抑制性微环境有望对于胰腺癌的治疗发挥有利作用!

03、案例结果讨论
阿可拉定作为全球首个中药提取创新的小分子免疫调节剂,具有独特的免疫调节作用机制!主要通过抑制癌症发生机理中发挥重要作用的IL-6/JAK/STAT3及NF-kB信号通路,直接结合于MyD88和IKKa,减少下游炎性细胞因子IL-6、TNF-a的释放,同时增加CD8+T细胞的表达,降低MDSC、PD-L1等免疫抑制性细胞和因子的表达,以此调节肿瘤微环境,抑制肿瘤细胞生长[9-14]。由此可见,抑制炎性和改善免疫微环境,是靶向以及免疫治疗从机制上无法解决的问题!虽然阿可拉定目前获批适应症为晚期肝癌的一线治疗,但前期不同癌种的基础研究探索充足,具有广泛的抗癌活性,其中也包括胰腺癌,因此对于非肝癌的使用也具有充足理论基础!另外,阿可拉定在III期研究中不良反应发生率极低仅为12.1%, 和靶免及化疗相比安全性优势明显,患者耐受性较好,同时能够显著改善患者的生活质量!
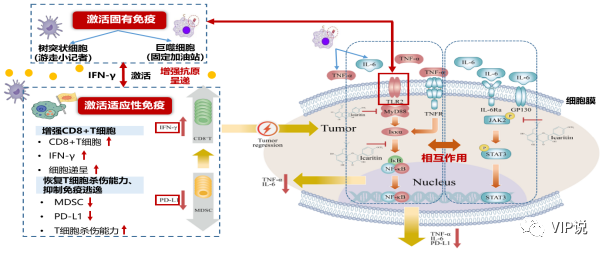
阿可拉定的作用机制
既往研究结果进一步证实,在原位Hepa小鼠中,阿可拉定治疗可增加肿瘤浸润CTL细胞,尤其CD3+CD8+T细胞比例,同时提高CTL表达IFN-γ的能力。另一方面,肿瘤组织中PMN-MDSCs的细胞数量、在CD45+细胞中的百分比及未分裂细胞比例均显著下降。同时,在骨髓来源的巨噬细胞中,阿可拉定可增强M1型、减弱M2型巨噬细胞的基因表达。这些结果都表明阿可拉定可以增强免疫杀伤能力,减弱免疫抑制作用[14],改善抑制性微环境。
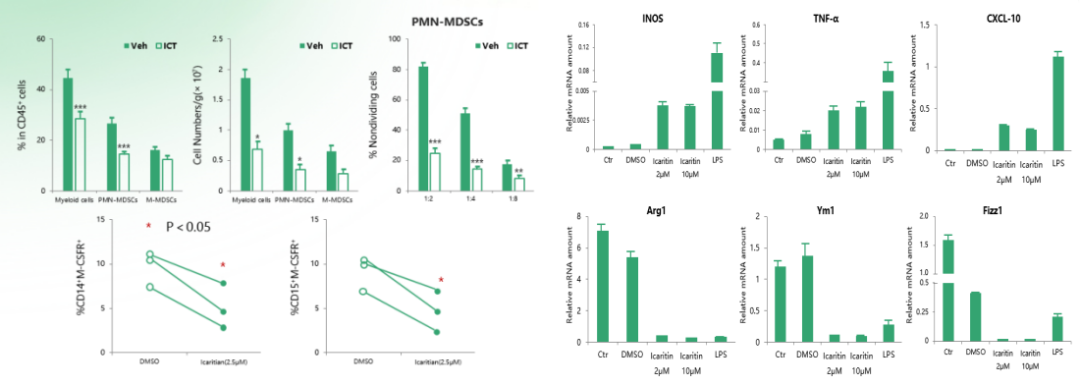 阿可拉定基础研究结果
阿可拉定基础研究结果
另一方面,大多数实体肿瘤产生免疫逃逸与血管异常有关; 因此,抗血管生成药物可以通过使肿瘤血管正常化,将内在的免疫抑制性TME转化为免疫支持性TME,从而促进免疫效应细胞杀伤肿瘤。同时,阿可拉定在激活免疫的效果之上进一步改善胰腺癌免疫抑制性微环境,这是免疫疗法无法达到的。
因此,联合应用抗血管生成治疗和免疫调节剂相较于联合免疫治疗有望进一步提高胰腺癌治疗的有效性,发挥协同抗肿瘤作用的同时有望降低免疫相关不良反应的风险。
随着更多肿瘤驱动基因的发现和新型药物的研究和应用,胰腺癌的治疗和预后有望取得更好效果。肿瘤实际上是一个慢性炎症过程,伴随各种炎症因子的变化。由于既往更注重临床症状、影像表现和血液学检查反映的治疗效果,忽略了肿瘤微环境和炎症因子变化。因此,今后可以通过炎性和免疫微环境入手,同时选择具有安全性优势的药物,对于晚期胰腺癌患者不失为一种更为安全有效的治疗方式!未来采取免疫调节剂联合治疗的策略,比如联合靶向、免疫、化疗等,通过不同作用机制协同增效的角度有望取得更加令人惊喜的治疗效果,让我们拭目以待!
参考文献
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)