2023-06-26 来源 : VIP说
导读
肝细胞癌(HCC)肿瘤微环境的特点是免疫细胞的免疫抑制环境,因此靶向肿瘤微环境的治疗可能是HCC有效治疗策略。阿可拉定通过调节肿瘤微环境治疗HCC疗效显著,但作用机制仍需进一步明确。
2023年5月发表在《Frontiers in Pharmacology》(IF 5.988)上的网络药理学文章“Investigating the effect of Icaritin on hepatocellular carcinoma based on network pharmacology”,本文详细的报道了网络药理学的方法学的建立和结果,研究结果发现阿可拉定可能通过调节FYN基因发挥抗HCC作用。

01 网络药理学的发展
近些年来,在中药的研究中网络药理学的研究应用越来越丰富,通过网络药理学对中药、植物药、动物药、化学药、生物药等药物作用和机制进行分析,可以探究药物分子与生物体内靶点、通路、基因、蛋白质等分子间的相互作用网络,以及这些相互作用对于药物的药效、毒性、代谢等影响。

02肝细胞癌缺乏明确靶点
原发性肝肿瘤是全球第6大常见肿瘤,是肿瘤相关的第3大常见死亡原因。其中肝细胞癌(HCC)占90%[2]。早期HCC以根治性手术切除为主,但其5年复发率仍达到12%。然而,大多数患者临床就诊时已处于中晚期,丧失了HCC根治性切除的时机。
对于不可切除HCC患者其治疗方式主要是局部治疗和系统性治疗,其中局部治疗包括射频消融(RFA)、经肝动脉化疗栓塞术(TACE)、肝动脉持续灌注化疗(HAIC)、内放疗钇[Y90](SIRT)、立体定向放射治疗(SBRT)等。
而系统药物治疗主要包括抗血管靶向药物、免疫治疗、系统性化疗等。HCC病因学机制导致肿瘤微环境具有特殊性和复杂性。肝癌微环境的特点是免疫细胞的免疫抑制环境[3],结构和功能均为异常的肿瘤血管。肝细胞癌病因复杂,缺乏可用于分子靶向治疗的驱动基因靶点,因此改善肝细胞癌免疫微环境是HCC的有效治疗策略。
03阿可拉定作用机制
阿可拉定(淫羊藿素软胶囊)是一种从传统草本中药淫羊藿中提取的单分子(纯度>98%)创新药物,具有免疫调节抗肿瘤作用。

临床前研究证实阿可拉定可以通过下调TNF-α、IL-6、PD-L1等表达发挥抗肿瘤作用[4-7]。此外阿可拉定还可以调节肿瘤免疫微环境,下调巨噬细胞中TNF-α和IL-6的分泌量,降低MDSC细胞比例恢复T细胞肿瘤杀伤功能,提高CD8+T细胞的数量和比例,恢复CD8+T细胞产生IFN-γ的能力,从而抑制肿瘤生长。
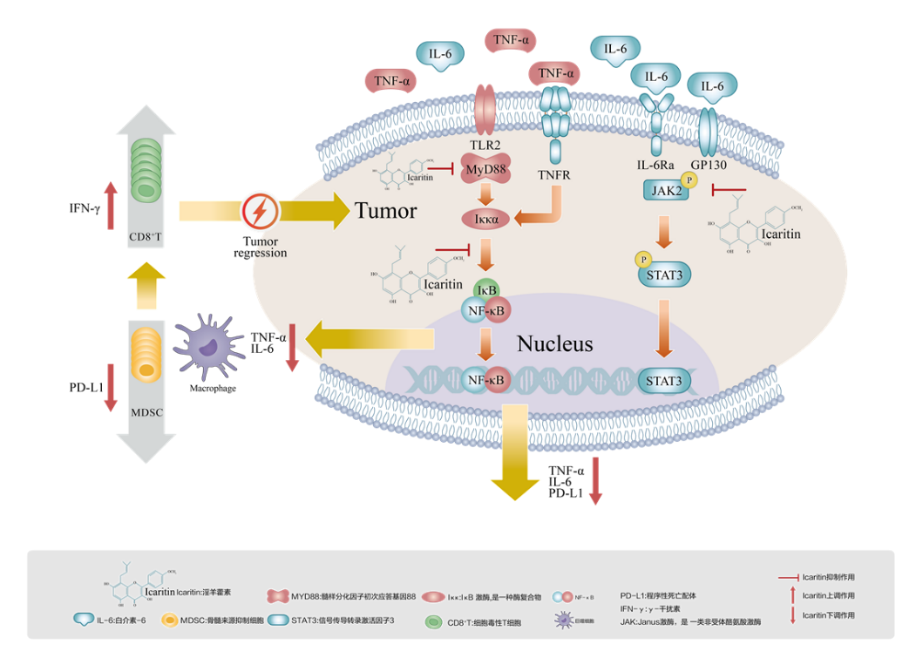
淫羊藿素此项适应证的获批是基于Ⅲ期临床研究[8],该研究共纳入了来自全国28家中心的280例未经系统治疗的晚期HCC患者。截至2020年11月2日的中期分析数据显示,在富集人群中,主要终点总生存期(OS)方面,相较于对照组,淫羊藿素组显著延长[中位值:13.54个月对6.87个月,风险比(HR)=0.43, P=0.0092],死亡风险降低57%;且疾病进展后继续接受研究药物治疗方案,淫羊藿素组中位OS仍显著优于对照组(18.97个月对11.43个月,HR=0.14, P=0.0094),死亡风险降低86%,可带来持续生存获益。
阿可拉定在治疗肝细胞癌 (HCC) 方面显示出良好的前景,体外和临床研究显示对HCC细胞的生长有强烈的抑制作用,然而其抗HCC活性的精准机制需要进一步研究。
04给予网络药理学研究阿可拉定对肝细胞癌的作用
为了研究阿可拉定对HCC的潜在分子机制,本研究采用了药物组学和蛋白质组学方法探索阿可拉定对HCC的靶向作用和分子作用机制。
药物组学方法学建立
药物组学的构建包括了阿可拉定在人源基因组中潜在靶标、HCC相关的靶标,然后将阿可拉定靶点和肝癌疾病靶点进行交集,得到了阿可拉定的抗HCC靶点。随后利用Maximal Clique Centrality (MCC) 方法对核心靶点 (核心基因) 进行筛选。
采用DAVID工具对阿可拉定的治疗HCC靶点做了富集研究,包括Gene Ontology (GO) 分析和Kyoto Encyclopedia of Genes and Genomes (KEGG) ,其中GO分析涵盖cellular components (CC) 、molecular functions (ME) biological processes (BP)。蛋白分子对接通过将阿可拉定与核心靶标进行分子对接,选择最低能量结合的模式进行进一步分析,并使用PyMOL软件将相互作用可视化为2D图。
在分子动力学模拟中,对选定的蛋白质-配体复合物进行了20ns的分子动力学模拟,以确定结合亲和力。使用Charmm36 force field生成蛋白质拓扑结构,使用CGenFF 构建配体拓扑结构。随后进行能量最小化、加热和平步骤,然后进行20 ns的分子动力学生产运行。轨迹被用于动力学研究和用MM/PBSA 进行蛋白质-配体自由能计算。
蛋白质组学方法学建立
将小鼠模型中接受阿可拉定治疗组和对照组的肿瘤样本均质化处理后,每组的蛋白质样本经处理后用数据依赖的采集模式进行分析。随后进行定量实时聚合酶链反应(gPCR) 分析,在PCR系统上使用特定的SYBR Green基因表达检测 (Applied Biosystems,#4309155) 对FYN基因和内源性对照 (ACTB) 进行定量实时PCR,最后将数据和内源性对照进行标准化。qPCR结果显示三只小鼠中FYN和PIK3R1的平均RNA表达水平。最后通过蛋白免疫印迹( Western Blot)将对目标蛋白进行检测、分析以及定量。
研究结果:
阿可拉定的分子结构见图1。网络药理学研究通过采用Venn图,发现283个潜在的阿可拉定靶点和7704个肝细胞癌 (HCC) 靶点相交,共产生222个相交的靶点 (图2)。这些靶点代表了阿可拉定潜在的抗HCC靶点。
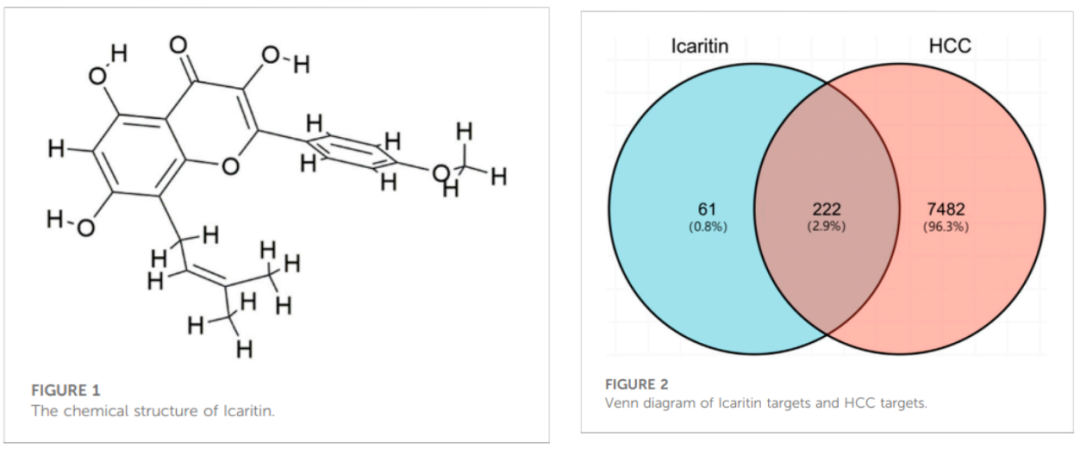
图1 图2
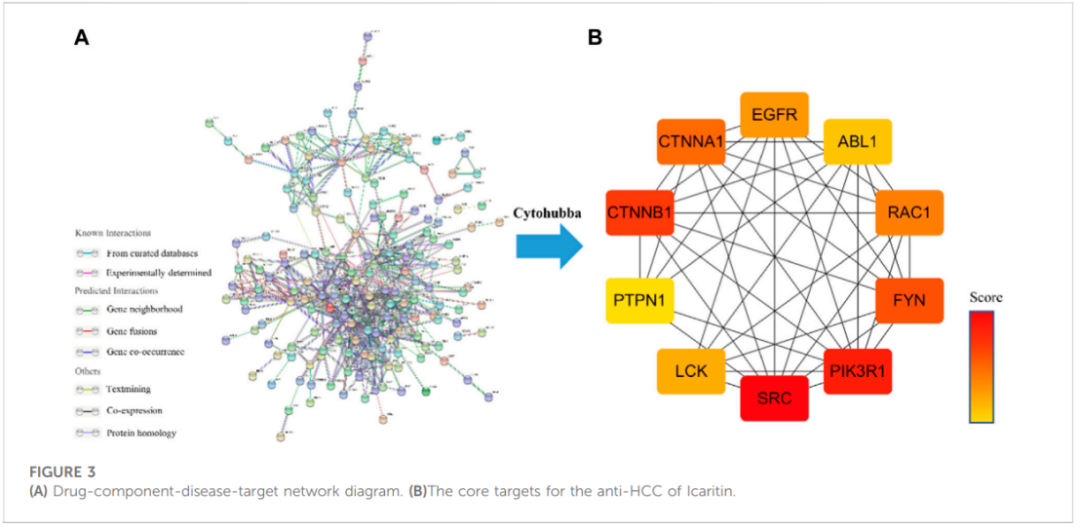
构建蛋白质-蛋白质相互作用(PPI)网络并确定阿可拉定抗HCC的核心靶标
阿可拉定的抗HCC靶点的PPI网络,包含132个nodes和 554 edges(图3A)。利用 Cytoscape 3.7.2中的cytoHubba和Matthews Correlation Coeficient (MCC) 方法进行筛选,确定了10个核心靶点(图3B) ,特别是SRC、PIK3R1、CINNB1、FYNCTNNA1、RAC1、EGFR、LCK、ABL1和PTPN1。
05中医药预防和治疗irAE的作用
阿可拉定抗HCC靶点的Gene Ontology(GO)富集性分析
抗HCC目标的主要生物过程涉及蛋白质磷酸化、肚基酪氨酸磷酸化、类固醇代谢、蛋白质的自磷酸化和蛋白激酶B信号通路的正向调节。细胞的主要成分是细胞膜、细胞核、细胞质、受体复合体和核质体。其分子功能包括RNA聚合酶II转录因子活性、配体激活的序列特异性DNA结合、蛋白激酶的活性、跨膜受体蛋白酪氨酸激酶活性和ATP结合(见图4A)。
阿可拉定抗HCC靶点的KEGG通路分析
阿可拉定发挥其抗HCC作用的主要途径包括癌症通路,PI3K-Akt信号通路,MAPK信号通路,对表皮生长因子受体酪氨酸激酶抑制剂的耐药机制,以及HCC通路。这些通路表明,阿可拉定具有治疗HCC的潜力。图4B显示了阿可拉定抗HCC靶点的KEGG通路分析。

图4A和4B
分子对接
阿可拉定与九个核心目标进行了分子对接,不包括CTNNA1,因为它缺乏含配体的晶体复合结构。阿可拉定对FYN、EGFR和LCK表现出很强的结合活性,阿可拉定和核心目标的分子对接图见图5。
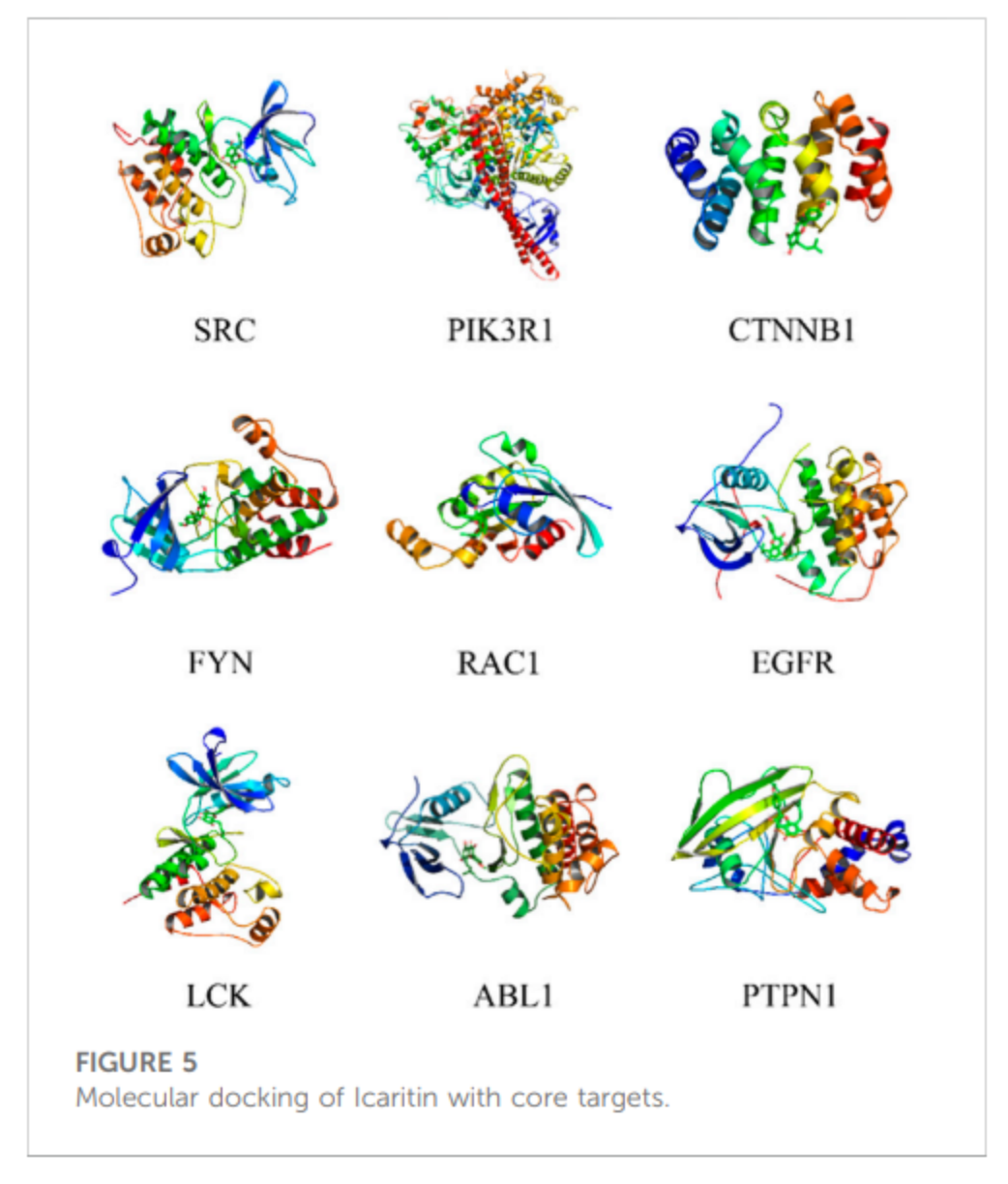
图5
分子动力学模拟
选择阿可拉定-FYN对接复合物进行分子动力学模拟,因为它的结合能最低。这些模拟支持了分子对接的结果,并阐明了蛋白质-配体之间的动态相互作用。RMSD图显示了整个模拟过程中阿可拉定-FYN复合物的稳定性 (图6A)同时,RMSF显示蛋白质残基的波动相对有限 (图6B) 。
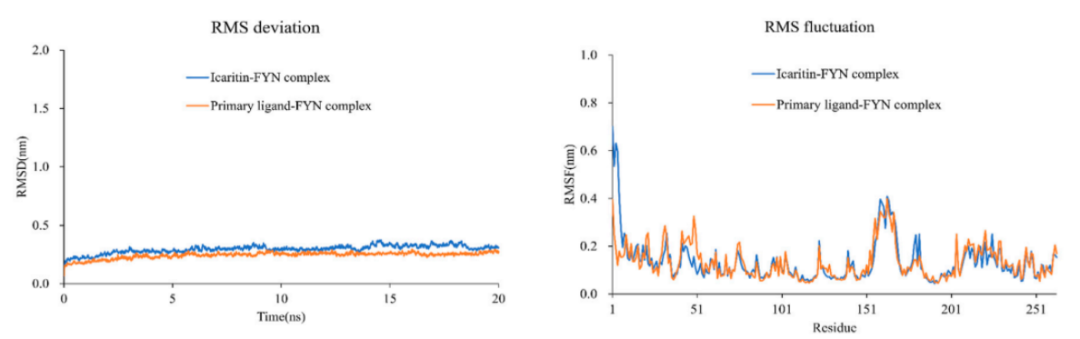
图6A 图6B
05体内试验和体外试验
体内实验
阿可拉定治疗组的肿瘤明显比对照组小(图7A)。对两组的肿瘤组织进行了靶向蛋白质组学分析。图7B显示了预测的阿可拉定靶向蛋白表达的热力图,它显示了阿可拉定治疗组中FYN蛋白的明显上调,并且具有很好的重复性。此外,图7C中描述的qPCR结果显示,在阿可拉定治疗组中,FYN基因明显上调。
体外实验
体外验证是用HEPG2细胞进行的。图7E显示了阿可拉定试验组和对照组的细胞集落形成图像,结果显示显示阿可拉定处理的细胞形成的细胞集落数量与对照组相比明显减少。FYN蛋白的表达在两组之间有很大差异,FYN蛋白的表达在阿可拉定组明显上调 (图7D)
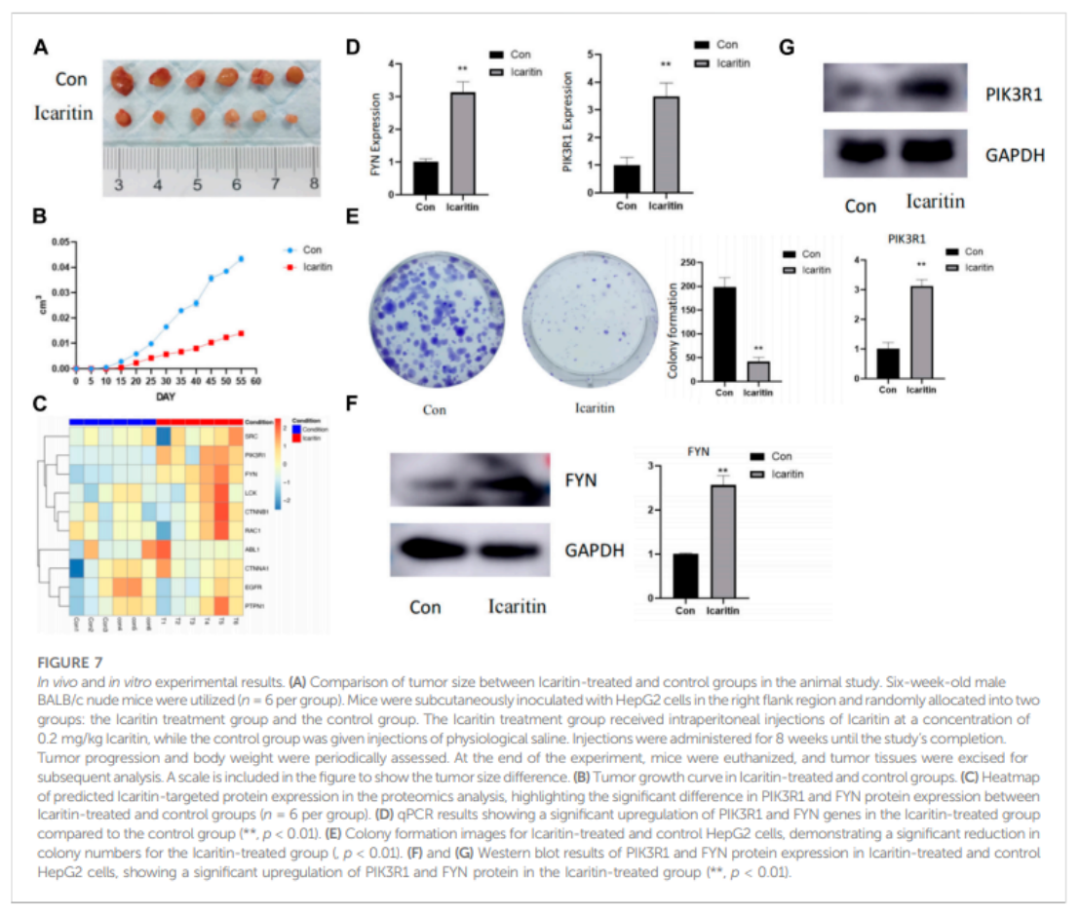
图7
这些靶点参与了各种细胞过程,包括细胞信号传导、粘附、迁移、侵袭和增殖。包括HCC在内,这些靶点的失调与各种癌症发生有关。在这些核心靶点中,FYN与阿可拉定显示出最高的分子对接结合能,这表明FYN可能在阿可拉定的抗HCC活性中发挥了关键作用。
分子对接和随后的分子动力学模拟进一步验证了阿可拉定和核心点之间的相互作用。通过cytohubba计算发现PIK3R1的得分较高,说明PIK3R1处于PPI网络的核心位置,不能真正说明蛋白质之间存在相互作用。
总之,FYN表现出与阿可拉定有很强的结合活性而且得到的复合物比原始配体-FYN复合物具有更高的结合自由能。这些发现表明,FYN可能是阿可拉定对HCC发挥作用的重要靶点。
参考文献
1. 世界中医药学会联合会.网络药理学评价方法指南[J].世界中医药, 2021, 16(4): 527-532. DOI: 10.3969/j.issn.1673-7202.2021.04.001.
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)