2023-07-18

肿瘤的发生发展与肿瘤细胞的代谢重编程相关。肿瘤细胞通过自主改变其各种代谢途径的通量,以满足增加的生物能量和生物合成需求以及减轻癌细胞增殖和存活所需的氧化应激。
癌症驱动突变与可用的环境营养物控制了代谢途径的通量。异常积累的代谢物,也可以促进肿瘤发生。
肿瘤代谢起源于Otto Warburg的研究,Warburg观察到,与正常组织相比,体外癌组织切片即使在有氧的情况下也可利用大量葡萄糖生成乳酸,这种现象称为有氧糖酵解或Warburg效应。

从此,拉开了肿瘤代谢的研究大门。近年来的研究中也发现其他诸多代谢通路包括脂肪酸代谢、胆固醇代谢、谷氨酰胺代谢、丝氨酸代谢、一碳单位代谢、胆碱代谢等,在肿瘤细胞中均发生了重编程变化。
2021年10月,美国西北大学Navdeep S. Chandel团队于《Nature Reviews Cancer》【IF:78.5】杂志发表了一篇关于肿瘤代谢发展前景的重磅综述“Cancer metabolism: looking forward”,该综述全面概况了肿瘤代谢领域的最新研究进展,并特别梳理了肿瘤代谢研究中尚未解决的关键问题。

肿瘤细胞会根据外部营养物质的浓度和不同的应激条件,选择不同的代谢方法产生ATP和生物大分子供自身使用。
这里存在两个关键问题是:(a)肿瘤生长的限速大分子是什么?(b)肿瘤在体内生长必须调用哪些细胞内通路?
最近有两项研究使用了基于CRISPR的体内功能基因组筛选技术,对由致癌基因KRAS和p53缺失驱动的胰腺癌和肺癌进行研究,发现其中最关键的基因与血红素和核苷酸合成相关,而血红素合成是线粒体电子传递链(ETC)功能的必要条件。
因此,人们推测,癌细胞中这些代谢途径是维持核苷酸和血红素合成所必需的,但这一假设需要在不同的肿瘤模型中进行实验验证,因为某些TME中的脂质可用性也可能受到限制。
肿瘤代谢的研究使人们重新开始使用定量方法来检测生理和病理过程中的体内细胞代谢,引导研究人员破译健康组织和肿瘤组织中的合成代谢途径的区别。
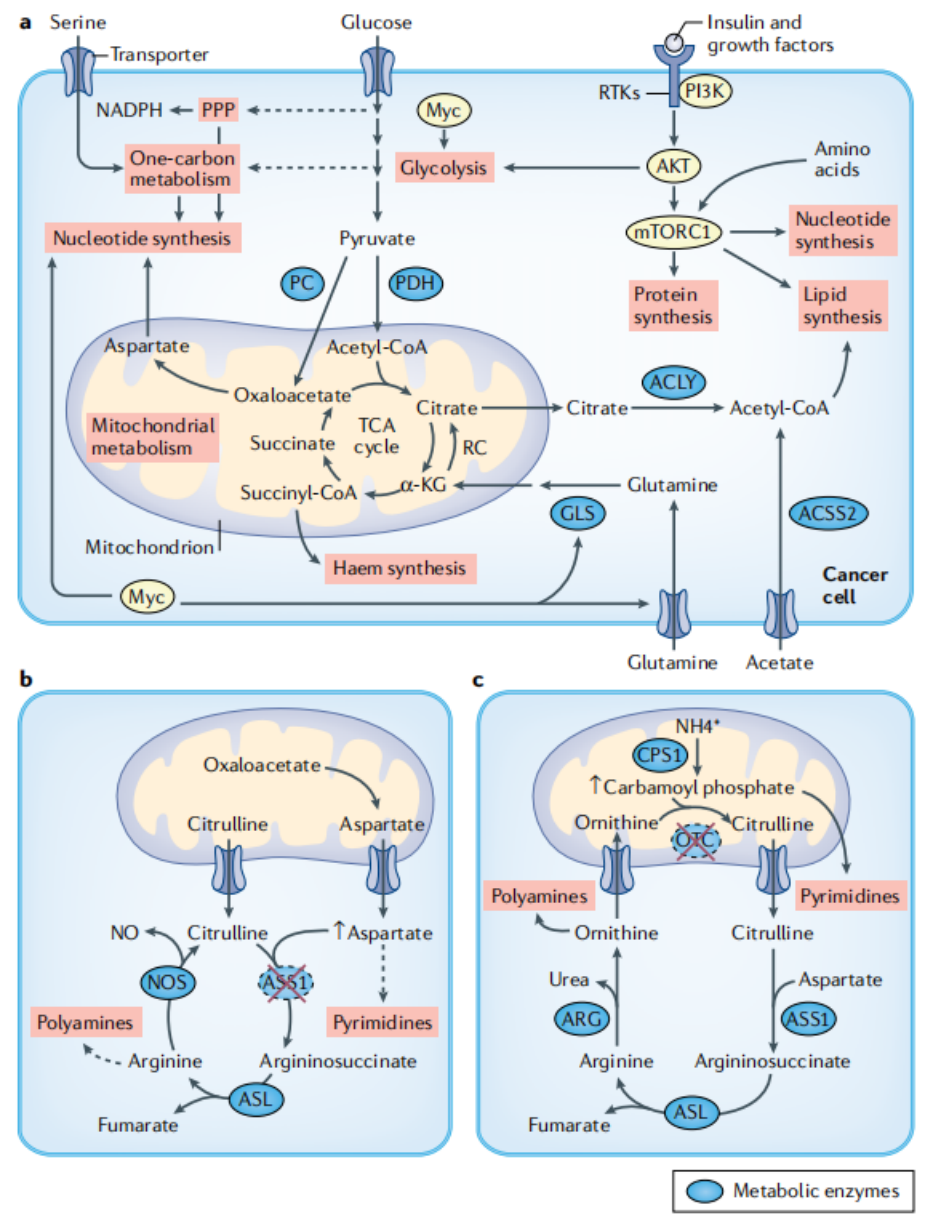
癌细胞通过中间代谢增加代谢通量以维持增殖,从而选择信号通路和转录网络(如PI3K–AKT–mTORC1和MYC)。
目前正在探索的一个关键领域是MYC和mTORC1过度激活导致癌细胞产生代谢脆弱性,因为与非恶性细胞相比,这可能在减少癌细胞增殖和存活方面提供独特的治疗干预。
此外,基于组织的不同环境营养可用性,信号通路的控制方式可能具有器官特异性。因此,研究正常细胞和癌细胞体内的信号和代谢途径,将对体内代谢的调节产生新的见解。
一个悬而未决的问题是琥珀酸、延胡索酸和D-2-羟基戊二酸(D-2HG)或L-2-羟基戊二酸(L-2HG)的积累如何在某些组织中发挥致瘤作用。
将肿瘤代谢物积累与观察到的未分化状态联系起来的具体机制以及肿瘤代谢物如何改变特定组蛋白或特定位点的DNA甲基化以改变基因表达,也尚不完全清楚。

在稳定状态下,活性氧(ROS)水平由清除速率与产生速率决定,而癌细胞中ROS的生成速率比正常细胞高得多。为了控制ROS的破坏性影响,肿瘤细胞利用转录因子NRF2上调抗氧化蛋白,以及激活促进NADPH和GSH产生的信号通路,这是维持某些抗氧化蛋白功能所必需的。
因此,需要开发用于测量不同类型ROS的特异性探针,以及在肿瘤进展过程中特异性调节不同类型ROS的遗传干预,以使癌症中ROS的生物学特性清晰。

当营养素或生长因子不足时,自噬是允许细胞存活和增殖的关键途径之一。在营养缺乏的情况下,AMPK的激活维持了癌细胞的自噬和溶酶体功能。
巨胞饮作用是另一种支持细胞适应营养缺乏的途径,它允许细胞内化细胞外蛋白质和坏死细胞碎片(细胞坏死),并将其输送到溶酶体中降解,从而支持大分子合成并进入中央碳代谢途径。
巨胞饮作用使细胞克服了针对靶向细胞内核苷酸合成的疗法,目前正在努力寻找一种控制癌细胞巨胞饮症的特异蛋白质,这将成为一个有希望的治疗靶点。
除了营养供应和酸性条件变化外,体内TME的另一标志是其由不同细胞类型构成,这有助于控制肿瘤进展。
一个简化模型是内皮细胞和基质细胞支持肿瘤生长,细胞毒性T细胞(CTLs)可减少肿瘤进展,而某些髓系细胞和调节性T细胞可以抑制CTLs以维持肿瘤生长。
癌细胞必须与TME中各种类型细胞竞争营养,确定特定TME中每种细胞类型的特定营养素限制非常重要。
TME中不同细胞类型之间也存在代谢交流,癌细胞利用这种策略在不利条件下持续生长。癌细胞也可通过各种机制逃避CTL介导的杀伤。目前,TME中不同细胞之间代谢物串扰的广度以及TME内许多细胞类型的代谢表型,尚不完全清楚。
目前研究体内肿瘤代谢的一个局限性是无法确定检测到的代谢物信号是否来自肿瘤细胞或TME中的其他细胞。因此,以癌症细胞中的特定代谢途径为治疗靶点,可能会对TME中的其他细胞产生类似或不同的影响,这反过来可能决定治疗效果。

肿瘤细胞转移是导致癌症患者死亡的一大原因之一。
代谢限制被认为是癌细胞转移的障碍,代谢变化与转移相关的每一个连续的多步骤过程相关联,例如:肿瘤细胞对基底膜的侵袭、细胞迁移到周围的血管系统或淋巴系统等。
在原发性肿瘤中,可能存在与转移潜能相关的代谢异质性,使用具有空间分辨率的非侵入性技术可进行评估。因此,破译细胞转移和定植于远端部位的代谢脆弱性至关重要。
未来几年,人们将重点关注对原发性生长是非必需但对肿瘤细胞转移是必需的代谢途径。
与原发肿瘤相比,尚不完全了解哪些代谢物控制支持远端转移生态位生长的信号通路。关于代谢如何促进转移的不同步骤还有待研究。
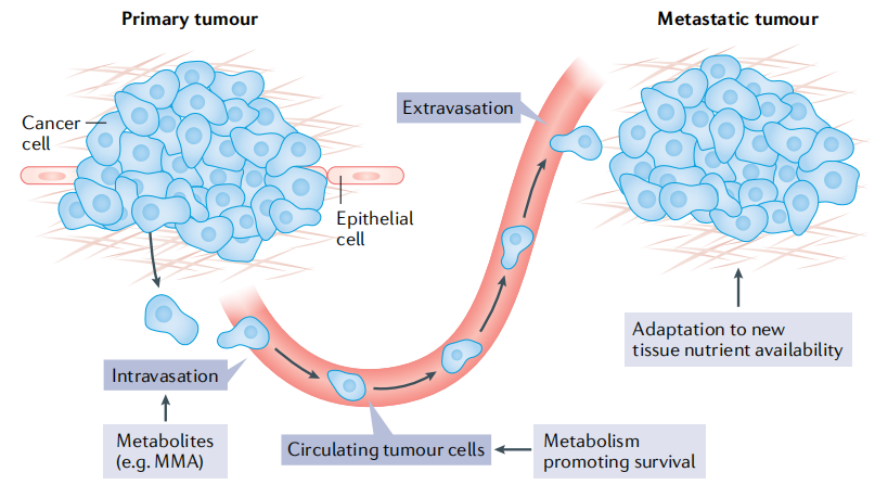
肿瘤代谢可以有效促进肿瘤细胞的增殖、生长、迁移和侵袭等关键的生物学过程。那么,通过抑制肿瘤细胞的代谢途径,可以有效地阻止肿瘤的发生和发展。靶向肿瘤代谢成为一种有前途的抗癌策略。
代谢酶是癌症治疗中有吸引力的治疗靶点,但由于对正常组织的毒性等多种原因,针对代谢的新药一直很少。
多项研究表明,在体内肿瘤进展和转移过程中,多种癌症对特定抗氧化剂“成瘾”,从而导致肿瘤进展和转移。一个巨大的挑战是确定是否存在一个治疗窗口,允许选择性靶向对正常组织毒性最小的特定抗氧化蛋白。
总的来说,靶向代谢需要一种“个性化医学”方法来定义确定癌细胞或机体代谢靶点。

癌症代谢领域已经从简单的Warburg效应模型发展到对肿瘤代谢复杂性的认识。
人们已经认识到TME施加的代谢限制以及TME内不同细胞组成是如何影响肿瘤进展的。科学技术的应用有助于发现在肿瘤发生、发展和转移过程中具有重要作用的新的代谢蛋白和代谢途径。
未来还有一些关键问题需要解决。
●如何利用成像、磁共振和质谱技术来检测小鼠癌症模型和癌症患者肿瘤微环境(TME)中的癌细胞和正常细胞的代谢异质性?
●与癌细胞相比,TME中非恶性细胞以及正常分化细胞的代谢和营养感应信号通路在发育、生理或不同病理过程中是如何发挥作用的?
●为什么琥珀酸盐、延胡索酸或D/L-2-羟基戊二酸(D/L-2HG)的积累仅在某些组织中发挥致瘤作用,以及这些肿瘤代谢物是如何改变基因表达?
●一些代谢酶如何通过非催化机制驱动肿瘤进展?
●哪些活性氧(ROS),即超氧物(O2-)、过氧化氢(H2O2)、羟基自由基(-OH)和脂质过氧化氢(LOOH),促进或抑制肿瘤的发生和发展?相关ROS靶点是什么?
●组织来源、驱动突变和TME造成的体内代谢脆弱性是什么?
●是否存在不参与合成代谢途径的不同代谢物促进转移性侵袭性细胞表型和转移性休眠?当癌细胞通过循环系统和淋巴系统时,其代谢如何改变以支持细胞存活,最终导致癌细胞在远端定植?
●宿主的机体代谢如何控制肿瘤的发生和发展?不同的癌细胞在体内利用哪些碳燃料?
●如何将靶向代谢途径与癌症遗传学、饮食和/或标准护理疗法(如免疫疗法)最佳结合?为什么目前针对代谢的有效疗法,例如5-氟尿嘧啶(5-FU)对一些患者有效而对另一些患者无效?

百度浏览 来源 : 中洪博元生物
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)